Химия. 10 класс
Конспект урока
Химия, 10 класс
Урок № 3 Непредельные углеводороды – алкены
Перечень вопросов, рассматриваемых в теме
Урок посвящён непредельным углеводородам, их номенклатуре, физическим и химическим свойствам, а также роли в жизни человека. В ходе урока учащиеся познакомятся с представителями данного класса органических веществ.
Алкены – непредельные углеводороды ряда этилена, имеющие одну двойную углерод-углеродную связь
Гибридизация – процесс взаимодействия разных, но близких по энергии электронных орбиталей, приводящий к их выравниванию по форме и энергии.
Гомология – явление сходства по составу, строению, химическим свойствам и принадлежности к тому же классу одного вещества с другим веществом, но различающиеся дуг от друга на одну или несколько групп СН2. Группу СН2 называют гомологической разностью.
Горение – быстро протекающий процесс окисления вещества, сопровождающийся большим выделением тепла и ярким свечением.
Полимеризация – реакция, при которой одинаковые молекулы соединяются между собой в более крупную молекулу
Изомерия – явление существования веществ, одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и вследствие этого по физическим и химическим свойствам. Такие вещества называются изомерами.
Формула структурная – изображение молекулы, в котором показан порядок связывания атомов между собой. Химические связи в таких формулах обозначаются черточками.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода имеется одна двойная углерод-углеродная связь. Общая формула алкенов СnH2n, где n≥2.
Простейшим представителем алкенов является этен, или этилен С2Н4.
Структурная формула этилена:

Особенности пространственного и электронного строения алкенов на примере молекулы этилена
Рассмотрим особенности электронного и пространственного строения алкенов на примере молекулы этилена. Все атомы углерода в молекуле этилена находятся в состоянии sp 2 -гибридизации. Три гибридных орбитали участвуют в образовании трех достаточно прочных сигма связей (по две связи у каждого атома углерода с атомами водорода и одна общая между собой). Оставшаяся негибридная р-орбиталь образует менее прочную пи-связь между атомами углерода. Таким образом, в молекуле этилена присутствуют 5 сигма-связей и одна пи-связь, причем двойная связь между атомами углерода образована одной сигма и и одно пи-связями. Наличие пи-связей в молекулах алкенов делает невозможным вращение атомов углерода друг относительно друга (имеются ввиду те атомы, при которых находится двойная связь)
Каждый атом углерода в молекуле этилена имеет треугольное строение.
Номенклатура алкенов
Особенности номенклатуры алкенов заключаются в следующем:
1. Нумерация углеродной цепи начинается с того конца, где ближе расположена двойная связь
2. В конце названия изменяется суффикс -ан соответствующего предельного углеводорода на -ен или -илен, и, если это необходимо, указывается атом углерода, при котором находится двойная связь

1. Нумерация главной цепи начинается слева направо, так как двойная связь ближе к левой части молекулы.
2. Называем радикал, расположенный у второго атома углерода: 2-метил
3. В главной цепи находится четыре атома углерода, следовательно, она соответствует предельному углеводороду – бутану.
4. Так как присутствует двойная связь, то суффикс – ан меняется на суффикс -ен и указывается положение двойной связи: бутен-1.
5. Соединяем суффикc с корнем и получаем название 2-матилбутен-1.
Гомология алкенов и изомерия алкенов.
Ближайшие гомологи этилена:
Для алкенов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Изомерия положения кратной связи
3. Пространственная геометрическая изомерия
4. Межклассовая (с циклоалканами)
Рассмотрим каждый вид изомерии на примере вещества состава С4Н8:
При построении структурной формулы данного вещества возможно расположение двойной связи как между первым и вторым атомами углерода, так и между вторым и третьим, тогда возможно получить две структурные формулы

Данный вид изомерии называется изомерией положения кратных связей.
Для данного вещества возможно построить единственный разветвлённый изомер – изомер углеродного скелета – 2-метилпропен:

Межклассовый изомер бутена – циклобутан:

Также для бутена-2 возможно существование геометрических изомеров, это связано с тем, что метильная группа СН3 – может располагаться относительно плоскости двойной связи в двух разных положениях, что приводит к образованию цис- (если эти группы расположены по одну линию связи) и транс-изомеров (если метильные группы расположены по разные линии связи):

Физические свойства алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде. Пропен и бутен – также газы. От пентена до октадецена – жидкости. Остальные – твердые вещества. Все агрегатные состояния указаны при нормальных условиях.
Способы получения алкенов
1. Внутримолекулярная дегидратация спиртов:
Данный способ является основным способом получения этилена в лабораторных условиях. Реакция протекает при температуре выше 140 градусов и в присутствии концентрированной серной кислоты, выполняющей роль катализатора. При дегидратации этанола получают этилен, а при дегидратации пропанола – пропилен:

2. Дегидрирование предельных углеводородов.
Данная реакция протекает при нагревании в присутствии катализаторов: никеля, платины, оксида хрома (III). При этом получают соответствующие алкены:

Химические свойства алкенов
Химические свойства алкенов обусловлены наличием в их молекулах двойных углерод-углеродных связей. Дело в том, что пи-связь, как было сказано ранее, является менее устойчивой, чем сигма связь. Поэтому при атаке её каким-либо реагентом она легко разрывается. Это объясняет основные химические свойства алкенов: они способны вступать в реакции присоединения и окисления.
Реакции присоединения
Гидрирование – присоединение водорода
Протекает при нагревании в присутствии катализаторов: платина, никель, оксид хрома (III). Продуктом реакции всегда является алкан.
Галогенирование – присоединение галогенов
Реакция протекает при обычных условиях. Продукт реакции – дигалогеналкан (1,2 – дибромэтан)
Признак реакции – обесцвечивание раствора брома, поэтому данную реакцию используют как качественную на двойную связь.
Гидрогалогенирование – присоединение галогенводородов
Продукт реакции – галогеналкан (хлорэтан)
Гидратация – присоединение воды
Продукт реакции – спирт
Реакция полимеризации
Полимеризация – реакция, при которой одинаковые молекулы соединяются в более крупные молекулы.
Условия реакции – высокая температура и давление
Продукт реакции – полимер (полиэтилен)
Продукты реакции полимеризации используются для производства пластмасс и синтетических волокон
«Мягкое» – реакция Вагнера: взаимодействие с водным раствором перманганата калия
Продукт реакции – многоатомный спирт (этиленгликоль)
Признак реакции – обесцвечивание раствора перманганата калия , поэтому данную реакцию используют как качественную на двойную связь.
Каталитическое – окисление кислородом в присутствии катализаторов
Продукт реакции – оксид алкена (оксид этилена)
Продуктами полного горения алкенов являются углекислый газ и вода
Особенности реакций гидрогалогенирования и гидратации у пропилена и других гомологов этилена
Реакции присоединения галогеналканов и воды у гомологов этилена протекают по правилу Марковникова: водород присоединяется по месту разрыва двойной связи к более гидрированному атому углерода. Например, при присоединении хлороводорода к молекуле пропилена, образуется не 1-хлорпропан, а 2-хлорпропан:

Аналогично протекает реакция гидратации:

Применение этилена и его соединений
Производство пластмасс, взрывчатых веществ, антифриза, растворителей, синтетического каучука, ацетальдегида, для ускорения созревания плодов.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ ТРЕНИРОВОЧНОГО МОДУЛЯ
- Решение задачи на нахождение массы раствора.
Масса 2%-го раствора бромной воды, которая вступает в реакцию с 2,24 л пропилена равна
Шаг первый: Составляем уравнение химической реакции С2Н4 + Br2 = C2H4Br2
Шаг второй: Находим количество вещества пропилена по формуле n=VVm= 2,24 л / 22,4 л/моль = 0,1 моль
Шаг третий: По уравнению реакции количество вещества пропилена равно количеству вещества брома: n(С2Н4)=n(Br2)=0,1 моль
Шаг четвёртый: Находим массу брома по формуле: m=Mn=160 г/моль*0,1 моль= 16 г
Шаг пятый: Находим массу раствора бромной воды по формуле: m (раствора)=m/ω = 16г / 0,02 = 800г
- Решение упражнения на химические свойства алкенов
Вставьте в таблицу пропущенные продукты реакции
Варианты ответов: этан, пропан, бутан, 1,2-дибромэтан, 1,2-дибромпропан, 1,3-дибромпропан, этанол, пропанол-1, пропанол-2, хлорэтан, 1-хлорпропан, 2-хлорпропан.
Первый шаг: При гидрировании алкенов водородом образуются предельные углеводороды – алканы с соответствующим числом атомов углерода. Поэтому первая колонка заполняется продуктами реакции – этан и пропан:

Второй шаг: При галогенировании алкенов галогены, в данном случае бром, присоединяются по месту разрыва двойной связи, образуя дигалогенпроизводные, например:

Поэтому второй столбец заполняется следующими веществами: 1,2-дибромэтан, 1,2-дибромпропан.
Третий шаг: При гидратации (присоединении воды) образуются спирты. При реакции пропилена с водой важно помнить о правиле Марковникова, поэтому продуктами реакции будут этанол и пропанол-2:
4. При гидрогалогенировании алкенов продуктом реакции будут галогеналканы. И опять нужно помнить о правиле Марковникова для гидрогалогенирования пропилена:
Поэтому правильный ответ в этом задании: хлорэтан и 2-хлорпропан
Алкены

Общая характеристика
Алкены – класс органических соединений, имеющий двойную связь между атомами углерода, структурная формула – CnH2n. Двойная связь в молекулах олефинов – это одна σ- и одна π-связь. Таким образом, если мы представим два атома углерода и разместим их на плоскости, σ-связь будет расположена на плоскости, а π-связь будет распологаться выше и ниже плоскости (если Вы плохо представляете себе, о чём идёт речь, обратитесь к разделу химические связи).
Гибридизация
В алкенах имеет место sp 2 -гибридизация, для которой угол H-C-H составляет 120 градусов, а длина связи C=C равна 0,134 нм.
Строение
Из наличия π-связи следует, и подтверждается экспериментально, что:
- По своему строению, двойная связь в молекулах алкенов более восприимчива к внешнему воздействию, нежели обычная σ-связь
- Двойная связь делает невозможным вращение вокруг σ-связи, откуда следует наличие изомеров, данные изомеры называются цис- и транс-
- π-связь менее прочна, чем σ-связь, поскольку электроны находятся дальше от центров атомов
Физические свойства
Физические свойства алкенов схожи с физическими свойствами алканов. Алкены, имеющие до пяти атомов углерода, находятся в газообразном состоянии при нормальных условиях. Молекулы с содержанием от шести до 16 атомов углерода находятся в жидком состоянии и от 17 атомов углерода – алкены находятся в твёрдом состоянии при нормальных условиях.
Температура кипения алкенов в среднем увеличивается на 30 градусов на каждую CH2-группу, как и у алканов, ответвления снижают температуру кипения вещества.
Наличие π-связи делает олефины слаборастворимыми в воде, что обуславливает их небольшую полярность. Алкены – неполярные вещества и растворяются в неполярных растворителях и слабо полярных растворителях.
Плотность алкенов выше, чем у алканов, но ниже чем у воды
Изомерия
- Изомерия углеродного скелета: 1-бутен и 2-метилпропен
- Изомерия положения двойной связи: 1-бутен и 2-бутен
- Межклассовая изомерия: 1-бутен и циклобутан
Реакции
Характерные реакции алкенов – реакции присоединения, π-связь разрывается и образовавшиеся электроны охотно принимают новый элемент. Наличие π-связи означает большее количество энергии, поэтому, как правило, реакции присоединения носят экзотермический характер, т.е. протекают с выделением тепла.
Реакции присоединения
Присоединение галогенводородов
Галогенводороды легко присоединяются к двойной связи алкенов, формируя галогеналкилы. Галогенводороды смешивают с уксусной кислотой, либо напрямую, в газообразном состоянии, смешивают с алкеном. Для рассмотрения механизма реакции, необходимо знать правило Марковникова.
Правило Марковникова
При взаимодествии гомологов этилена с кислотами, водород присоединяется к более гидрогенизированному атому углерода.
Исключение из правила, гидроборирование алкинов, будет рассмотрено в статье об алкинах.
Механизм реакции присоединения галогенводородов к алкенам следующий: происходит гомолитический разрыв связи в молекуле галогенводорода, образовывается протон и анион галогена. Протон присоединяется к алкену образуя карбкатион, такая реакция является эндотермической и имеет высокий уровень энергии активации, поэтому реакция происходит медленно. Образованный карбкатион очень реактивен, поэтому легко связывается с галогеном, энергия активации низкая, поэтому этот этап не тормозит реакцию.
Галогенирование
При комнатной температуре алкены реагируют с хлором и бромом в присутствии тетрахлорметана. Механизм реакции присоединения галогенов выглядит следующим образом: электроны с π-связи воздействуют на молекулу галогена X2. По мере приближения галогена к олефину, электроны в молекуле галогена смещаются к более отдалённому атому, таким образом молекула галогена поляризуется, ближайший атом имеет положительный заряд, более удалённый – отрицательный. Происходит гетеролитический разрыв связи в молекуле галогена, образуется катион и анион. Катион галогена присоединяется к двум атомам углерода посредством электронной пары π-связи и свободной электронной пары катиона. Оставшийся анион галогена воздействует на один из атомов углерода в молекуле галогеналкена разрывая цикл C-C-X и образовывая дигалогеналкен.
Реакции присоединения алкенов находят два основных применения, первое – количественный анализ, определение количества двойных связей количеством поглощенных молекул X2. Второе – в промышленности. Производство пластика основано на винилхлориде. Трихлорэтилен и тетрахлорэтилен – отличные растворители ацетиленовых жиров и резин.
Гидрирование
Присоединение газообразного водорода к алкену происходит с катализаторами Pt, Pd или Ni. В результате реакции образуются алканы. Основное применение реакции каталитического присоединения водорода – это, во-первых, количественный анализ. По остатку молекул H2 можно определить количество двойных связей в веществе. Во-вторых, растительные жиры и жиры рыб являются непредельными углеродами и такое гидрирование приводит к увеличению температуры плавления, преобразуя в твёрдые жиры. На данном процессе основано производство маргарина.
Гидратация
При смешивании алкенов с серной кислотой образуются алкил-гидросульфаты. При разбавлении алкил-гидросульфатов водой и сопутствующем нагревании, образуется спирт. Пример реакции – смешивание этена (этилен) с серной кислотой, последующее смешивание с водой и нагревание, результат – этанол.
Окисление
Алкены легко окисляются различными веществами, такими как, например, KMnO4, O3, OsO4 и т.д. Существует два вида окисления алкенов: разрыв π-связи без разрыва σ-связи и разрыв σ- и π-связи. Окисление без разрыва сигма-связи называется мягким окислением, с разрывом сигма-связи – жёстким окислением.
Окисление этена без разрыва σ-связи образует эпоксиды (эпоксиды – это циклические соединения C-C-O) или двухатомные спирты. Окисление с разрывом σ-связи образует ацетоны, альдегиды и карбоновые кислоты.
Окисление перманганатом калия
Реакции окисления алкенов под воздействием перманганата калия называются были открыты Егором Вагнером и носит его имя. В реакции Вагнера, окисление происходит в органическом растворителе (ацетон или этанол) при температуре 0-10°C, в слабом растворе перманганата калия. В результате реакции образуются двуатомные спирты и обесцвечивается перманганат калия.
Полимеризация
Большинство простых алкенов могут испытывать реакции самоприсоединения, формируя таким образом большие молекулы из структурных единиц. Такие большие молекулы называются полимерами, реакция, которая позволяет получить полимер называется полимеризацией. Простые структурные единицы, образующие полимеры, называются мономерами. Полимер обозначается заключением повторяющейся группы в скобках с указанием индекса “n”, что означает большое количество повторений, например: “-(CH2-CH2)n-” – полиэтилен. Процессы полимеризации – основа производства пластика и волокон.
Радикальная полимеризация
Радикальная полимеризация инициируется при помощи катализатора – кислорода или пероксида. Реакция состоит из трёх этапов:
Ионная полимеризация
Другой способ полимеризации алкенов – это ионная полимеризация. Реакция протекает с образованием промежуточных продуктов – карбкатионов и карбанионов. Образование первого карбкатиона, как правило, осуществляется при помощи кислоты Льюиса, образование карбаниона происходит, соответственно, при реакции с основанием Льюиса.
Распространённые полимеры
Наиболее распространёнными полимерами являются:
| Мономер | Формула | Полимер |
|---|---|---|
| Этен | H2C=CH2 | Полиэтилен |
| Хлороэтилен (винилхлорид) | H2C=CHCl | Поливинилхлорид (ПВХ) |
| Фенилэтен | F2C=CF2 | Тефлон |
| Пропеннитрил (полиакрилонитрил) | H2C=CH-C≡N | Нитрон |
| Метилметакрилат | CH2=C(CH3)-COOCH3 | Оргстекло |
| Таблица 1. Распространённые полимеры | ||
Номенклатура
Название алкенов, аналогично алканам, состоит из первой части – префикса, обозначающего количество атомов углерода в главной цепи, и суффикса -ен. Алкен – соединение с двойной связью, поэтому молекулы алкена начинаются с двух атомов углерода. Первый в списке – этен, эт- – два атома углерода, -ен – наличие двойной связи.
Если в молекуле более трёх атомов углерода, то необходимо указывать позицию двойной связи, например, бутен может быть двух видов:
Для обозначения позиции двойной связи, необходимо добавить цифру, для примера выше это будут 1-бутен и 2-бутен соответственно (также применяются названия 1-бутен и 2-бутен, но они не являются систематическими).
Наличие двойной связи влечёт за собой изомерию, когда молекулы могут находится по разные стороны от двойной связи, например:
Данная изомерия именуется цис- (Z-zusammen, с немецкого вместе) и транс- (E-entgegen, с немецкого напротив), в первом случае цис-1,2-дихлорэтен (или (Z)-1,2-дихлорэтен), во втором – транс-1,2-дихлорэтен (или (E)-1,2-дихлорэтен).
Как выглядят молекулы алкенов
Нажмите на молекулу в списке и 3D-модель появится в чёрном окне
Калий: способы получения и химические свойства
Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
Способ получения
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Качественная реакция
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет .

Химические свойства
1. Калий — сильный восстановитель . Поэтому он реагирует почти со всеми неметаллами :
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом . При этом образуются фторид калия, хлорид калия, бромид калия, йодид калия :
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой . Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K 0 + 2 H2 O = 2 K + OH + H2 0
2.2. Калий взаимодействует с кислотами . При этом образуются соль и водород.
2.2.1. Ка лий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород :
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной с ерной кислотой образуется сульфат калия, сероводород и вода:
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком , при этом образуются амид натрия и водород:
2.4. Калий может взаимодействовать с гидроксидами:
Например , Калий взаимодействует с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Калий
Серебристо-белый мягкий металл 
39,0983 а. е. м. (г/моль)
418,5 (4,34) кДж/моль (эВ)
| K | 19 |
| 39,0983 | |
| 4s 1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium ; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K
2Cl − − 2e − → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH − − 4e − → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
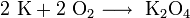
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
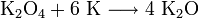
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
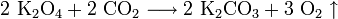
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Калий — характеристика химического элемента и основные свойства



| Калий | |
| Атомный номер | 19 |
| Внешний вид простого вещества | Серебристо-белый мягкий металл |
| Свойства атома | |
| Атомная масса (молярная масса) | 39,0983 а. е. м. (г/моль) |
| Радиус атома | 235 пм |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность (по Полингу) | 0,82 |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Термодинамические свойства простого вещества | |
| Плотность | 0,856 г/см³ |
| Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления | 336,8 K |
| Теплота плавления | 102,5 кДж/моль |
| Температура кипения | 1047 K |
| Теплота испарения | 2,33 кДж/моль |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмноцентрированная |
| Параметры решётки | 5,332 |
| Отношение c/a | — |
| Температура Дебая | 100 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
— элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий»
(лат.
potassium
; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат.
kalium
, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента —
K
.
История открытия
Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
Примерная молярная масса 39,1 г/моль.
Электронная конфигурация калия 1s22s22p63s23p64s1

Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений». И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И. Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Свойства калия (таблица): температура, плотность, давление и пр.:
Подробные сведения на сайте ChemicalStudy.ru

(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле)

205* Эмпирический радиус атома калия согласно [1] и [3] составляет 227 пм и 235 пм соответственно.
206* Ковалентный радиус калия согласно [1] составляет 203±12 пм.
401* Плотность калия согласно [3] составляет 0,856 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело), согласно [4] 0,826 г/см3 (при 64 °C и иных стандартных условиях, состояние вещества – жидкость).
402* Температура плавления калия согласно [3] и [4] составляет 63,65 °C (336,8 K, 146,57 °F) и 63,55 °C (336,7 K, 146,39 °F) соответственно.
403* Температура кипения калия согласно [3] и [4] составляет 773,85 °C (1047 K, 1424,93 °F) и 776 °C (1049,15 K, 1428,8 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) калия согласно [4] составляет 2,38 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) калия согласно [4] составляет 79,2 кДж/моль.
Калий в природе

После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде. Минералы, формулы которых могут «похвастаться» большим содержанием этого элемента:
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Химические характеристики

Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними. Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C. Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.



Свойства атома калия:
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 39,0983(1) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 4s1 |
| 203 | Электронная оболочка | K2 L8 M8 N1 O0 P0 Q0 R0 |
| 204 | Радиус атома (вычисленный) | 243 пм |
| 205 | Эмпирический радиус атома* | 220 пм |
| 206 | Ковалентный радиус* | 203 пм |
| 207 | Радиус иона (кристаллический) | K+ 151 (4) пм, |
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле)
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Калий

Калий – химический элемент, играющий большую роль в жизни растений. По степени необходимости стоит в одном ряду с азотом и фосфором. Распространен в природе достаточно широко. Встречается только в виде соединений. Является действующим веществом сырых калийных солей и концентрированных калийных удобрений. Применяется под все сельскохозяйственные культуры в качестве основного, припосевного удобрения и подкормки.

Содержание:
- Физические и химические свойства
- Содержание в природе
- Формы доступности калия в почве
- Содержание калия в различных типах почв
- Осадочные горные породы
- Тяжелые глинистые почвы
- Суглинистые почвы
- Бедные песчаные почвы
- Дерново-подзолистые почвы
- Роль в растении
- Биохимические функции
- Ткани и органеллы растений, содержащие калий
- Элемент молодости
- Физиологические функции
- Недостаток (дефицит) калия в растениях
- Избыток калия
- Содержание калия в различных соединениях
- Калийсодержащие минералы промышленного значения
- Калийные удобрения
- Сырые калийные соли
- Сильвинит
- Каинит
- Концентрированные калийные удобрения
- Хлористый калий, хлорид калия, КО
- 40%-ная калийная соль
- Сульфат калия
- Калимагнезия, сульфат калия-магния (шенит
- Калимаг, калийно-магнезиальный концентрат
- Хлоркалий электролит
- Цементная пыль
- Печная зола
- Свежий навоз на соломенной подстилке
- Способы применения
- Применение калийных удобрений, в зависимости от типа почвы
- Взаимодействие с другими удобрениями
- Способы внесения
- Эффект от применения калийных удобрений
Когда-то зола была весьма ценным химическим продуктом, потому что из нее люди получали первое в мире моющее средство, нагревая ее в воде и получая при этом мылкий раствор, используемый при стирке и в других целях. Такая «особая» зола, образующаяся только при сжигании древесины, камыша, соломы или папоротника, даже имела свое название – поташ, или кали. Она содержала карбонат калия, который и придавал ей ценные свойства.
В нашей стране еще в XIвеке производство поташа было довольно совершенным. Люди использовали уже не обыкновенную золу, а выпаренный раствор, образующийся при ее кипячении. Перед выпариванием его фильтровали для отделения частиц чистого угля и других примесей. В результате формировались ломкие кусочки серого цвета, состоящие из карбоната, сульфата, хлорида калия и соды. Несмотря на свою невзрачность, этот результат химических превращений всегда был в ходу и продавался за немалую цену, так как аналогов ему тогда не существовало.
Долгое время люди не догадывались, что основным компонентом средневекового «мыла» был новый химический элемент. И только в 1807 году Гемфри Дэви, проведя электролиз щелочи КОН, выделил из нее металлический калий. Его отнесли к группе щелочных, или, как их еще называли, «яростных» металлов, отличающихся высокой химической активностью. Позже калий был обнаружен и в составе других веществ, а также послужил основой для получения множества соединений, ныне повсеместно используемых человеком. Например, он является составляющей жидкого мыла, которое не идет ни в какое сравнение со средством, используемым несколько веков назад. [5]

Калий

Физические и химические свойства
Калий (Kalium), K – химический элемент главной подгруппы I группы периодической системы Менделеева. Атомный номер – 19. Атомная масса – 39,10.
Калий – типичный щелочной металл серебристо-белого цвета. Он быстро окисляется на воздухе и бурно реагирует с водой, загорается при небольшом нагревании. Реакция с водой сопровождается выделением водорода. Энергично взаимодействует с галогенами, особенно с хлором и фтором.
- Температура плавления – 63,5°C,
- Температура кипения – 771°C,
- Плотность – 0,86 г/см 3 . [2]
Содержание в природе
Калий принадлежит к распространенным элементам. Металл входит в состав различных минералов и горных пород силикатного типа. В верхних слоях мощных отложений каменной соли иногда содержатся значительные количества калия, преимущественно в виде хлоридов или двойных солей с магнием и натрием. Однако же большие скопления солей калия промышленного значения встречаются редко. В воде многих озер содержится сода. [2]
Калий присутствует почти во всех тканях и органах растений, часто в неодинаковых количествах. В соломе зерновых культур его больше, чем в зерне. В клубнях картофеля – меньше, чем в ботве. Богаты содержанием калия молодые растения, в которых все клетки энергично делятся. Максимальное накопление калия в растении совпадает с периодом цветения. [1]
Формы доступности калия в почве
Запасы калия там гораздо больше, чем запасы азота и фосфора. Содержание валового калия колеблется от 0,5 до 4 % и зависит от гранулометрического состава почв. Чем больше глинистых частиц в почве, тем больше в ней калийных соединений.
По степени подвижности, а значит, и доступности растениям соединения калия подразделяют на:
- Калий почвенного раствора (водорастворимый). Состоит из различных солей. Данная форма легко усваивается растениями, но ее содержание незначительно (1–20 мг/кг почвы) и не может характеризовать обеспеченность растений калийными соединениями.
- Калий поглощенный (обменный). Входит в состав катионов поглощающего почвенного комплекса. Обменный калий легко переходит в раствор почвы. Этим и обусловлена его легкая доступность растениям. Разграничение обменной и водорастворимых форм достаточно условно, поскольку, в зависимости от условий окружающей среды (температуры, влажности и т. д.), содержание водорастворимого калия уменьшается или увеличивается за счет обменного.
- Калий необменный (фиксированный). Не экстрагируется из почвы растворами слабых кислот и нейтральных солей, включает в себя фиксированный природный и искусственно фиксированный калий. Природный фиксированный калий – калий, удерживаемый в решетке глинистых минералов. Искусственно фиксированный калий расположен в межпакетных пространствах кристаллической решетки. Он используется растениями лучше, чем природный фиксированный.
- Калий, входящий в состав безводных силикатов. Находится в составе минералов алюмосиликатов (полевых шпатов и слюд), труднорастворим.
- Калий в составе плазмы микроорганизмов. Практического значения в питании растении почти не имеет в связи с малым количеством.
Формы калия в почве не постоянны и могут переходить друг в друга. [1]
Валовое содержание калия в почве не всегда способно точно характеризовать обеспеченность растений калием, поскольку в почве может содержаться только около 1 % валовых запасов, доступных растениям. В связи с этим, об обеспеченности калием на разных типах почв судят не по общему (валовому) проценту его содержания, а по соотношению между его формами.
Содержание калия в различных типах почв
Валовое содержание калия в почве определяется и характером материнской породы.
Калий — характеристика химического элемента и основные свойства



История открытия
Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
Примерная молярная масса 39,1 г/моль.
Электронная конфигурация калия 1s22s22p63s23p64s1

Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений». И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И. Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Калий, свойства атома, химические и физические свойства.
39,0983(1) 1s2 2s2 2p6 3s2 3p6 4s1
Калий — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 19. Расположен в 1-й группе (по старой классификации — главной подгруппе первой группы), четвертом периоде периодической системы.
Атом и молекула калия. Формула калия. Строение калия
Изотопы и модификации калия
Свойства калия (таблица): температура, плотность, давление и пр.
Физические свойства калия
Химические свойства калия. Взаимодействие калия. Реакции с калием
Таблица химических элементов Д.И. Менделеева
Калий в природе

После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде. Минералы, формулы которых могут «похвастаться» большим содержанием этого элемента:
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Характеристика химического элемента КАЛИЯ
Характеристика химического элемента КАЛИЯ
Калий — обозначается символом K — химический элемент I группы периодической системы Менделеева;
- атомный номер 19,
- атомная масса 39,098;
Калий — серебристо-белый, очень легкий, мягкий и легкоплавкий металл.
Элемент состоит из двух стабильных изотопов — 39K (93,08%), 41K (6,91%) и одного слабо радиоактивного 40K (0,01%) с периодом полураспада 1,32·109 лет.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так: +19К: 2ё; 8ё; 8ё; 1ё.
Исходя из строения атома, можно предсказать степень окислени С1 калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.

Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Nа к Rb.
Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +H2O;
В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
Летучего водородного соединения калий не образует, а образует гидрид калия КН
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
Химические характеристики

Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними. Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C. Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Калий: способы получения и химические свойства
Калий К — это щелочной металл. Серебристо-белый, мягкий, легкоплавкий.
Относительная молекулярная масса Mr = 39,098; относительная плотность для твердого состояния d = 0,8629; относительная плотность для жидкого состояния d = 0,83; tпл = 63, 51º C; tкип = 760º C.
1. Калий получают в промышленности путем разложения гидрида калия при температуре 400º С в вакууме, при этом образуются калий и водород :
2KH = 2K + H2
2. В результате электролиза жидкого гидроксида калия образуются калий, кислород и вода :
4KOH → 4K + O2↑ + 2H2O
Качественная реакция на калий — окрашивание пламени солями калия в фиолетовый цвет.

1. Калий — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. Калий легко реагирует с водородом при 200–350º C образованием гидрида калия:
2K + H2 = 2KH
1.2. Калий сгорает в кислороде с образованием надпероксида калия:
K + O2 = KO2
1.3. Калий активно реагирует при комнатной температуре с фтором, хлором, бромом и йодом
. При этом образуются
фторид калия, хлорид калия, бромид калия, йодид калия:
2K + F2 = 2KF
2K + Cl2 = 2KCl
2K + Br2 = 2KBr
2K + I2 = 2KI
1.4. С серой, теллуром и селеном реагирует при температуре 100–200º C с образованием сульфида калия, селенида калия и теллурид калия :
2K + S = K2S
2K + Se = K2Se
2K + Te = K2Te
1.5. Калий реагирует с фосфором при 200º C в атмосфере аргона с образованием фосфида калия:
3K + P = K3P
2. Калий активно взаимодействует со сложными веществами:
2.1. Калий реагирует с водой. Взаимодействие натрия с водой приводит к образованию щелочи и газа водорода:
2K0 + 2H2O = 2K+OH + H20
2.2. Калий взаимодействует с кислотами. При этом образуются соль и водород.
2.2.1. Калий реагирует с разбавленной соляной кислотой, при этом образуются хлорид калия и водород:
2K + 2HCl = 2KCl + H2 ↑
2.2.2. При взаимодействии с разбавленной серной кислотой образуется сульфат калия, сероводород и вода:
8K + 5H2SO4 = 4K2SO4 + H2S + 4H2O
2.2.3. Реагируя с азотной кислотой калий образует нитрат калия, можно образовать газ оксид азота (II), газ оксид азота (I), газ азот и воду.
2.2.4. В результате реакции насыщенной сероводородной кислоты и калия в бензоле образуется осадок гидросульфид калия и газ водород:
2K + 2H2S = 2KHS↓ + H2↑
2.3. Калий при температуре 65–105º C может реагировать с аммиаком, при этом образуются амид натрия и водород:
2K + 2NH3 = 2KNH2 + H2 ↑
2.4. Калий может взаимодействовать с гидроксидами:
Например, Калий
взаимодействует
с гидроксидом калия при температуре 450º С, при этом образуется оксид калия и водород:
2K + 2KOH = 2K2O + H2
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Физические свойства
Калий — серебристо-белый, лёгкий, мягкий и легкоплавкий металл. Кристаллическая решётка кубическая, объёмноцентрированная, параметр а=0,522±2 нМ при 5К и а=0,5247±2 нМ при 78К.
Физические свойства калия: плотность 862,9 кг/м3 (0°С); t плавления 63,55°С; t кипения 760°С; коэффициент теплопроводности (при 21°С) 97,13 Вт/м•К; удельная теплоёмкость (при 20°С) 741,2 Дж/кг•К; удельное электрическое сопротивление (при 20°С) 7,118•10-8 Ом•м; твёрдость по Бринеллю 400 кПа. Металлический калий легко режется ножом. Степень окисления +1. Калий на воздухе легко окисляется, образуя оксид К2О и надпероксид KO2. Хранят калий в бензине или керосине. С водой он легко реагирует с образованием гидрооксида KOH и выделением водорода. При взаимодействии с водными растворами кислот образует хорошо растворимые соли. При температуре выше 200°С реагирует с водородом с образованием белых кристаллов KH. При нагревании с серой, теллуром, селеном образует сульфид К2S, теллурид К2Te, селенид К2Se. Известны также различные карбиды, силициды, арсениды и фосфиды калия.


