Ионное произведение воды. Водородный показатель
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
Равновесие процесса диссоциации воды:
Н2О ↔ Н + + ОН —
описывается константой Кw, которая носит название “ионное произведение воды”. Ионное произведение воды равно:
Кw = [Н + ] [ОН — ] (1)
Для разбавленных водных растворов ионное произведение воды не зависит от состава раствора и постоянно при данной температуре. Так, Кw=10 — 14 для воды, миллимолярных растворов К2SO4, H2SO4 и KOH при Т=298 К. Строго говоря, постоянство Кw справедливо в случае, когда аналитические концентрации ионов заменены их активностями (лишь для малых концентраций Н + и ОН — значения концентрации и активности практически совпадают).
Процесс диссоциации Н2О идет с поглощением теплоты, поэтому при повышении температуры в интервале от 0 до 100 о С величина Кw увеличивается.
Для практических целей удобно пользоваться не концентрацией ионов водорода, а её водородным показателем – отрицательным десятичным логарифмом – рН. Величина рН равна:
рН = — lg[H + ]. (2)
Как выше отмечалось, более строгим является уравнение рН = – lg aН+, где aН+ – активность ионов водорода. Однако для практических целей при расчете рН разбавленных растворов обычно используется уравнение (2).
рН + рОН = 14, (3)
Для нейтральных растворов рН = 7, для кислых растворов рН 7. В аналитической практике редко приходится работать с растворами, рН которых выходит из интервала 0 ÷14. Тем не менее, в сильнощелочной среде рН может быть немного больше 14, а в очень кислой среде может принимать отрицательные значения.
Примеры решения задач
Задача 1. Вычислите рН 0,001М растворов HСl и КОН.
Решение. HСl и КОН являются сильными электролитами и в разбавленных растворах практически полностью диссоциируют на ионы. В растворе НСl: [Н + ] = 0,001 моль/л.
рН = –lg [H + ] = –lg 0,001 = 3
В растворе КОН: [ОН – ] = 0,001 моль/л. рОН = –lg [ОH — ] = –lg 0,001 = 3. рН=14 – 3 = 11.
Задача 2. Рассчитайте рН раствора КОН, 350 мл которого содержат 0,0035 моль КОН.
Решение.
КОН → К + + ОН —
рОН = –lg [ОH — ] = –lg 0,01 = 2.
рОН + рН = 14. рН = 14 – 2 = 12
или [Н + ] = 10 –14 /[ОН – ] = 10 –14 /0,01 = 10 –12 моль/л.
рН = –lg 10 –12 = 12.
Задача 3. Вычислите молярную концентрацию раствора Ba(OH)2, если рН раствора составляет 12 при 298 К.
Решение.
Ba(OH)2 → Ва 2+ + 2ОН –
-lg [ОH – ] = 2, откуда [ОH – ] = 0,01 М.
Задача 4. Рассчитайте степень диссоциации и рН 0,01 М водного раствора аммиака при 298 К, если константа диссоциации NH4OH при указанной температуре равна 1,76·10 –5 .
Решение.
NH3 H2O ⇔ NH4 + + OH — или упрощенно: NH4ОH ⇔ NH4 + + OH —
[Н + ] = 10 -14 /[ОН — ] = 10 -14 /4,2·10 -4 = 2,4·10 -11 моль/л.
рН = –lg [H + ] = –lg 2,4·10 –11 = 10,6.
Задача 5. К 1 л 0,01М раствора CH3CОOH добавили 6 г СН3СООNa. Определите рН полученного раствора при Т = 298 К, если при указанной температуре Кд(CH3CОOH) = 1,75·10 –5 .
Решение.
Присутствие в растворе CH3CОOH сильного электролита СН3СООNa приводит к сдвигу равновесия диссоциации уксусной кислоты влево в силу действия принципа Ле Шателье. В результате степень диссоциации уксусной кислоты уменьшается.
n(СН3СООNa) = 6:82 = 0,073 моль.
(считаем, что объем раствора после добавления 6 г СН3СООNa не изменился).
Ацетат–ионы в растворе образуются как за счет диссоциации уксусной кислоты:
CH3CОOH ⇔ СН3СОО – + Н + ,

так и за счет диссоциации СН3СООNa:
СН3СООNa → СН3СОО — + Na +
Поскольку СН3СООNa в растворе диссоциирует полностью, то концентрацией ацетат-ионов, образующихся при диссоциации уксусной кислоты можно пренебречь, так как она мала по сравнению с величиной 0,073 моль/л. Принимаем, что:
[H + ] = 1,75·10 –5 · 0,01 / 0,073 = 2,4·10 –6 моль/л.
рН = –lg2,4·10 –6 = 5,6.
Задачи для самостоятельного решения
1. Определите величину рН 0,0001 М раствора HCl.
Что такое ph в химии ℹ как рассчитать водородный показатель, как определить показатель ph раствора, шкала кислотности среды
Кислотно-щелочное равновесие.
Показатель pH и его влияние на качество питьевой воды.
Что такое pH?
pH («potentia hydrogeni» — сила водорода, или «pondus hydrogenii» — вес водорода) — это единица измерения активности ионов водорода в любом веществе, количественно выражающая его кислотность.
Данный термин появился в начале ХХ века в Дании. Показатель pH ввел датский химик Сорен Петр Лауриц Соренсен (1868-1939), хотя утверждения о некой «силе воды» встречаются и у его предшественников.
Активность водорода определяется как отрицательный десятичный логарифм концентрации водородных ионов, выраженной в молях на литр:
pH = -log[H+]
Для простоты и удобства при вычислениях был введен показатель pH. рН определяется количественным соотношением в воде ионов Н+ и ОН-, образующихся при диссоциации воды. Принято измерять уровень pH по 14-цифровой шкале.

Если в воде пониженное содержание свободных ионов водорода [H+] (рН больше 7) по сравнению с ионами гидроксида [ОН-], то вода будет иметь щелочную реакцию, а при повышенном содержании ионов Н+ (рН меньше 7) — кислую реакцию. В идеально чистой дистиллированной воде эти ионы будут уравновешивать друг друга.
кислая среда: [H+] > [OH-]
нейтральная среда: [H+] = [OH-]
щелочная среда: [OH-] > [H+]
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. В нейтральной воде показатель рН равен 7.
При растворении в воде различных химических веществ этот баланс изменяется, что приводит к изменению значения рН. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении щелочи — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает.
рН показатель отражает степень кислотности или щелочности среды, в то время как «кислотность» и «щелочность» характеризуют количественное содержание в воде веществ, способных нейтрализовывать соответственно щелочи и кислоты. В качестве аналогии можно привести пример с температурой, которая характеризует степень нагрева вещества, но не количество тепла. Опустив руку в воду, мы можем сказать какая вода — прохладная или теплая, но при этом не сможем определить сколько в ней тепла (т.е. условно говоря, как долго эта вода будет остывать).
pH считается одним из важнейших показателей качества питьевой воды. Он показывает кислотно-щелочное равновесие и влияет на то, как будут протекать химические и биологические процессы. В зависимости от величины pH может изменяться скорость протекания химических реакций, степень коррозионной агрессивности воды, токсичность загрязняющих веществ и т.д. От кислотно-щелочного равновесия среды нашего организма напрямую зависит наше самочувствие, настроение и здоровье.
Современный человек живет в загрязненной окружающей среде. Многие приобретают и употребляют пищу, изготовленную из полуфабрикатов. Кроме этого практически каждый человек ежедневно подвергается стрессовому воздействию. Все это оказывает влияние на кислотно-щелочное равновесие среды организма, смещая его в сторону кислот. Чай, кофе, пиво, газированные напитки снижают показатель pH в организме.
Считается, что кислая среда является одной из основных причин разрушения клеток и повреждения тканей, развития заболеваний и процессов старения, росту болезнетворных организмов. В кислой среде до клеток не доходит строительный материал, разрушается мембрана.
Кислая среда провоцирует множество заболеваний, среди которых сердечно-сосудистые заболевания, артрит, остеопороз, онкологические заболевания и др, а так же способствует развитию бактерий, вирусов, грибков, гельминтов и прочих паразитов. Паразиты предпочитают кислую среду обитания, и именно в кислотной среде они проявляют себя наиболее патогенно. Кислую среду в организме создают психические и физические перегрузки, мясо, пища, прошедшая глубокую термическую и иную технологическую обработку, снижающую содержание в ней полезных веществ. Эти же источники закисления наполняют организм свободными радикалами, которые перегружают иммунную систему. Один из признаков закисления организма — некомфортная сухость во рту.
Внешне о состоянии кислотно-щелочного равновесия крови человека можно судить по цвету его конъюнктивы в уголках глаз. При оптимальном кислотно-щелочном балансе цвет конъюнктивы ярко-розовый, если же у человека повышается щелочность крови, конъюнктива приобретает темно-розовый окрас, а при повышении кислотности окрас конъюнктивы становится бледно-розовым. При чем цвет конъюнктивы изменяется уже через 80 секунд после употребления веществ, влияющих на кислотно-щелочное равновесие.
Организм регулирует рН внутренних жидкостей, поддерживая значения на определенном уровне. Кислотно-щелочной баланс организма — это определенное соотношение кислот и щелочей, способствующее его нормальному функционированию. Кислотно-щелочной баланс зависит от сохранения относительно постоянных пропорций между межклеточными и внутриклеточными водами в тканях организма. Если кислотно-щелочное равновесие жидкостей в организме не будет поддерживаться постоянно, нормальное функционирование и сохранение жизни окажутся невозможными. Поэтому важно контролировать то, что вы потребляете.

Кислотно-щелочной баланс – это наш индикатор здоровья. Чем мы «кислее», тем скорее стареем и больше болеем. Для нормальной работы всех внутренних органов уровень рН в организме должен быть щелочным, в интервале от 7 до 9.
pH внутри нашего тела не всегда одинаков — некоторые его части более щелочные, а некоторые кислотные. Организм регулирует и поддерживает гомеостаз уровня pH лишь в отдельных случаях, например pH крови. На уровень pH почек и других органов, кислотно-щелочное равновесие которых не регулируются организмом, влияют пища и напитки, которые мы употребляем.
pH крови
Уровень pH крови поддерживается организмом в диапазоне 7.35-7.45. Нормальным показателем pH крови человека считается 7,4-7,45. Даже незначительное отклонение этого показателя влияет на способность крови переносить кислород. Если pH крови повышается до 7,5, она переносит на 75% кислорода больше. При снижении показателя pH крови до 7,3 человеку уже сложно подняться с постели. При 7,29 он может впасть в кому, если показатель pH крови снизится ниже 7,1 — человек умирает.
Уровень pH крови должен поддерживаться в здоровом диапазоне, поэтому организм использует органы и ткани для поддержания его постоянства. Вследствие этого, уровень pH крови не меняется из-за употребления щелочной или кислотной воды, но ткани и органы тела, используемые для регулировки pH крови, меняют свой pH.
pH почек
На параметр pH почек оказывает влияние вода, пища, метаболические процессы в организме. Кислотная еда (например мясные продукты, молочные продукты и др.) и напитки (сладкие газированные напитки, алкогольные напитки, кофе и пр.) приводят к низкому уровню pH в почках, потому что организм выводит излишнюю кислотность через мочу. Чем ниже уровень pH мочи, тем тяжелее приходится работать почкам. Поэтому кислотная нагрузка, приходящаяся от такой еды и напитков на почки, называется потенциальной кислотно-почечной нагрузкой.
Употребление щелочной воды приносит почкам пользу — происходит повышение уровня pH мочи, снижается кислотная нагрузка на организм. Увеличение pH мочи повышает pH организма в целом и избавляет почки от кислотных токсинов.
pH желудка
В пустом желудке содержится не больше чайной ложки желудочной кислоты, выработанной в последний прием пищи. Желудок производит кислоту по мере необходимости при употреблении пищи. Желудок не выделяет кислоту, когда человек пьет воду.
Очень полезно — пить воду на пустой желудок. Показатель pH увеличивается при этом до уровня 5-6. Увеличенный pH будет иметь мягкий антацидный эффект и приведет к увеличению количества полезных пробиотиков (благотворных бактерий). Увеличение pH желудка повышает pH организма, что ведет к здоровому пищеварению и освобождает от симптомов расстройства желудка.
pH подкожного жира
Жировые ткани организма имеют кислотный pH, поскольку в них откладываются излишние кислоты. Организму приходится хранить кислоту в жировых тканях, когда она не может быть выведена или нейтрализована иными способами. Поэтому смещение pH организма в кислую сторону — это один из факторов лишнего веса.
Позитивное влияние щелочной воды на массу тела состоит в том, что щелочная вода помогает выводить из тканей излишнюю кислоту, поскольку помогает почкам работать более рационально. Это помогает контролировать вес, поскольку многократно снижается количество кислоты, которое тело должно «хранить». Щелочная вода также улучшает результаты здоровой диеты и упражнений, помогая организму справиться с излишней кислотностью, выделяемой жировыми тканями в процессе потери веса.
Кости
У костей щелочной pH, так как они в основном состоят из кальция. Их pH постоянен, но если кровь нуждается в регулировке pH, кальций забирается из костей.
Польза, приносимая щелочной водой костям, состоит в их защите, путем снижения количества кислоты, с которым организму приходится бороться. Исследования показали, что употребление щелочной воды снижает рассасывание костей — остеопороз.
pH печени
У печени слабощелочной pH, на уровень которого влияет и пища, и напитки. Сахар и алкоголь должны быть расщеплены в печени, а это приводит к излишкам кислоты.
Польза, приносимая щелочной водой печени, состоит в наличии в такой воде антиоксидантов; установлено, что щелочная вода усиливает работу двух антиоксидантов, находящихся в печени, способствующих более эффективному очищению крови.
pH организма и щелочная вода
Щелочная вода позволяет частям тела, сохраняющим pH крови, работать с большей производительностью. Повышение уровня pH в частях тела, отвечающих за поддержание pH крови, поможет этим органам оставаться здоровыми и работать оперативно.
Между приемами пищи Вы можете помочь Вашему организму нормализовать показатель pH, употребляя щелочную воду. Даже небольшое увеличение pH может оказать огромное влияние на состояние здоровья.
По данным исследований японских ученых, показатель pH питьевой воды, находящийся в диапазоне 7-8, повышает продолжительность жизни населения на 20-30%.
В зависимости от уровня рН воды можно условно разделить на несколько групп:
• сильнокислые воды 9.5
Обычно уровень рН питьевой водопроводной воды находится в пределах, при которых он непосредственно не влияет на потребительские качества воды. В речных водах pH обычно находится в пределах 6.5-8.5, в атмосферных осадках 4.6-6.1, в болотах 5.5-6.0, в морских водах 7.9-8.3.
ВОЗ не предлагает какой-либо рекомендуемой по медицинским показателям величины для рН. Известно, что при низком рН вода обладает высокой коррозионной активностью, а при высоких уровнях (рН>11) вода приобретает характерную мылкость, неприятный запах, способна вызывать раздражение глаз и кожи. Именно поэтому для питьевой и хозяйственно-бытовой воды оптимальным считается уровень рН в диапазоне от 6 до 9.
Примеры значений pH
Вещество
pH
Интересно знать: Немецкий биохимик ОТТО ВАРБУРГ, удостоенный в 1931 Нобелевской премии по физиологии и медицине доказал, что недостаток кислорода (кислая среда pH
Для сохранения и поддержания здоровья нам необходима правильная щелочная вода (рН=7.5 и выше). Это позволит лучше сохранять кислотно-щелочное равновесие жидкостей организма, так как основные жизненные среды имеют слабощелочную реакцию.
Уже при нейтральной биологической среде организм может обладать удивительной способностью к самоисцелению.

Не знаете где можно взять правильную воду ? Я подскажу!

Нажатие на кнопку « Узнать » не ведет к каким-либо финансовым тратам и обязательствам.
Вы лишь получите информацию о доступности правильной воды в Вашем регионе ,
а так же получите уникальную возможность бесплатно стать членом клуба здоровых людей
и получить скидку 20% на все предложения + накопительный бонус.

Вступи в международный клуб здоровья Coral Club, получи БЕСПЛАТНО дисконтную карту, возможность участия в акциях, накопительный бонус и другие привилегии!
Классификация химических реакций

Темы кодификатора ЕГЭ: Классификация химических реакций в органической и неорганической химии.
Химические реакции — это такой вид взаимодействия частиц, когда из одних химических веществ получаются другие, отличающиеся от них по свойствам и строению. Вещества, которые вступают в реакцию — реагенты . Вещества, которые образуются в ходе химической реакции — продукты .
В ходе химической реакции разрушаются химические связи, и образуются новые.
В ходе химических реакций не меняются атомы, участвующие в реакции. Меняется только порядок соединения атомов в молекулах. Таким образов, число атомов одного и того же вещества в ходе химической реакции не меняется .
Химические реакции классифицируют по разным признакам. Рассмотрим основные виды классификации химических реакций.
Классификация по числу и составу реагирующих веществ
По составу и числу реагирующих веществ разделяют реакции, протекающие без изменения состава веществ, и реакции, протекающие с изменением состава веществ:
1. Реакции, протекающие без изменения состава веществ (A → B)
К таким реакциям в неорганической химии можно отнести аллотропные переходы простых веществ из одной модификации в другую:
Sромбическая → Sмоноклинная.
В органической химии к таким реакциям относятся реакции изомериза-ции , когда из одного изомера под действием катализатора и внешних факторов получается другой (как правило, структурный изомер).
Например , изомеризация бутана в 2-метилпропан (изобутан):
2. Реакции, протекающие с изменением состава
- Реакции соединения (A + B + …→ D) — это такие реакции, в которых из двух и более веществ образуется одно новое сложное вещество. Внеорганической химии к реакция соединения относятся реакции горения простых веществ, взаимодействие основных оксидов с кислотными и др. В органической химии такие реакции называются реакциями присоединения . Реакции присоединения — это такие реакции, в ходе которых к рассматриваемой органической молекуле присоединяется другая молекула. К реакциям присоединения относятся реакции гидрирования (взаимодействие с водородом), гидратации (присоединение воды), гидрогалогенирования (присоединение галогеноводорода), полимеризация (присоединение молекул друг к другу с образованием длинной цепочки) и др.

Например , гидратация :
- Реакции разложения ( A → B + C + …) — это такие реакции, в ходе которых из одной сложной молекулы образуется несколько менее сложных или простых веществ. При этом могут образовываться как простые, так и сложные вещества.

Например , при разложении пероксида водорода:
В органической химии разделяют собственно реакции разложения и реакции отщепления . Реакции отщепления (элиминирования) — это такие реакции, в ходе которых происходит отрыв атомов или атомных групп от исходной молекулы при сохранении ее углеродного скелета.
Например , реакция отщепления водорода (дегидрирование) от пропана:
Как правило, в названии таких реакций есть приставка «де». Реакции разложения в органической химии происходят, как правило, с разрывом углеродной цепи.
Например , реакция крекинга бутана (расщепление на более простые молекулы при нагревании или под действием катализатора):
- Реакции замещения — это такие реакции, в ходе которых атомы или группы атомов одного вещества замещаются на атомы или группы атомов другого вещества. В неорганической химии эти реакции происходят по схеме:
AB + C = AC + B .

Например , более активные галогены вытесняют менее активные из соединений. Взаимодействие йодида калия с хлором:
2KI + Cl2 → 2KCl + I2.
Замещаться могут как отдельные атомы, так и молекулы.
Например , при сплавлении менее летучие оксиды вытесняют более летучие из солей. Так, нелетучий оксид кремния вытесняет оксид углерода из карбоната натрия при сплавлении:
В органической химии реакции замещения — это такие реакции, в ходе которых часть органической молекулы замещается на другие частицы. При этом замещенная частица, как правило, соединяется с частью молекулы-заместителя.
Например , реакция хлорирования метана:
По числу частиц и составу продуктов взаимодействия эта реакция больше похожа на реакцию обмена. Тем не менее, по механизму такая реакция является реакцией замещения.
- Реакции обмена — это такие реакции, в ходе которых два сложных вещества обмениваются своими составными частями:
AB + CD = AC + BD

К реакциям обмена относятся реакции ионного обмена, протекающие в растворах; реакции, иллюстрирующие кислотно-основные свойства веществ и другие.
Пример реакции обмена в неорганической химии — нейтрализация соляной кислоты щелочью:
NaOH + HCl = NaCl + H2O
Пример реакции обмена в органической химии — щелочной гидролиз хлорэтана:
Классификация химических реакций по изменению степени окисления элементов, образующих вещества
По изменению степени окисления элементов химические реакции делят на окислительно-восстановительные реакции, и реакции, идущие без изменения степеней окисления химических элементов.
- Окислительно-восстановительные реакции (ОВР) — это реакции, в ходе которых степени окисления веществ изменяются. При этом происходит обмен электронами.
В неорганической химии к таким реакциям относятся, как правило, реакции разложения, замещения, соединения, и все реакции, идущие с участием простых веществ. Для уравнивания ОВР используют метод электронного баланса (количество отданных электронов должно быть равно количеству полученных) или метод электронно-ионного баланса.
В органической химии разделяют реакции окисления и восстановления, в зависимости от того, что происходит с органической молекулой.
Реакции окисления в органической химии — это реакции, в ходе которых уменьшается число атомов водорода или увеличивается число атомов кислорода в исходной органической молекуле.
Например , окисление этанола под действием оксида меди:
Реакции восстановления в органической химии — это реакции, в ходе которых увеличивается число атомов водорода или уменьшается число атомов кислорода в органической молекуле.
Например , восстановление уксусного альдегида водородом:
- Протолитические реакции и реакции обмена — это такие реакции, в ходе которые степени окисления атомов не изменяются.
Например , нейтрализация едкого натра азотной кислотой:
Классификация реакций по тепловому эффекту
По тепловому эффекту реакции разделяют на экзотермические и эндотермические.
Экзотермические реакции — это реакции, сопровождающиеся выделением энергии в форме теплоты (+Q). К таким реакциям относятся почти все реакции соединения.
Исключения — реакция азота с кислородом с образованием оксида азота (II) — эндотермическая:
Реакция газообразного водорода с твердым йодом также эндотермическая:
Экзотермические реакции, в ходе которых выделяется свет, называют реакциями горения.
Например , горение метана:

Также экзотермическими являются:
- реакции щелочных металлов с водой;
- реакции, сопровождающиеся взрывом;

- разложение дихромата аммония («вулканчик»);
- образование аммиака: N2 + 3H2 = 2NH3 ;
- реакции нейтрализации;
- синтез метанола;
- алюмотермия ;
- реакции, в которых из менее стабильных веществ образуются более стабильные;
- в органической химии — реакции присоединения, реакции горения, окисления и др.
Эндотермические реакции — это реакции, сопровождающиеся поглощением энергии в форме теплоты (— Q). Как правило, с поглощением теплоты идет большинство реакций разложения (реакции, требующие длительного нагревания).
Например , разложение известняка:
Также эндотермическими являются:
- реакции гидролиза;
- реакции, идущие только при нагревании ;
- реакции, протекающие только при очень высоких температурах или под действием электрического разряда.
Например , превращение кислорода в озон:
В органической химии с поглощением теплоты идут реакции разложения. Например , крекинг пентана:
Классификация химических реакций по агрегатному состоянию реагирующих веществ (по фазовому составу)
Вещества могут существовать в трех основных агрегатных состояниях — твердом, жидком и газообразном. По фазовому состоянию разделяют реакции гомогенные и гетерогенные .
- Гомогенные реакции — это такие реакции, в которых реагирующие вещества и продукты находятся в одной фазе, и столкновение реагирующих частиц происходит во всем объеме реакционной смеси. К гомогенным реакциям относят взаимодействия жидкость-жидкость и газ-газ.
Например , окисление сернистого газа:
- Гетерогенные реакции — это реакции, в которых реагирующие вещества и продукты находятся в разных фазах. При этом столкновение реагирующих частиц происходит только на границе соприкосновения фаз. К таким реакциям относятся взаимодействия газ-жидкость, газ-твердая фаза, твердая-твердая, и твердая фаза — жидкость.
Например , взаимодействие углекислого газа и гидроксида кальция:
Для классификации реакций по фазовому состоянию полезно уметь определять фазовые состояния веществ. Это достаточно легко сделать, используя знания о строении вещества, в частности, о типах кристаллической решетки.
Вещества с ионной, атомной или металлической кристаллической решеткой, как правило твердые при обычных условиях; вещества с молекулярной решеткой, как правило, жидкости или газы при обычных условиях.
Обратите внимание, что при нагревании или охлаждении вещества могут переходить из одного фазового состояния в другое. В таком случае необходимо ориентироваться на условия проведения конкретной реакции и физические свойства вещества.
Например , получение синтез-газа происходит при очень высоких температурах, при которых вода — пар:
Таким образом, паровая конверсия метана — гомогенная реакция.
Классификация химических реакций по участию катализатора
Катализатор — это такое вещество, которое ускоряет реакцию, но не входит в состав продуктов реакции. Катализатор участвует в реакции, но практичсеки не расходуется в ходе реакции. Условно схему действия катализатора К при взаимодействии веществ A + B можно изобразить так: A + K = AK; AK + B = AB + K.
В зависимости от наличия катализатора различают каталитические и некаталитические реакции.
- Каталитические реакции — это реакции, которые идут с участием катализаторов. Например, разложение бертолетовой соли: 2KClO3 → 2KCl + 3O2.
- Некаталитические реакции — это реакции, которые идут без участия катализатора. Например, горение этана: 2C2H6 + 5O2 = 2CO2 + 6H2O.
Все реакции, протекающие с участием в клетках живых организмов, протекают с участием особых белковых катализаторов — ферментов. Такие реакции называют ферментативными.
Более подробно механизм действия и функции катализаторов рассматриваются в отдельной статье.
Классификация реакций по способности протекать в обратном направлении
Обратимые реакции — это реакции, которые могут протекать и в прямом, и в и обратном направлении, т.е. когда при данных условиях продукты реакции могут взаимодействовать друг с другом. К обратимым реакциям относятся большинство гомогенных реакций, этерификация; реакции гидролиза; гидрирование-дегидрирование, гидратация-дегидратация; получение аммиака из простых веществ, окисление сернистого газа, получение галогеноводородов (кроме фтороводорода) и сероводорода; синтез метанола; получение и разложение карбонатов и гидрокарбонатов, и т.д.
Необратимые реакции — это реакции, которые протекают преимущественно в одном направлении, т.е. продукты реакции не могут взаимодействовать друг с другом при данных условиях. Примеры необратимых реакций: горение; реакции, идущие со взрывом; реакции, идущие с образованием газа, осадка или воды в растворах; растворение щелочных металлов в воде; и др.
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
- Соединения
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF

Окислительно-восстановительные реакции (ОВР)
Это те химические реакции, в процессе которых происходит изменение степеней окисления химических элементов, входящих в состав исходных веществ. ОВР подразделяются на:
-
Межмолекулярные – атомы окислителя и восстановителя входят в состав разных молекул. Примеры:
Внутримолекулярные – атомы окислителя и восстановителя в составе одного сложного вещества. Примеры:
Диспропорционирование – один и тот же атом является и окислителем, и восстановителем

Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
От обилия информации можно запутаться. Я рекомендую сформулировать четко: “Окислитель – понижает СО, восстановитель – повышает СО”. Запомнив эту информацию таким образом, вы не будете путаться.

ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе “Решения задач”.
Обратимые и необратимые реакции
Обратимые реакции – такие химические реакции, которые протекают одновременно в двух противоположных направлениях: прямом и обратном. При записи реакции в таких случаях вместо знака “=” ставят знак обратимости “⇆”.
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Иногда сложно бывает отличить обратимую реакцию от необратимой, однако я дам несколько советов, которые советую взять на вооружение. В результате необратимых реакций:
- Образуются малодиссоциирующие вещества (например – вода, однако есть исключения – реакция этерификации)
- Реакция сопровождается выделение большого количества тепла
- В ходе реакции образуется газ или выпадает осадок
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)

Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
Все реакции можно разделить на гетеро- и гомогенные. Гетерогенные реакции (греч. heterogenes – разнородный) – реакции, протекающие на границе раздела фаз, в неоднородной среде. Скорость таких реакций зависит от площади соприкосновения реагирующих веществ.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:

Гомогенные реакции (греч. homogenes – однородный) – реакции, протекающие между веществами, находящимися в одной фазе.
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.

Реакции и их тепловой эффект
Все реакции можно разделить на те, в ходе которых тепло поглощается, или, наоборот, тепло выделяется. Представьте пробирку, охлаждающуюся или нагревающуюся в вашей руке – это и есть тот самый тепловой эффект. Иногда тепла выделяется так много, что реакции сопровождаются воспламенением или взрывом (натрий с водой).
Экзотермические реакции (греч. exo – вне) – химические реакции, сопровождающиеся потерей энергии системой и выделением тепла (той самой энергии) во внешнюю среду. При написании химических реакций в конце экзотермических ставят “+ Q” (Q – тепло), иногда бывает указано точное количество выделяющегося тепла. Например:
2Mg + O2 = 2MgO + Q
NaOH + HCl = NaCl + H2O + 56 кДж

К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью “запутывания” в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)

Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония (“вулканчик”) является примером экзотермического разложения, при котором тепло выделяется.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Химические реакции их классификация (Схема, Таблица)
Химическая реакция — это превращение одного или нескольких исходных веществ (реагентов) в другие вещества, при этом ядра атомов не меняются, происходит только перераспределение электронов и ядер, и образуются новые химические вещества. При химических реакциях не изменяется общее число ядер атомов и изотопный состав химических элементов (в отличие от ядерных реакций).
Классификация химических реакций схема
Химические реакции классифицируются по тепловому эффекту, по изменению степени окисления атомов в реагирующих веществах, по числу и составу исходных и образующихся веществ, и по признаку обратимости.

Классификация химических реакций по числу и составу исходных и образующихся веществ
Реакция, в которой из одного исходного вещества образуется несколько новых веществ
2HgO → t → 2Hg + O2
Реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы одного из элементов сложного вещества
Реакция, в результате которой два вещества обмениваются своими составными частями, образуя два новых вещества
NaOH + HCl → NaCl + H2O
Реакция, в результате которой из двух или нескольких веществ образуется одно новое
Классификация химических реакций по тепловому эффекту
Тепловой эффект химической реакции — это количество теплоты (Q), которое выделяется или поглощается в химической реакции.
Реакция, проходящая с поглощением теплоты
Реакция, проходящая с выделением теплоты
Термохимическое уравнение — уравнение химической реакции, в котором указан тепловой эффект реакции:
Термохимические расчеты основаны на законе Гесса:
– тепловой эффект химической реакции зависит от состояний исходных веществ и продуктов реакций, но не зависит от промежуточных стадий процесса
– тепловой эффект химической реакции равен сумме теплот образования продуктов реакции эа вычетом суммы теплот образования исходных веществ
Классификация химических реакций по признаку обратимости
Такая реакция, которая в данных условиях протекает одновременно в двух взаимно противоположных направлениях
Такая реакция, которая в данных условиях протекает до конца, т. е. до полного превращения исходных реагирующих веществ в конечные продукты реакции
Таблица признаки необратимости реакций
Реакция идет с выделением большого количества теплоты
2Mg + O2 → 2MgO + Q
Хотя бы один продукт реакции покидает сферу реакции (выпадает в осадок или выделяется в виде газа)
В результате реакции образуются малодиссоциируе-мые вещества
HCl + NaOH → NaCl + H2O
Классификация химических реакций по изменению степени окисления
Проходящая с изменением степени окисления атомов (окислительно-восстановительная)
реакция, при которой происходит переход электронов от одних атомов, молекул или ионов к другим
– 2KI -1 + Сl 2 0 → 2КСl -1 + I 2 0
Проходящая без изменения степени окисления
Реакция, в которой степень окисления каждого атома после реакции остается неизменной
Влияние изменения условий на положение химического равновесия
Изменение условий, при которых система находится в состоянии химического равновесия
Изменение скоростей прямой и обратной реакции в начальный момент
Направление смешения положения равновесия
В большей степени возрастает скорость эндотермической реакции
В сторону эндотермической реакции
В большей степени понижается скорость эндотермической реакции
В сторону экзотермической реакции
В большей степени возрастает скорость реакции, протекающей с уменьшением числа молей газообразных веществ
В сторону уменьшения числа молей газообразных веществ в системе
В большей степени понижается скорость реакции протекающей с уменьшением числа молей газообразных веществ
В сторону увеличения числа молей газообразных веществ в системе
Возрастает скорость реакции, по которой вводимое вещество расходуется
В сторону реакции, по которой вводимое вещество расходуется
Уменьшается скорость реакции, где реагентом является вещество, концентрация которого уменьшается
В сторону реакции, по которой образуется вещество, концентрация которого уменьшается
Скорости прямой и обратной реакции изменяются одинаково
Классификация химических реакций по веществам, тепловому эффекту
Вспомните, чем отличаются химические явления или химические реакции от физических (Конспект).
| Процессы превращения одних веществ в другие, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам, называются химическими реакциями . |

Химические реакции, протекающие
без изменения состава веществ.
Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения.
Если качественный и количественный состав реагентов и продуктов реакций не меняется, то, очевидно, изменяется их строение. В курсе органической химии такие вещества называются изомерами, а процессы их взаимного перехода — реакциями изомеризации. Например, известно, что детонационную стойкость бензина характеризует октановая шкала, в которой устойчивость к детонации 2,2,4-триметилпентана (изооктана) принята за 100. А октановое число его изомера, углеводорода С8Н18 нормального строения, равно 20. Получить изооктан из н-октана можно с помощью реакции изомеризации:
В неорганической химии одинаковый качественный, но разный количественный состав простых веществ иллюстрируют, например, аллотропные видоизменения кислорода: этот элемент образует два простых вещества — кислород и озон, которые связаны взаимопревращениями. Процесс образования озона происходит при электрических разрядах:
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Вспомните, какое строение имеют алмаз и графит. У обоих веществ — атомная кристаллическая решётка, только у алмаза она объёмная тетраэдрическая, а у графита — плоскостная. Поэтому алмаз — очень твёрдое вещество, а графит мягок. Алмаз прозрачен и обладает высоким светопреломлением, а графит непрозрачен, тёмно-серого цвета, в отличие от алмаза проводит электрический ток. Тем не менее обе модификации связаны взаимопревращениями:
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах.
В настоящее время искусственные алмазы получают из графита также при низких давлениях. Такие алмазы значительно уступают природным по ювелирным показателям, но сравнимы с природными по твёрдости, а потому применяются в технических целях.
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный.
Химические реакции, протекающие
с изменением состава веществ
(по признаку числа и состава реагентов и продуктов реакции).
Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена.
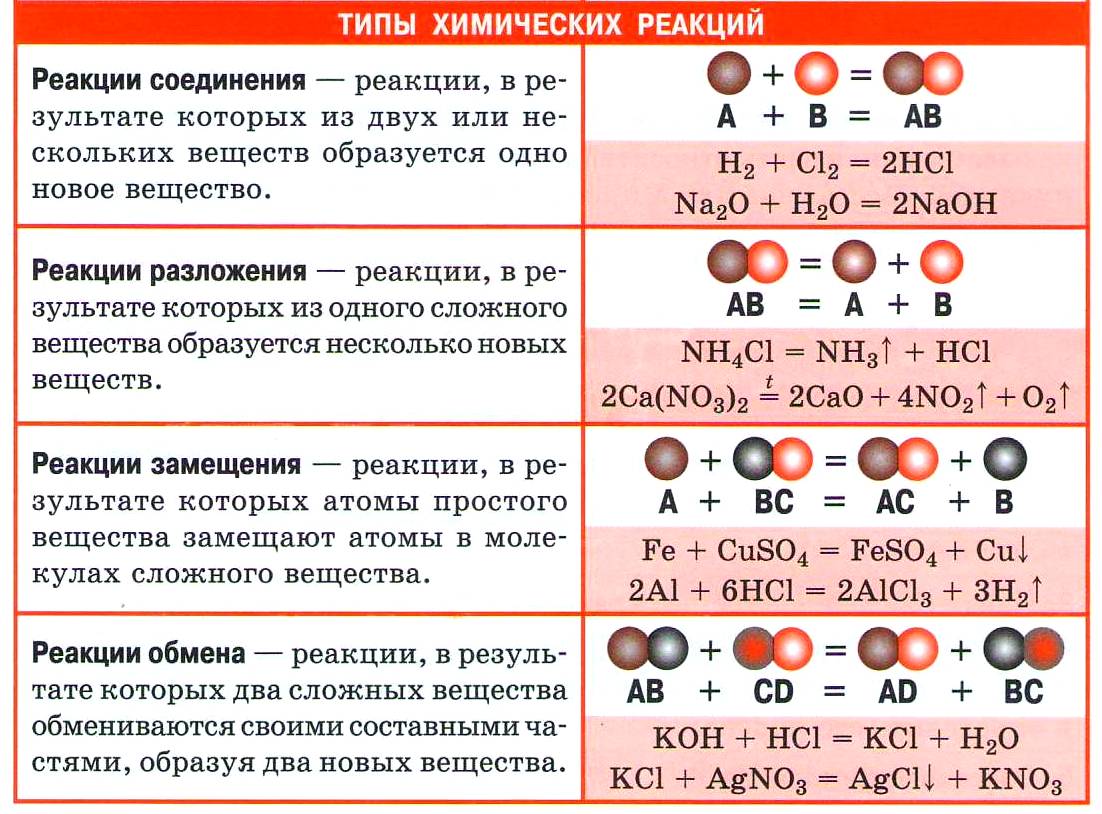
1. Реакции соединения (присоединения)
| Реакции, в результате которых из двух и более веществ образуется одно сложное вещество, называются реакциями соединения . |
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов:
- Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5
В этом процессе участвуют два простых вещества и получается одно сложное.
- Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4(сложное вещество образуется в результате взаимодействия двух сложных веществ).
- На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 +O2 + 2Н2O = 4HNO3
В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия:
- гидрирование — присоединение водорода;
- галогенирование — присоединение галогенов;
- гидрогалогенирование — присоединение галогеноводородов;
- гидратация — присоединение воды.
Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера.
2. Реакции разложения (отщепления)
| Реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ, называются реакциями разложения . |
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами.
- Электролиз воды:

- Термическим разложением оксида ртути(II) англичанин Джозеф Пристли получил кислород.
- Разложение пероксида водорода:

- Разложение нитратов:

Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш.
В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций).
3. Реакции замещения
| Реакции, в результате которых атомы простого вещества замещают атомы другого элемента в сложном веществе, называются реакциями замещения . |
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2.
Аналогично, этот тип реакций характеризует химические свойства металлов:
- Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑
- С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑
- Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe +CuSO4 = Сu +FeSO4
- Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl +Fe2O3 = Аl2O3 + 2Fe
Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4.
Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O
В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества.
4. Реакции обмена
| Реакции, в результате которых два сложных вещества обмениваются своими составными частями, называются реакциями обмена . |
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода).
- Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца:
- Лабораторный способ получения аммиака:
2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O
NH4 + + ОН – = NH3↑ + Н2O
- Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей:
NaOH + НСl = NaCl + Н2O
OH – + H + = H2O
Химические реакции, протекающие
с тепловым эффектом.
Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими.
Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q
Эта реакция широко использовалась раньше при фотографировании. До сих пор можно встретить выражение: «Место происшествия освещали вспышки магния», — хотя сейчас вместо вспышки пламени горящего порошка магния используются электровспышки.
Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q
Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 2NO – Q
 Такие реакции называются эндотермическими.
Такие реакции называются эндотермическими.
Схематично экзо- и эндотермические реакции отражает рисунок.
Если реакции разложения протекают с поглощением теплоты, то в реакциях соединения теплота должна выделяться, и наоборот. Например, практическое значение имеет обжиг известняка: процесс получения ценного химического сырья и строительного материала — негашёной извести:
| Количество теплоты, которое выделяется или поглощается в результате протекания химической реакции, называется тепловым эффектом реакции . |
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим.
Например:
СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая;
СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям
Классификация реакций — многоплановый процесс. Их можно классифицировать также:
- по направлению (обратимые и необратимые реакции);
- по использованию катализатора (каталитические и некаталитические реакции);
- по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции);
- по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления).

Конспект урока по химии «Классификация химических реакций». В учебных целях использованы цитаты из пособия «Химия. 11 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
II. Классификация реакций по тепловому эффекту



Химические реакции.Классификация химических реакций
Химические реакции (химические явления)–этопроцессы, в результате которых из одних веществ образуются другие, отличающиеся от исходных по составу или строению.При протекании химических реакций не происходит изменения числа атомов того или иного элемента, взаимопревращения изотопов.
Классификация химических реакций многопланова, в ее основу могут быть положены различные признаки: число и состав реагентов и продуктов реакции, тепловой эффект, обратимость и др.
I. Классификация реакций по числу и составу
Реагирующих веществ
А. Реакций, протекающие без изменения качественного состава вещества. Это многочисленные аллотропные превращения простых веществ (например, кислород ↔ озон (3О2↔2О3), белое олово ↔ серое олово); переход при изменении температуры некоторых твердых веществиз одного кристаллического состояния в другое–полиморфные превращения (например, красные кристаллы иодида ртути(II) при нагревании превращаются в вещество желтого цвета того же состава, при охлаждении протекает обратный процесс); реакции изомеризации (например, NH4OCN↔ (NH2)2CO) и др.
Б. Реакции, протекающие с изменением состава реагирующих веществ.
Реакции соединения–это реакции, при которых из двух или более исходных веществ образуется одно новое сложное вещество. Исходные вещества могут быть как простыми, так и сложными, например:
Реакции разложения– это реакции, при которых из одного исходного сложного вещества образуется два или более новых вещества. Вещества, образующиеся в реакциях такого типа могут быть как простыми, так и сложными, например:
Реакции замещения– это процессы, в которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.Поскольку в реакциях замещения в качестве одного из реагентов обязательно участвует простое вещество, практически все превращения такого типа являются окислительно-восстановительными, например:
Реакции обмена– это реакции, при которых два сложных вещества обмениваются своими составными частями.Реакции обмена могут протекать непосредственно между двумя реагентами без участия растворителя, например:H2SO4 + 2КОН = K2SO4 + 2Н2О ; SiО2(тв)+ 4HF(г)=SiF4+ 2Н2О.
Реакции обмена, протекающие в растворах электролитов, называют реакциями ионного обмена.Такие реакции возможны лишь в том случае, если одно из образующихся веществ является слабым электролитом, выделяется из сферы реакции в виде газа или труднорастворимого вещества (правило Бертолле):
AgNO3 + HCl = AgCl↓ + HNO3, или Ag + + Cl – = AgCl↓;
NaOH + HCl = NaCl + H2O, или Н + + OH – = H2O.
II. Классификация реакций по тепловому эффекту
А.Реакции, протекающие с выделением тепловой энергии–экзотермические реакции (+ Q).
Б.Реакции, протекающие с поглощением теплоты–эндотермические реакции (– Q).
Тепловым эффектомреакции называют количество теплоты, которое выделяется или поглощается в результате химической реакции.Уравнение реакции, в котором указан ее тепловой эффект, называют термохимическим.Значение теплового эффекта реакции удобно приводить в расчете на 1 моль одного из участников реакции, поэтому в термохимических уравнениях часто можно встретить дробные коэффициенты:
Экзотермическими являются все реакции горения, подавляющее большинство реакций окисления и соединения. Реакции разложения, как правило, требуют затрат энергии.










