Фосфорная кислота. Получение и применение.
Автор: Tyorkin · Опубликовано 2 апреля, 2014 · Обновлено 7 июля, 2018

Более точным названием данного вещества считается ортофосфорная кислота, которая будучи в выпаренном состоянии имеет вид бесцветных ромбовидных кристаллов, у которых температурой плавления составляет 42,3°С. В чистом виде она встречается довольно редко, а потому фосфорной кислотой именуют 75 — 85 процентный водный раствор фосфора. Химическая формула описываемой кислоты H3PO4. Фосфорную кислоту можно смешать с H2O в любом соотношении, получив при этом немного кислый раствор. Таким образом, данное вещество, будучи в привычном для нас виде, представляет собой бесцветную густую жидкость без запаха.
В нормальных условиях данная кислота является малоактивной и вступает в реакцию лишь с небольшим количеством металлов, гидроксидами и карбонатами. Если нагреть вещество до температуры более 80°С, для реакций с ним можно будет использовать неактивные оксиды, силикаты и кремнезем. Также во время нагревания из кислоты испаряется вода, образуя сначала пирофосфорные, после чего — метафосфорные кислоты.
Фосфор является незаменимым элементом для всех живых организмов на планете Земля, независимо от того микроорганизм это, простейшие растения или человек. Ему выделена наиважнейшая роль при росте костей, зубов, панцирей у животных и когтей.
Применение фосфорной кислоты
Область применения фосфорных соединений поистине огромна, ниже приведен перечень некоторых из них:
Производство удобрений.
Для этих целей используется большая часть всей добываемой фосфорной кислоты. Каждый год лишь при производстве удобрений повсеместно используется свыше 90 процентов фосфорсодержащей руды. К основным производителям удобрений данного типа можно отнести Россию, США и Марокко, тогда как к основным потребителям можно отнести практически все Западноевропейские, Азиатские и Африканские страны.
Соли фосфорной кислоты потребляются растениями в виде анионов, а также соли полифосфорных кислот при проведении гидролиза. Фосфор используется растениями при образовании наиболее важных своих частей, а именно семян и плодов. Также за счет фосфорной кислоты увеличивается зимостойкость растений, они становятся устойчивей к засухе. Особенно важным условием является применение фосфорсодержащих удобрений в северных регионах с непродолжительным вегетативным периодом. Благотворно она воздействует и на саму почву, вызывая активное развитие почвенных бактерий.
Пищевая промышленность.
Растворы описываемой кислоты применяются с целью придать вкус сиропам, всевозможным газированным напиткам и мармеладам. Зарегистрировано данное вещество, как пищевая добавка Е338. Солями фосфорной кислоты можно улучшить вкус различных хлебобулочных изделий.
Звероводство.
Незаменимым веществом для профилактики камней в почках и повышенной кислотности желудка является фосфорная кислота.
Деревообрабатывающая промышленность.
Растворы фосфорной кислоты используются в деревообрабатывающей промышленности для пропитки древесины, благодаря чему дерево становится негорючим.
Производство строительных материалов и бытовой химии.
С применением данной кислоты производятся устойчивые к пламени лакокрасочные материалы, такие как: эмаль, лак и пропитки, а также огнестойкий фосфатный пенопласт, плиты, изготовленные из древесины и иного рода стройматериалы.
Соли фосфорной кислоты используются, чтобы смягчить воду, также они содержатся в составе моющих средств и средств, удаляющих с накипь.
Производство фосфорной кислоты
В небольших количествах фосфорная кислота легко получается в лабораторных условиях при окислении фосфора раствором 32-процентной азотной кислоты. В промышленных условиях она получается посредствам экстракционного и термического способа.
Экстракционный способ считается менее затратным. Суть его заключается в разложении природных фосфатов при помощи различных кислот, наиболее часто применяемыми является серная, а также азотная и соляная. Данный метод подразумевает экстрагирование P2O5 в следующий вид — H3PO4. Для этих целей фосфаты подвергаются обработке H2SO4, а полученная пульпа фильтруется от осевшего сульфата Ca. Таким образом, получается чистая ортофосфорная кислота.
К сырью, применяемому при производстве фосфорной кислоты, предъявляется перечень довольно высоких требований, так, например, природные фосфаты, содержащие в большом количестве карбонаты, соединения Al, Mg, Fe и иные органические вещества — непригодны! На территории Российской Федерации и стран СНГ при производстве фосфорной кислоты чаще всего используется Хибинский апатитовый концентрат наряду с фосфоритами Каратау.
Термический способ, используемый для получения наиболее чистой кислоты, состоит из нескольких этапов: сжигание элементного фосфора, гидратация P4O10 и абсорбция его водой, конденсация и улавливание газа. В зависимости от применяемого принципа охлаждения газов, встречается три вида проведения термического получения кислоты:
• испарительный;
• циркуляционно-испарительный;
• теплообменно-испарительный.
Отечественные предприятия чаще всего прибегают к использованию технологии с циркуляционно-испарительным методом охлаждения.
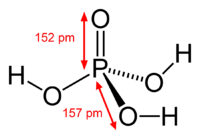
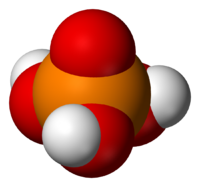
Ортофосфорная кислота
| Ортофосфорная кислота | |
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | Ортофосфорная кислота |
| Химическая формула | H3PO4 |
| Физические свойства | |
| Состояние (ст. усл.) | твердое |
| Отн. молек. масса | 98,0 а. е. м. |
| Молярная масса | 98,0 г/моль г/моль |
| Плотность | 1,685 (жидк) г/см³ |
| Динамическая вязкость (ст. усл.) | 2,4-9,4 сПуаз Па·с (при 20 °C) |
| Термические свойства | |
| Температура плавления | 42,35 °C |
| Температура кипения | 158 °C |
| Химические свойства | |
| pKa | 2,12, 7,21, 12,67 |
| Растворимость в воде | 548 г/100 мл |
| Классификация | |
| Рег. номер CAS | [7664-38-2] |
Ортофо́сфорная кислота́ (фо́сфорная кислота́) [1] — неорганическая кислота средней силы, с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы.
При температуре выше 213 °C она превращается в пирофосфорную кислоту H4P2O7. Очень хорошо растворима в воде. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 % водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима также в этаноле и других растворителях.
Содержание
Получение
Фосфорную кислоту получают из фосфата:


Или взаимодействием с водой оксида фосфора(V), полученного сжиганием фосфора в кислороде:

С водой реакция идет очень бурно, поэтому оксид фосфора(V) обрабатывают нагретым до 200 °C концентрированным раствором ортофосфорной кислоты.
Расплавленная ортофосфорная кислота и ее концентрированные растворы обладают большой вязкостью, что обусловлено образованием межмолекулярных водородных связей.
Свойства
H3PO4 — трехосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной HClO4, фосфорная кислота проявляет признаки амфотерности — образуются соли фосфорила, например [Р(ОН)4]·(ClO4).
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра — образуется жёлтый осадок:

Качественной реакцией на ион РО4 3− является образование ярко-жёлтого осадка молибденофосфата аммония:

Фосфаты
Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли.
 (дигидрофосфат натрия)
(дигидрофосфат натрия)  (гидрофосфат натрия)
(гидрофосфат натрия)  (фосфат натрия)
(фосфат натрия)
Дигидрофосфаты (однозамещенные фосфаты) имеют кислую реакцию, гидрофосфаты (двузамещенные фосфаты) — слабощелочную, средние (трехзамещенные фосфаты, или просто фосфаты) — щелочную.
Дигидрофосфаты обычно хорошо растворимы в воде, почти все гидрофосфаты и фосфаты растворимы мало. Прокаливание солей приводит к следующим превращениям:


Фосфаты при прокаливании не разлагаются, исключение составляет фосфат аммония (NH4)3PO4.
Органические фосфаты играют очень важную роль в биологических процессах. Фосфаты сахаров участвуют в фотосинтезе. Нуклеиновые кислоты также содержат остаток фосфорной кислоты.
Применение
Используется при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках.
Применение ортофосфорной кислоты в сельском хозяйстве. В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного рН желудка и мочекаменной болезни.
Применение ортофосфорной кислоты в стоматологии. Ортофосфорная кислота применяется для снятия зубной эмали перед пломбированием зубов. При применении адгезивных материалов 2 и 3 поколения требуется тотальное протравливание зуба кислотой, с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесенный адгезив не полностью (по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удается полностью удалить ортофосфорную кислоту после ее нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность бондинга, а также приводят к образованию так называемой «кислотной мины».
Поэтому с появлением адгезивных материалов 5 и 6 поколения ортофосфорная кислота использоваться перестала.
См. также
- Фосфорные кислоты
- Фосфор
Примечания
- ↑Химия. Лекции и электронные учебники на Бобыч.Ру (рус.) . Архивировано из первоисточника 7 февраля 2012.Проверено 13 сентября 2009.
Литература
- Карапетьянц М. Х. Дракин С. И. Общая и неорганическая химия. М.: Химия1994
- Блум У. Адгезивные системы обзор и сравнение// Дент. Арт.- 2003,№ 2.-С.5-11.
- Давыдова А. В. Характеристика адгезивных систем// Материалы научно-практической конференции «Новые технологии в стоматологии».- Ростов на Дону, 2004.-С.45-46
- Enamel-dentin adhesives, self-etching primers// CRA Newsletter.- Vol.24,№ 11.-2000.-P.1-2.
Ссылки
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Hg2 2+ | Pb 2+ | Sn 2+ | Cu + | Cu 2+ | |
| OH − | P | P | P | — | P | М | Н | М | Н | Н | Н | — | Н | Н | Н | Н | Н | — | — | Н | Н | Н | Н | |
| F − | P | Н | P | P | Р | М | Н | Н | М | Р | Н | Н | Н | Р | Р | М | Р | Р | М | М | Н | Р | Н | Р |
| Cl − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | Н | М | — | Н | Р |
| Br − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | Н | М | Р | H | Р |
| I − | P | P | P | P | Р | Р | Р | Р | Р | Р | ? | Р | — | Р | Р | Р | Р | Н | Н | Н | Н | М | Н | — |
| S 2− | P | P | P | P | — | Р | М | Н | Р | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| SO3 2− | P | P | P | P | Р | М | М | М | Н | ? | ? | М | ? | Н | Н | Н | М | Н | Н | Н | Н | ? | Н | ? |
| SO4 2− | P | P | P | P | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Н | Р | Р | Р |
| NO3 − | P | P | P | P | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | — | Р | Р |
| NO2 − | P | P | P | P | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? | ? | ? |
| PO4 3− | P | Н | P | P | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | ? | Н | Н | Н | Н |
| CO3 2− | М | Р | P | P | Р | Н | Н | Н | Н | — | — | Н | — | Н | Н | — | Н | Н | — | Н | — | — | ? | — |
| CH3COO − | P | Р | P | P | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | М | Р | — | Р | Р |
| CN − | P | Р | P | P | Р | Р | Р | Р | Р | ? | Н | Н | — | Н | Н | Н | Н | Н | Р | Н | Р | — | — | Н |
| SiO3 2− | H | Н | P | P | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | ? | Н | ? | ? | ? |
Wikimedia Foundation . 2010 .
- Яблоня
- Халифат
Смотреть что такое “Ортофосфорная кислота” в других словарях:
ОРТОФОСФОРНАЯ КИСЛОТА — ОРТОФОСФОРНАЯ КИСЛОТА, то же, что фосфорная кислота … Современная энциклопедия
ортофосфорная кислота — Регулятор кислотности пищевого продукта, получаемый химическим синтезом из природных фосфатов, содержащий основного вещества не менее 67,0 % и не более 85,7 %, сульфатов не более 1500 мг/кг в пересчете на CaSO4 , фтористых соединений не более 10… … Справочник технического переводчика
ортофосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
ортофосфорная кислота — Е338 – ортофосфорная кислота. В зависимости от концентрации применяют для производства фосфорных удобрений, в пищевой, текстильной, стекольной промышленности. Пропитка древесины ортофосфорной кислотой и ее солями делают дерево негорючим. На этой… … Универсальный дополнительный практический толковый словарь И. Мостицкого
ортофосфорная кислота — то же, что фосфорная кислота … Энциклопедический словарь
ОРТОФОСФОРНАЯ КИСЛОТА — то же, что фосфорная кислота … Естествознание. Энциклопедический словарь
ортофосфорная кислота — фосфорная кислота … Cловарь химических синонимов I
Ортофосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Кислота — У этого термина существуют и другие значения, см. Кислота (значения) … Википедия
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I
Аллотропия простых веществ и химия аллотропных модификаций
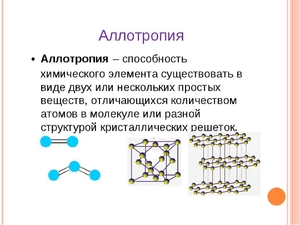
В природе встречаются такие химические элементы, которые могут существовать в форме различных простых веществ, свойства которых, как химические, так и физические различны, а также кардинально различны строения их кристаллических решеток. В химии это называется «Аллотропия».
Аллотропия, это
Понятия «Аллотропия» имеет древнегреческие корни: αλλος – другой, τροπος – свойство.
Термин вошел в обиход с 1841 благодаря шведскому ученому, И. Я. Берцелиусу, в целях обозначения различных форм проявления одного и того же химического элемента.
Аллотропия химических элементов может проявляться в виде:
- аллотропии состава, когда различно число атомов в молекуле,
- аллотропии формы, когда различны строения кристаллических решеток.
В современной химии термин «Аллотропия» используется для простых веществ, вне зависимости от их агрегатного состояния.
Для веществ с твёрдым агрегатным состоянием, независимо от того, это вещество простое или сложное, используется термин «Полиморфизм» (от греческого слова Διαφοροποιημένο – многообразный).
Аллотропные преобразования
Химические элементы, образующие различные простые вещества и встречающиеся в природе, называются аллотропными формами химического элемента.
Химические элементы, образующие различные простые вещества под воздействием изменения окружающих условий, например, температура и давление, называются аллотропными модификациями химического элемента.
Не все химические элементы обладают свойством аллотропии.
Установлено, что аллотропией обладают химические элементы с высокой степенью окисления и способностью атомов к образованию гомоцепных структур.
Поэтому аллотропные преобразования в основном наблюдаются у неметаллов (за исключением галогенов и инертных газов), а также у полуметаллов.
Аллотропные преобразования металлов в природе встречаются намного реже. Только 28 металлов при атмосферном давлении имеют аллотропные формы и 6 образуют аллотропные модификации при их технологической обработке.
Химия аллотропных переходов
Преобразования химического элемента происходят при химическом переходе его атомного или молекулярного состояния из одной формы в другую. Эти переходы могут происходить при изменении окружающих условий, например:
- при нормальном давлении и изменении температуры;
- при изменении давления при неизменной температуре;
- при одновременном изменении давления и температуры.
Эти преобразования могут носить обратимый (энантиотропный) характер или необратимый (монотропный).
Примеры преобразований:
 энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.
энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.- монотропный переход — модификация белого фосфора P4 в чёрный фосфор при температуре 200 °C и давлении 1,25 ГПа. Возвращение температуры и давления к исходным условиям не приводит к обратному переходу.
У некоторых химических элементов аллотропные переходы могут чередоваться.
Примером является олово.
Белое олово (β-Sn) в обычных условиях пластичное, имеет тетрагональную кристаллическую решетку и устойчиво.
Белое олово при повышении температуры выше 173 °C, превращается в хрупкую форму (γ-Sn). Превращение происходит энантиотропно.
Белое олово при понижении температуры ниже 13.2 °C, превращается в серое олово (α-Sn) порошкообразное с кубической алмазоподобной решёткой. Превращение происходит монотропно.
Некоторые химические элементы и их модификации
Неметаллы
 Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.- Сера — вторая по подверженности аллотропии среди неметаллов. Основные ее виды: ромбическая, моноклинная и пластическая. При нормальных условиях окружающей среды моноклинная и пластическая модификации серы переходят в ромбическую.
- Фосфор — имеет 11 аллотропных форм, различающихся числом атомов в молекуле, химическими связями и свойствами, из которых белый фосфор, красный фосфор и черный фосфор имеют устойчивые формы и встречаются в природе, остальные формы распадающиеся и в природе не встречаются.
- Селен — в свободном состоянии бывает в трех видах: красный цикло-Se8, гексагональный или серый селен Se и чёрный селен.
- Водород — бывает в виде o-H2 (орто-водород) и p-H2 (пара-водорода). Молекулы o-H2 и p-H2 отличаются построением ядерных спинов. У o-H2 они параллельные, у p-H2 антипараллельные.
- Кислород — модифицируется в два вещества: Кислород (O2) и Озон (O3).
Полуметаллы
- Бор — встречается в более, чем в 10 состояниях в аморфной и кристаллической формах. Физические свойства этих форм различны.
- Кремний — бывает в аморфной и кристаллической формах. У кристаллической модификации решётка атомная, алмазоподобная.
- Сурьма — имеет четыре металлические и три аморфные аллотропные модификации. Металлические формы существуют при разном давлении. Аморфные формы сурьмы: взрывчатая, чёрная и жёлтая.
- Мышьяк — встречается в трех аллотропных состояниях: в виде неметалла или жёлтый мышьяк, в виде полуметаллического полимера или серый мышьяк, в виде неметаллической молекулярной структуры или чёрный мышьяк.
Металлы
- Железо — бывает в виде четырех кристаллических модификаций:
 α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;- β-Fe. Имеет решётку объемноцентрированную кубическую. Существует при температурах от 769 °C до 917 °C. Обладает магнитными свойствами парамагнетики;
- γ-Fe или аустенит. Имеет решётку гранецентрированную кубическую. Существует при температурах от 917 °C до 1394 °C;
- δ-Fe. Имеет решётку объемноцентрированную кубическую. Имеет устойчивость при температуре выше 1394 °C.
- Олово — имеет две аллотропные формы: серое олово (α-Sn) с алмазоподобной кристаллической решёткой в виде мелкокристаллического порошка и белое олово (β-Sn) в виде пластичного серебристого металла, а также одну аллотропическую модификацию гамма-олово (γ-Sn) с ромбической структурой. Оно высокотемпературное.
Видео
Большая Энциклопедия Нефти и Газа
Аллотропное видоизменение
Аллотропные видоизменения элементарного вещества – это вещества, молекулы которых различны, хотя и образованы атомами одного и того же химического элемента. Свойства аллотропных видоизменений одного и того же элемента, проявляемые в различных агрегатных состояниях, различны. Способность одного и того же вещества существовать в различных кристаллических формах называют полиморфизмом. Он может быть двух видов: энантиотропный, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотропный, когда одно видоизменение устойчивее другого независимо от температуры. Энантиотропные полиморфные видоизменения, таким образом, подобны агрегатным состояниям одного и того же вещества. Монотропные полиморфные видоизменения являются, по существу, аллотропными видоизменениями в кристаллическом состоянии. Таким образом, границы понятий аллотропии и полиморфизма не вполне совпадают. Следует отметить, что во многих случаях элементарные вещества в жидком и газообразном состояниях содержат молекулы, различные как по числу атомов, так и по структуре. Относительное содержание этих различных молекул в массе элементарного вещества зависит от температуры и других условий, причем изменение этих условий обычно приводит к возврату соответствующих равновесий. В связи с этим, а также с трудностью изоляции отдельных форм молекул последние не принято считать самостоятельными аллотропными видоизменениями. [1]
Аллотропные видоизменения элементарных веществ представляют собой вещества, построенные из различных молекул ( или кристаллов), образованных атомами одного и того же химического элемента. Аллотропные видоизменения одного элемента имеют различные свойства, проявляемые в различных агрегатных состояниях. Наряду с аллотропией известно также явление полиморфизма – способности одного и того же вещества существовать в различных кристаллических формах. Полиформизм может быть двух видов: э н а н т и отр о п н ы и, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотроп-н ы и, когда одно видоизменение устойчивее другого независимо от температуры. [2]
Аллотропные видоизменения элементарного вещества – это вещества, молекулы которых различны, хотя и образованы атомами одного и того же химического элемента. Свойства аллотропных видоизменений одного и того же элемента, проявляемые в различных агрегатных состояниях, различны. Способность одного и того же вещества существовать в различных кристаллических формах называют полиморфизмом. Он может быть двух видов: энантиотропный, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотропный, когда одно видоизменение устойчивее другого независимо от температуры. Энантиотропные полиморфные видоизменения, таким образом, подобны агрегатным состояниям одного и того же вещества. Монотропные полиморфные видоизменения являются, по существу, аллотропными видоизменениями в кристаллическом состоянии. Таким образом, границы понятий аллотропии и полиморфизма не вполне совпадают. Следует отметить, что во многих случаях элементарные вещества в жидком и газообразном состояниях содержат молекулы, различные как по числу атомов, так и по структуре. Относительное содержание этих различных молекул в массе элементарного вещества зависит от температуры и других условий, причем изменение этих условий обычно приводит к возврату соответствующих равновесий. В связи с этим, а также с трудностью изоляции отдельных форм молекул последние не принято считать самостоятельными аллотропными видоизменениями. [3]
Какие аллотропные видоизменения образует кремний. [4]
Какие аллотропные видоизменения образует бор. [5]
Какие аллотропные видоизменения фосфора вам известны. Какими свойствами они обладают и в чем различие этих свойств. [6]
Углерод образует аллотропные видоизменения . Одной из разновидностей углерода является древесный уголь, который получают при сухой перегонке древесины при относительно низкой температуре без доступа воздуха. [7]
Чем отличаются аллотропные видоизменения серы . [8]
Образует несколько аллотропных видоизменений . [9]
Из двух аллотропных видоизменений одного элемента наименее устойчивое обычно более реакционноспособно, более растворимо и имеет большее давление пара. Например, белый фосфор в противоположность красному имеет запах, несколько растворим в воде и значительно более реакционноспособен. [10]
Сколько бы аллотропных видоизменений ни образовывал химический элемент при каких-либо определенных, заданных условиях, абсолютно устойчивым из них оказывается, как правило, лишь какое-то одно. [11]
Сколько бы аллотропных видоизменений ни образовывал химический элемент при каких-либо определенных заданных условиях, абсолютно устойчивым из них оказывается, как правило, лишь какое-то одно. [12]
Существует ряд аллотропных видоизменений S ; наиболее важны: ромбическая сера – желтые кристаллы, плотн. Кроме этих кристаллических видоизменений серы, существуют еще аморфные модификации. Сера не растворяется в воде, хорошо растворяется в С8г ( одна из аморфных разновидностей не растворяется в нем), в толуоле. В продаже встречаются две технические разновидности серы: комовая ( газовая и природная) сера и серный цвет. Первая представляет собой главным образом ромбическую серу, содержит иногда примесь As и Se. Серный цвет ( мелкокристаллический порошок) – смесь серы, растворимой и не растворимой в С8г; менее чист, чем комовая сера. [13]
Известно несколько аллотропных видоизменений фосфора : белый, красный, черный и др. Образование их объясняется различным расположением атомов относительно друг друга в кристаллических решетках. [14]
Известно несколько аллотропных видоизменений фосфора . [15]
Аллотропия
— свойство некоторых химических простых тел (элементов) являться в двух или нескольких столь различных видоизменениях, что их можно принять за совершенно различные тела, если бы тождество их химической природы не было твердо установлено химическими превращениями. Аллотропические видоизменения, или модификации, известны для многих элементов. Хороший пример тому представляет углерод, являющийся или в виде алмаза, или в виде графита, или, наконец, в виде аморфного угля. Такие же видоизменения бывают у бора и кремния. Бесцветный, легко воспламеняющийся фосфор, нагретый в безвоздушном пространстве, точно так же превращается в красное аллотропическое видоизменение, не воспламеняющееся на воздухе и не имеющее ядовитых свойств, в такой сильной степени свойственных обыкновенному (желт.) фосфору.
Содержание
- 1 Дополнение
- 2 Примечания
- 3 См. также
- 4 Ссылки
Дополнение
(хим.) — понятие аллотропии введено в науку Берцелиусом («Jahresb.», 1841, стр. 13. «L. A.», 49, 247 [1844]; ср. Изомерия) для обозначения изомерных видоизменений элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений, если судить по словам: «Может быть несколько причин того, что мы называем изомерией, а именно:
1) А., если… пример двух железных колчеданов обусловлен содержанием в одном Sα, а в другом Sβ [1] ; 2) различное относительное положение атомов в соединении… и 3) в некоторых случаях и А., и неодинаковое положение атомов».
В настоящее время понятие А. большею частью прилагается к «изомерии» элементов; иногда, впрочем, говорят и об А. соединений, подразумевая при этом так называемую «физическую» изомерию, и наконец, только в самое последнее время в «твердых растворах» мы тоже возвратились к взгляду Берцелиуса и объясняем «изомерию», напр. стали (при различных условиях закалки), предсуществованием в ней аллотропических форм железа. Число известных случаев А. громадно. Между элементами они главным образом наблюдены для металлоидов. Только для галоидов (F, Cl, Вr и J) их неизвестно, если не принимать, однако, взгляда Лемана (см. ниже). Для металлоидов VI вертикальной группы периодической системы Менделеева известны явления А.: для кислорода (озон — см.), серы (см.) и селена (см.), но не теллура. Об А. металлоидов V группы см. Азот и Фосфор; для мышьяка известны теперь тоже три аллотропич. формы, а именно:
1) желтый прозрачный мышьяк, кристаллизующийся в правильной системе (в ромбических додекаэдрах), растворимый порядочно в сероуглероде и хуже в бензоле, глицерине и жирных маслах, быстро переходящий на свету и при нагревании во 2-е видоизменение (Schuller; Retgers, «Z. an. Gh.», 1894; Mс. Leod, «Chem. News», 70 и Linck, «Berl. Ber.», 1899); 2) мышьяк, кристаллизующийся в гексагональных ромбоэдрах, просвечивающий, отвечающий красному фосфору, и 3) мышьяк, тоже кристаллизующийся в гексагональных ромбоэдрах, но не просвечивающий, с металлическим серебристо-белым блеском, отвечающий металлическому фосфору (см. Retgers, «Z. an. Ch.», 1893 и XX, 287);
для сурьмы аллотропич. форм неизвестно, и так назыв. «взрывчатая», или аморфная, сурьма оказывается содержащей значительный количества треххлористой сурьмы (E. Cohen u. W. E. Ringer, «Z. ph. Ch.», 1904). В IV группе аллотропические формы известны для углерода (см.), кремния (см.) и в III для бора (см.).
Случаев аллотропии металлов известно пока мало; наиболее изучены аллотропические формы олова (см.) и железа (см.; ср. Retgers, «Zeit. ph. Ch.», 1894), но имеются еще указания на полиморфизм цинка, иридия, палладия, серебра (?) и золота (?) (Arzruni, «Beziehungen zw. Krystallform u. ch. Zusammensetzung», 3 ч. 1-го т. Graham-Otto’s «Ausführl. Lehrb. d. Ch.», стр. 36 [1898]; ср. еще M. И. Коновалов, «О видоизменениях (А.) простых тел или элементов», «Речи и отчеты Моск. Сельскохоз. Инст.» за 1899 г. и E. Petersen, «Zeitsch. ph. Ch.», 1891).
— Что касается аллотропии химически сложных тел, то вопрос и для них сводится обыкновенно на явления полиморфизма (см.), так как химических различий в большинстве случаев для них не известно [2] . Более известные случаи полиморфизма неорганических веществ указаны в ст. Полиморфизм; из органических веществ полиморфизм наблюден на бензофеноне, уксуснокислом изогидробензоине (Цинке), дибромопропионовой кисл. (Толленс), толилфенилкетоне (фан Дорп, Цинке), метахлорнитробензоле, хлординитробензоле (1, 3, 4) (Лаубенгеймер), бромистом углероде (Леман) и мн. других (список у Arzruni. 1. с., 55-58; более новые данные у Tammann’a, «Kristallisieren u. Schmelzen», Лпц., 1903). Никакой связи между полиморфизмом и составом пока не удалось установить, что, вероятно, находит объяснение в отрывочности имеющихся наблюдений (систематичны только работы Тамманна). Что касается общих условий полиморфизма (аллотропии), то достаточно указать, что явление это связано с твердым (кристаллическим) состоянием материи и неизвестно для аморфного (жидкого), и что потому пары (?), растворы и жидкости (?), полученные плавлением аллотропных форм, тождественны; что из двух аллотропных форм одна обыкновенно находится в малоустойчивом состоянии по отношению к другой (метастабильное состояние Оствальда; оно может быть довольно постоянным благодаря пассивным сопротивлениям); только при температуре (и давлении) точки перехода обе формы одинаково устойчивы, но возможность осуществления этой последней (точки перехода) зависит от того, имеется ли случай «энантио»- или «монотропии» (см.). Исчерпывается ли возможное разнообразие только этими двумя типами, нельзя еще считать окончательно установленным, судя по многим опытным данным (ср. Энолизация); возможно, однако, что усложнение (сравнительно с теорией) кажущееся, обусловленное медленностью превращений (W. Bancroft, «Journ. Ph. Ch.», 1898; P. Duhem, «Zeitschr. ph. Ch.», 1897). В заключение замечу, что факторами, вызывающими то или другое аллотропическое превращение, являются, при данной природе превращающегося тела, изменения температуры и давления; все такие превращения подчинены правилу фаз (см.), и, смотря по тому, имеем ли мы дело с ин- или унивариантными системами, мы можем отождествить наблюдаемые явления или с плавлением системы из одного слагаемого (конденсированные системы фан’т Гоффа, системы инвариантные), или с испарением однородной жидкости в замкнутом пространстве (при сосуществовании жидкости и пара — система унивариантная). Едва ли есть потому необходимость, как это делает Леман (Lehmaon, «Molekularphysik», I, 605—703), предполагать, что «твердое и жидкое состояние (одного и того же тела) представляют химически различные тела», что «в сущности, плавление представляет химическое разложение, а застывание — обратное образование» первоначального твердого тела, что «ни одно тело не обладает более, чем одним агрегатным состоянием, а так называемые три агрегатных состояния одного тела фактически суть три химически различных тела, хотя порядка не атомных, а молекулярных изомеров». Взгляд Лемана имеет, однако, сторонников между минералогами и изложен у Браунса («Химическая минералогия», пер. Белянкина. под ред. Левинсона-Лессинга, 175—180 [1904]; его критику см. К. Schaum, «Die Arten der Isomerie», Марбург, 4-13 [1897]).
Примечания
- ↑ Знаками α и βБерцелиус отличил аллотропические видоизменения серы.
- ↑ «Диморфные вещества, по моему мнению, — говорит Пастер, — изомерные вещества с очень мало различным расположением молекул; потому и химические свойства их мало изменены».
В статье воспроизведен материал из Большого энциклопедического словаря Брокгауза и Ефрона.
Аллотропия (греч.), способность некоторых химических элементов образовывать несколько аллотропических разновидностей, обладающих различными свойствами. Примеры: алмаз и графит — аллотропные видоизменения углерода; красный и желтый фосфор — фосфора, и т. д. Причина аллотропии по-видимому стоит в связи с различным строением внешних электронных орбит атома. См. Атом.
В статье воспроизведен текст из Малой советской энциклопедии.
Аллотропные модификации углерода


Средняя оценка: 3.9
Всего получено оценок: 187.
Средняя оценка: 3.9
Всего получено оценок: 187.
Соединения, образованные атомами углерода, но отличающиеся строением и свойствами, называются аллотропными модификациями углерода. Основными модификациями углерода являются графит, алмаз, карбин.
Классификация
Возможность присоединять четыре атома делает углерод активным элементом. Помимо присоединения атомов других элементов углерод может образовывать различные модификации, отличающиеся структурой и свойствами.
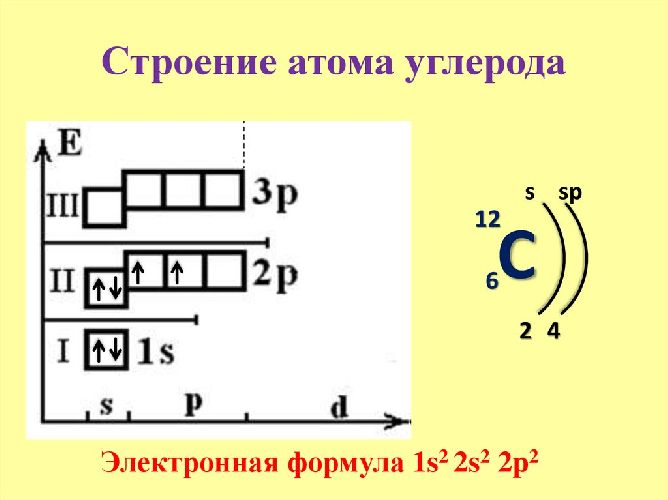 Рис. 1. Строение атома углерода.
Рис. 1. Строение атома углерода.
Выделяют два вида углерода в зависимости от образования модификаций:
- кристаллический – входит в состав твёрдых веществ;
- аморфный – образует мягкие вещества.
Кристаллические формы углерода:
- алмаз;
- лонсдейлит;
- наноалмаз;
- графит;
- графен;
- карбин;
- фуллерены;
- фуллерит;
- углеродное волокно;
- углеродные нановолокна;
- углеродные нанотрубки.
В соответствии с геометрическим строением кристаллической решётки выделяют три типа аллотропных модификаций:
- тетраэдрическая (sp 3 -гибридизация) – один атом углерода, находящийся в центре, связан с атомами в узлах тетраэдра;
- тригональная (sp 2 -гибридизация) – атомы углерода образуют шестиугольники, связанные друг с другом послойно;
- линейная (sp-гибридизация) – атомы углерода образуют цепочки, связанные одинарными, двойными, тройными связями.
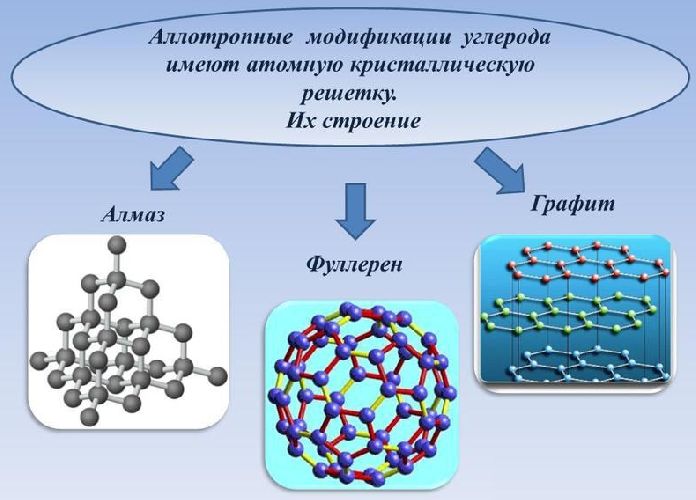 Рис. 2. Строение кристаллических решёток углерода.
Рис. 2. Строение кристаллических решёток углерода.
Аморфный углерод образует следующие модификации:
- активированный уголь;
- древесный уголь;
- ископаемый уголь;
- кокс каменноугольный;
- стеклоуглерод;
- углеродная нанопена;
- техуглерод;
- сажа.
Лонсдейлит является гексагональной модификацией алмаза. Наноалмазы, фуллерены, нанотрубки, нанографиты объединены в семейство наноуглеродных кластеров. Они образованы вложенными друг в друга углеродными сферами.
Основные модификации
Наиболее изучены твёрдые формы углерода – алмаз, графит и карбин. Особенности строения и свойства аллотропных модификаций углерода представлены в таблице.
Модификация
Строение решётки
Свойства
Применение
Относительно мягкий жирный минерал, обладающий электропроводностью. Имеет серый цвет, металлический блеск. Плотность – 2,23 г/см 3 . Не плавится. Реагирует со щелочными металлами, солями, кислородом
Смазка в прокатном производстве. За счёт отслоения тригональной решётки используется в качестве стержня карандаша
Мелкокристаллический порошок с небольшой плотностью. Полупроводник
Используется в фотоэлементах
Прозрачный минерал, обладающий наибольшей твёрдостью. Обладает теплопроводностью, является полупроводником. Имеет большой показатель преломления. Плавится при температуре 3700°C
Драгоценный камень, абразив. Из алмаза изготавливают свёрла, ножи, резцы
При сильном нагревании графит переходит в алмаз, а алмаз – в графит.

Что мы узнали?
Углерод имеет множество аллотропных модификаций. Основные из них – графит, алмаз, карбин. Они отличаются друг от друга физическими, химическими свойствами, строением кристаллической решётки. Наиболее твёрдая модификация – алмаз – используется для изготовления промышленных инструментов. Графит – мягкий минерал – применяется в прокатной промышленности. Благодаря строению способен отслаиваться, оставляя след, поэтому используется в качестве карандашного стержня. Карбин – порошок, который используется в фотоэлементах.
Химия соединений: свойства аллотропных модификаций углерода
Аллотропия — это возможность существования вещества в виде нескольких модификаций, отличающихся друг от друга физически и химически. Аллотропия возможна для элементов, характеризующихся способностью атомов к образованию гомогенных цепей. Наибольший интерес для современной химии представляют свойства аллотропных модификаций углерода, в основном из-за перспектив получения большего количества видоизменённых форм с полезными свойствами.
- Аллотропные преобразования и переходы
- Аллотропия углерода
- Видоизмененные формы углерода
Аллотропные преобразования и переходы
Наиболее характерны аллотропные преобразования для неметаллических веществ (кроме галогенов (хлор, бром, йод) и инертных газов (аргон, ксенон и неон)), полуметаллов и, реже всего, для металлов. Переходы элемента в иную форму, отличающуюся от его стандартной модификации, происходят при изменении условий окружающей среды. Основными факторами, влияющими на аллотропные преобразования, являются изменения давления и температуры, которые могут воздействовать на элементы как поодиночке, так и комплексно. Примерами элементов, обладающих аллотропией, и их модификациями являются:

- углерод, который можно назвать лидером по количеству изученных аллотропных форм;
- фосфор, для которого известны 11 аллотропных соединений;
- кислород, существующий в виде О2 (собственно, кислорода) и О3 (озона);
- железо, образующее четыре кристаллические модификации (α-Fe или феррит, β-Fe, γ-Fe или аустенит и δ-Fe);
- кремний, который может находиться как в аморфной, так и в кристаллической формах;
- азот, имеющий полимерную модификацию, в пять раз превышающую по мощности неядерные взрывчатые материалы.
Любое изменение может быть обратимым (т. е. при возвращении к нормальным условиям вещество переходит в свою стандартную форму), энантиотропным, или же необратимым, монотропным. К энантиотропным переходам относятся превращения серы из ромбической в моноклинную или же переход белого пластичного олова (бета-олова) в белое хрупкое (гамма-олово). Монотропное видоизменение происходит, например, при модификации белого фосфора в чёрный.
Аллотропия углерода

Углерод, как активный элемент с четырьмя свободными связями, способен образовывать два основных типа соединений: кристаллические — твёрдые и аморфные — мягкие или пластичные вещества. Высокое содержание аморфного углерода наблюдается в таких веществах, как различные виды угля (антрацит, ископаемый, древесный и активированный), техуглероде, саже, коксе и углеродной нанопене. Кристаллические формы углерода, в свою очередь, подразделяются по особенностям пространственного строения кристаллической решётки:
- тетраэдрические (sp-3 гибридизация);
- тригональные (sp-2 гибридизация);
- линейные (sp гибридизация).
Все аллотропные модификации углерода имеют существенные различия между собой начиная от способа их получения (например, естественный и искусственный), условий их формирования (температурные параметры и показатели давления) и заканчивая их применением.
Видоизмененные формы углерода
Основные критерии, указывающиеся в сводных таблицах примеров аллотропных модификаций, — это строение решётки, основные свойства (или так называемые полезные свойства, характеризующие ценность модификации для промышленности или науки) и отрасли применения материала.
| Название модификации | Строение решётки | Характеристика | Применение |
| Алмаз | Тетраэдрическая | Самое твёрдое вещество по шкале Мооса (10 баллов). Обладает высокой теплопроводностью, износостойкостью и модулем упругости. Способен к люминесценции | В качестве абразива, сдерживающего вещества в экспериментах с высоким давлением и в ювелирной промышленности |
| Лонсдейлит | Тетраэдрическая | 8 баллов по шкале Мооса. Прозрачен, индекс преломления составляет от 2,40 до 2,41 | В связи с чрезвычайной трудоёмкостью получения не имеет практического применения |
| Графит | Тригональная | Мягкий минерал, проводящий электричество. Не плавится, обладает химической активностью (реагирует с металлами, солями и кислородом) | Наиболее известен как материал для карандашного стержня, однако, также используется для изготовления электродов, плавильных тиглей, наполнителя для пластмасс и много другого |
| Графен | Тригональная | Двухмерная модификация углерода, представленная гексагональной кристаллической решёткой толщиной в 1 атом | Используется при создании транзисторов |
| Фуллерены | Тригональная | Состоят из молекул углерода в форме выпуклых многогранников | Применяются в лазерных технологиях, при получении искусственных алмазов и создании лекарств нового поколения |
| Наноалмазы | Тетраэдрическая | Наноструктуры с кристаллической решёткой по типу алмаза | В космической и медицинской отраслях промышленности |
| Карбин | Линейная | Мелкокристаллический порошок чёрного цвета со свойствами полупроводника. Кристаллическая решётка карбина состоит из множества линейных цепочек углерода, расположенных параллельно друг другу | Используется в фотоэлементах и в медицине для создания искусственных вен и артерий |
| Стеклоуглерод | Имеет аморфное строение | За счёт сложного, смешанного состава, характеризуется электропроводностью графита и твёрдостью, схожей с твёрдостью стекла. Устойчив к коррозии в агрессивных средах | Как материал для электродов и тиглей |
Исследование модификаций углерода позволяет не только получать конструкционные материалы с заданными свойствами, но и предсказывать возможность существования новых форм с уникальными характеристиками.
Так, например, одной из самых последних гипотез, стало предположение о получении Т-углерода, гораздо более легкого чем алмаз и обладающего 65% его твердости, что позволит использовать минерал в аэрокосмической отрасли.

Таким образом, в ближайшем будущем ожидается появление новых видоизмененных форм одного из самых распространенных элементов на земле. Однако уже известные его аллотропные модификациии, всё ещё будут использоваться в промышленности и науке за счёт особенностей своего строения, химических и физических свойств.
 энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.
энантиотропный переход — превращение ромбической серы (α-S) в моноклинную (β-S) при нормальном давлении и температуре 95,6 °C. При снижении температуры ниже 95,6 °С происходит обратный переход моноклинной формы в ромбическую.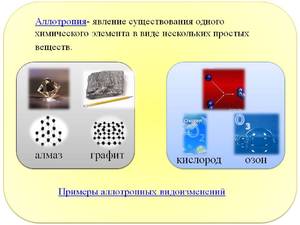 Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие.
Углерод — является лидером по количеству аллотропных форм и модификаций с абсолютно различными свойствами, а также строению кристаллических решеток. Самые распространенные из алмаз и графит. Есть также углеродные нанотрубки, лонсдейлит, фуллерен, карбин и многие другие. α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;
α-Fe или феррит. Имеет решётку объемноцентрированную кубическую. Существует до температуры 769 °C. Обладает свойствами ферромагнентики;



