Агрегатные состояния вещества и их свойства
Одно и то же вещество может пребывать в различных состояниях.
Например, вода при низких температурах превращается в лед, при комнатной температуре вода жидкая, а из носика горячего чайника, когда горячая вода в нем кипит, мы наблюдаем струйку пара.
Кроме того, мы привыкли любоваться облаками в небе. Облака – это большие скопления водяного пара, частичек воды и кристалликов льда – снежинок.
То есть, вода, может находиться в твердом, жидком и газообразном состояниях. Эти состояния называют агрегатными состояниями вещества.
Примечания:
- Пар – это газ. Процесс, при котором образуется пар, называется парообразованием.
- Даже при низких температурах вода испаряется. То есть, водяной пар в воздухе содержится даже при минусовой температуре.
- То, в каком состоянии будет находиться вещество, зависит от температуры и давления.
В природе агрегатные состояния воды изменяются часто. С поверхностей водоемов – рек, озер, морей и океанов, вода испаряется. Затем пар собирается в облака, эти облака переносятся ветром за многие километры. И на больших расстояниях от морей и рек, благодаря превращению воды в жидкость, по утрам выпадает роса, или идет дождь.

- из жидкого в газообразное состояние – парообразование (парообразование на поверхности — это испарение);
- из газообразного в жидкое состояние – конденсация;
В различных агрегатных состояниях могут находиться любые вещества в природе.
- при комнатной температуре – это твердое тело;
- нагретое до температуры 1540 градусов Цельсия — превращается в жидкость;
- а если его нагреть до температуры 2861 градус по шкале Цельсия, оно превратится в газ.
Благодаря тому, что металлы, и другие вещества можно превращать в жидкости при высоких температурах, из них изготавливают нужные нам части машин и другие предметы.
Важно! При переходе из одного агрегатного состояние в другое, молекулы вещества не изменяются. Изменяется лишь расстояние между ними и их взаимное действие на соседние молекулы.
Свойства агрегатных состояний
Физики изучили различные вещества, их свойства и то, при каких условиях эти вещества меняют свое агрегатное состояние.
Важно: Газы не имеют своей формы и не имеют своего объема. Они займут весь предложенный объем.
В газах расстояние между молекулами гораздо больше размеров самих молекул.
Притяжение между молекулами мало. А скорости молекул достаточно высоки. А чем выше скорость, тем больше энергия движения (кинетическая энергия) молекулы.
Поэтому, молекулы газа могут свободно перемещаться по всему объему, предоставленному этому газу. А если газ выпустить из баллона, то молекулы газа разлетятся во все стороны.
Примечание: При комнатной температуре молекулы воздуха движутся в среднем со скоростью, примерно 500 метров в секунду.
Жидкости
Важно: Жидкости не имеют своей формы, они займут предложенную им форму. Но, жидкости имеют свой объем.
В жидкостях молекулы располагаются очень близко, так, что они касаются друг друга. Поэтому, жидкости сжать не получается!
Однако, молекулы жидкости все еще могут передвигаться по всему объему жидкости. Но скорости молекул во много раз меньше, чем в газах. Поэтому, молекулы в жидкостях будут двигаться гораздо медленней.
Примечание:
- Когда мы сжимаем тело, мы уменьшаем расстояние между его молекулами.
- Физики иногда вместо слов «сжимать тело» говорят «уменьшать объем тела».
Твердые тела
Важно: Твердые тела имеют свою форму. Они, так же, имеют свой объем.
В твердых телах молекулы, как и в жидкостях, располагаются очень близко друг к другу. Однако, в твердых телах маленькие частички образуют решетчатую структуру. Поэтому, двигаться по твердому телу они не могут. Но под воздействием температуры они могут вибрировать (колебаться), оставаясь при этому на месте.
Все твердые тела по упорядоченности расположения маленьких частиц можно разделить на аморфные и кристаллические тела.

Различают аморфные и кристаллические твердые тела. То, будет ли твердое тело аморфным, или кристаллическим, зависит от того, насколько упорядочены мельчайшие частицы, из которых состоит это твердое тело — молекулы.
Химия
План урока:
В мире множество веществ, которые могут принимать разную форму. Вода в чайнике жидкая, а если начать ее кипятить, то она станет паром. Если эту же воду поставить в морозильную камеру, то она затвердевает. Вещества на нашей планете как актеры, которые могут играть разные роли.
Агрегатное состояние – принятие химическими веществами разной формы в зависимости от изменений внешней среды. Всего существует четыре состояния – газовое, жидкое, твердое, плазменное. Но к агрегатным относятся только три состояния– газ, жидкость и твердые вещества. В плазменном состоянии не сохраняется атомно-молекулярный состав вещества, а в трех других – сохраняется.
Агрегатное состояние вещества и фазовые переходы. Гуглдиск
Процесс перехода одного состояния в другое называется фазовым переходом. Он характеризуется изменением структуры связей между атомами, молекулами или ионами. Фазовый переход сопровождается поглощением или выделением теплоты. Ему сопутствуют скачкообразные изменения физических и химических свойств — плотности, растворимости и др.
Вещество изменяет агрегатное состояние при следующих условиях.
- Плавление – переход вещества из твердого состоянияв жидкое (таяние льда).
- Затвердевание – обратный плавлению процесс (зимние узоры на стекле).
- Парообразование – переход вещества из жидкого состояния вгазообразное (выделение пара из кипящего чайника).
- Конденсация – обратный парообразованию процесс (появление капель воды при принятии горячего душа).
- Сублимация, или возгонка – переход из твердого состояния в газообразное, минуя жидкую стадию(переход сухого льда в состояние углекислого газа).
- Десублимация – обратный сублимации процесс (появление инея на деревьях).
Газообразное состояние
Газ – состояние, при котором частицы вещества слабо связаны друг с другом, занимают все пространство и движутся хаотично. Расстояния между атомами и молекулами значительно превышают их размеры. Газовое состояние можно сравнить с футбольным полем, на котором быстро и независимо друг от друга передвигаются спортсмены. Футболисты, как и молекулыв газообразном состоянии, взаимодействуют только когда сталкиваются или близко подходят друг к другу.
Расположение молекул газа.
Газообразное состояние находится в виде различных запахов. У газов нет формы и объема, поэтому частицы распространяются по всему пространству. Например, запах газа из невыключеннойплиты быстро охватывает всю квартиру благодаря хаотичности движения молекул и их стремлению заполнить все помещение.
Газы обладают следующими особенными свойствами.
- Равномерность заполнения всего объема.
- Небольшая плотность при высокой скорости диффузии.
- Легкое сжатие.
Газообразноеагрегатное состояние веществаможно оценивать как насыщенный и ненасыщенный пар. Если число молекул, вылетающих из жидкости, станет равным числу молекул пара, возвращающихся в жидкость, то возникает динамическое равновесие между паром и жидкостью – состояние насыщенного пара. В ненасыщенном такого равновесия нет.
При нахождении жидкости в открытом сосуде, объем вещества уменьшается из-за испарения. Если поместить ту же жидкость в закрытый сосуд, объем вещества останется прежним. Сначала начнется процесс испарения и продолжается до тех пор, пока число покинувших жидкость молекул не станет равно возвратившимся назад из паров. Т.е. в закрытом сосуде возникает динамическое равновесие. Изменение внутренней энергии вещества определяется по формуле:
ΔU = ± mr, где m — масса тела, r — удельная теплота парообразования.
Переход веществиз газообразногов жидкое состояние, называется сжижением. Увеличение давления и понижение температуры приводит к уменьшению расстояний между молекулами, увеличению силы взаимодействия и превращению в жидкость. Сжижение характеризуется критической температурой. Она определяется в точке, в которой переход газа в жидкость невозможен.
Жидкое состояние
Жидкость – состояние, в котором происходит заполнение частицами всего объема. В отличие от газов, у жидкости есть поверхность. Также для нее характерно высокое межмолекулярное взаимодействие и низкая сжимаемость. Частицы в жидкости располагаются как гости, приглашенные в небольшую квартиру. Приглашенные, как и молекулы, свободно передвигаются в пространстве и ведут себя по-разному. Из-за того, что гостей много, человеку необходимо постоянно оглядываться, чтобы ни на кого не натолкнуться. Присутствующиенаходятся близко друг к другу.
Жидкие вещества. Гуглдиск:
Жидкое агрегатное состояниеобладает особенным свойством – текучестью. Она объясняется тем, что частицы колеблются внутри квазикристаллической решетки и перемещаются между ними. Получается сложная траектория — колебания вокруг центра, перемещающегося в пространстве.
Твердое состояние
Твердому состоянию свойственна высокая степень упорядоченности частиц. Каждая молекулаколеблется около среднего положения, оставаясь жестко связанной с соседями и образуя кристаллическую решетку. Твердое агрегатное состояние напоминает воинскую часть, в которой все подчиняется строгим правилам. В строю, как и в твердых веществах, каждому солдату предоставлено определенное место. Самостоятельное перемещение внутри строя запрещается. Солдаты стоят плотно плечом к плечу, расстояния между ними маленькие. Столкновения внутри строя невозможны.
Твердые вещества имеют форму и сохраняют свой объем. Их классифицируют на несколько видов.
- Аморфные – вещества, в которых относительно упорядоченные частицы имеют сильные ковалентные, полярные и неполярные, ионные, металлические связи.
- Кристаллические – вещества, в которых частицы расположены строго по своим местам.
Аморфные тела по свойствам напоминают жидкости,так как их молекулы передвигаются между хаотично расположенными условными центрами. Примерами аморфных веществ служат пластмассы, смолы и другие неметаллы. Примеры кристаллических тел – железо, серебро и другие металлы.
Нагревание кристаллических веществ ведет к нарушению расположения частиц и увеличению расстояний между ними. При достижении температуры плавленияпроисходит перестройка молекул, и твердое тело превращаетсяв жидкое. Количество теплоты, которое необходимо для расплавления некоторой массы веществ, подчиняется формуле:
Q = km, где k — удельная теплота плавления этого вещества, m — его масса.
Плазма
Плазма – не выдумка из фантастических фильмов и книг, а ионизированный газ. Она характеризуется одновременным присутствием нейтральных и заряженных частиц. Ионизаторы воздуха строятся на принципе перехода из газообразного вещества в плазму.
Получить плазму сложно, т.к. для этого вещество необходимо нагревать до температур порядка сотен тысяч градусов и выше. Полученная смесь состоит из электронов, ядер и положительно заряженных ионов. Плазма электронейтральна, но обладает высокой проводимостью. Внутри нее происходят непрерывные разрежения и сгущения, сопровождающиеся образованием плазмоидов — упорядоченных структур правильной формы. Хотя плазма на нашей планете – редкое явление, каждый человек хотя бы раз в жизни сталкивался с ней. Плазменное состояние характерно для северного сияния и молний. В масштабах Вселенной основная масса вещества находится в виде плазмы.
Сводная таблица агрегатных состояний
Области применения агрегатных состояний
Способность веществ переходить из одного агрегатного состояния в другой активно используется человеком. На ней основаны многие промышленные процессы.
- Способность металлов плавиться и принимать различную форму используется в черной и цветной металлургии.
- При получении соли и других химических соединений применяется выпаривание, при котором вещество получается после испарения жидкости.
- Инертные газы используются в осветительных приборах.
- Жидкий кислород применяется в медицине в качестве средства анестезии.
Таким образом, без различных агрегатных состояний невозможно было бы представить жизнь на планете. Фазовые переходы веществ используются практически во всех областях жизнедеятельности.
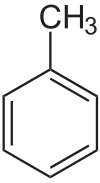
Толуол
| Толуол | |
 |
|
| Общие | |
|---|---|
| Химическая формула | C6H5-CH3 |
| Физические свойства | |
| Молярная масса | 92,14 г/моль |
| Плотность | 0,86694 г/см³ |
| Термические свойства | |
| Температура плавления | −95 °C |
| Температура кипения | 110,6 °C |
| Критическая точка | 320 °C (593 K), 4299 кПа |
| Удельная теплота испарения | 364000 Дж/кг |
| Химические свойства | |
| Растворимость в воде | 0,053 г/100 мл |
| Классификация | |
| Рег. номер CAS | 108-88-3 |
| SMILES | 1= CC1=CC=CC=C1 |
Толуо́л (от исп. Tolu , толуанский бальзам) — метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пельтье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил свое название.
Содержание
Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных пределах с углеводородами, многими спиртами и эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положения относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Концентрационный предел распространения пламени, %об [1,27;6,8]. Температурный предел распространения пламени, °C [6;37]. Температура вспышки 4 °C.
- Взаимодействие с перманганатом калия в кислой среде:
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан. Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты нельзя забывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (менее 30 °C). Толуол также образует с водой азеотропную смесь [1] . [2]
Толуол можно получить из бензола по реакции Фриделя-Крафтса:

Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам, (САНПИН, меры предосторожности при работе с летучими органическими растворителями) толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов, и создать предпосылки для возникновения энцефалопатии. Толуол обладает также канцерогенным действием.
Примечания
- ↑Толуол
- ↑ Гордон А., Форд Р. Спутник химика.//Перевод на русский язык Розенберга Е. Л., Коппель С. И. Москва: Мир, 1976. — 544 с.
Ссылки
- Toxicological Profile for Toluene (ver. September 2000) // ATSDR
- Краткие технические характеристики толуола
- ГОСТ 14710-78. Толуол нефтяной. Технические условия.

- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
Wikimedia Foundation . 2010 .
- Цыганов, Дмитрий Михайлович
- Сопрограмма
Смотреть что такое “Толуол” в других словарях:
ТОЛУОЛ — Углеводород, встречается в каменноугольном масле, аромат. жидкость. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ТОЛУОЛ иначе метил бензол, душистая жидкость, добываемая из смолы, образующаяся при перегонке… … Словарь иностранных слов русского языка
Толуол — – бесцветная подвижная летучая жидкость с резким запахом, применяемая как растворитель. Химическое наименование толуола – метилбензол. Горюч, сгорает коптящим пламенем. Толуол выступает сырьем для производства бензола, бензойной… … Нефтегазовая микроэнциклопедия
толуол — метилбензол Словарь русских синонимов. толуол сущ., кол во синонимов: 4 • ароматика (5) • … Словарь синонимов
толуол — а, м. toluol < Tolu название порта в Колумбии + лат. oleum масло. Органическое соединение: бесцветная жидкость, получаемая из каменноугольной смолы. Применяется при производстве красителей, взрывчатых веществ и лекарственных препаратов. Крысин … Исторический словарь галлицизмов русского языка
ТОЛУОЛ — C6H5CH3, бесцветная жидкость, tкип 110,6 .С. Содержится в больших количествах в каменноугольной смоле и продуктах нефтепереработки. Применяется для получения взрывчатого вещества (тринитротолуол), красителей, фармацевтических препаратов, для… … Большой Энциклопедический словарь
ТОЛУОЛ — (метилбензол), ароматический УГЛЕВОДОРОД (С6Н5СН3), получаемый из каменноугольной смолы или нефти. Бесцветная горючая жидкость; широко используется как промышленный растворитель, а также в авиационном и автомобильном горючем (в некоторых странах… … Научно-технический энциклопедический словарь
ТОЛУОЛ — ТОЛУОЛ, толуола, мн. нет, муж. (от имени города Santiago de Tolu в Колумбии и лат. oleum масло) (хим.). Ароматический жидкий углеводород, получаемый сухой перегонкой нефтяных остатков, смол и др. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ТОЛУОЛ — органическое соединение, жидкий углеводород из группы бензола. Получается при перегонке каменного угля и синтетически из других соединений. Вместе с бензолом применяется для получения взрывчатых веществ, многих химических продуктов и т. д.… … Морской словарь
ТОЛУОЛ — (C6H5CH3) бесцветная жидкость. Содержится в каменноугольной смоле и продуктах нефтепереработки. Применяют для получения взрывчатых веществ (тринитротолуол), красителей, фармацевтических препаратов, для синтеза органических соединений и как… … Российская энциклопедия по охране труда
ТОЛУОЛ — ТОЛУОЛ, С7Н8,или / СН3 метил бензол, второй член гомологического ряда ароматических углеводородов. Находится в каменноугольной смоле и получается из нее фракционированной перегонкой, благодаря чему продажный Т. обычно содержит примеси посторонних … Большая медицинская энциклопедия
Толуол

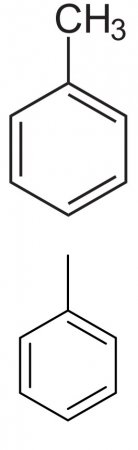
Толуол (от исп. Tolu , толуанский бальзам) — метилбензол, PhMe — бесцветная жидкость с характерным запахом, относится к аренам.
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название.
Содержание
- 1 Общая характеристика
- 2 Химические свойства
- 3 Получение и очистка
- 4 Применение
- 5 Опасность и обращение
- 6 Толуоловая токсикомания

Общая характеристика
Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, не смешивается с водой. Показатель преломления света 1,4969 при 20 °C. Горюч, сгорает коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
- Взаимодействие с перманганатом калия в кислой среде:
5C6H5CH3 + 6KMnO4 + 9H2SO4 → → 5C6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O
- Взаимодействие с перманганатом калия в нейтральной среде
C6H5CH3 + 2KMnO4 → C6H5COOK + 2MnO2 + KOH + H2O
- Взаимодействие с галогенами на свету
C6H5CH3 + X2 → hν C6H5CH2X + HX
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией.Также хорошие выходы достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, только в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол также образует с водой азеотропную смесь.
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
C6H6 + CH3Br → FeBr3 C6H5CH3 + HBr 

Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и др. органических веществ.
Является растворителем для многих полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3 — 6,7 %. Обладает слабым наркотическим действием.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, очень токсичен, его длительное воздействие может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»).

Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646 являются галлюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея “Момент”, заменив его ацетоном.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH – | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | Н | |
| F – | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | – | Н | Р | Р |
| Cl – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | – | – | – | Н | – | – | Н | – | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | – | Н | ? | Н | Н | ? | М | М | – | Н | ? | ? |
| HSO3 – | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Н | Р | Р |
| HSO4 – | Р | Р | Р | Р | Р | Р | Р | Р | – | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р |
| NO2 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | – | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO – | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | – | Р | Р | Р | Р | Р | Р | Р | – | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2
Скопируйте эту ссылку, чтобы разместить результат запроса ” ” на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса ” ” содержит ошибку, нажмите на кнопку “Отправить”. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки – помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация – такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Толуол — формула, свойства и применение химического веществаТолуол — метилбензол, бесцветная жидкость с запахом, принадлежит к аренам. Он является ароматическим углеводородным растворителем, и его природные источники включают сырую нефть в небольших количествах. Альтернативные названия: этилбензол, анисен, фенилметан. Толуол получают в процессе производства бензина и других разновидностей топлива из сырой нефти, при производстве кокса из угля, а также в качестве побочного продукта при изготовлении стирола. Физиологические качестваТолуол (метилбензол) считается мутной эмульсией с резким запахом, показывает слабое наркотическое влияние, нерастворим в воде, превосходно открывается в базовых растворителях, воздействует на полимеры. Температура полного кипения — 110.60 гр. Содержит сладковатый аромат, напоминающий запах красок, лаков. Горючее вещество коптит сажей. Метилбензол менее токсичен, чем бензол.
Структурная основаСостав базового продукта, состоящего лишь только из атомов углерода и водорода, демонстрирует формулу толуола. Между ним и бензолом есть однотипность, которая состоит в кольце из 6 углеродных атомов при гибридизации. В гомологах отличие от составляющих одного и того же соответствующего ряда есть. Любая из составляющих формирует 3 сигма-связи с примыкающими частичками (2 атома углерода и 1 водорода). Отвесно кольцу есть только 1 система из негибридных P-орбиталей (единственная из 6 углеродных атомов). В итоге вещество получает свои свойства от пройденного цикла. Уплотнённость между углеродными атомами, компонентами ядра, распределена пропорционально. Наружный вид отражается в бензольной формуле. Ключевая формула в этом случае отражает главные структурированные особенности молекулы. Метильная категория обладает возможностью быть в любом из 6 атомов ядра, они эквивалентны друг другу.
Получение этилбензолаСуществует несколько типов технологических моделей, используемых для производства. Установки для создания бензола, за некоторыми исключениями, служат одновременно для получения толуола и ксилола (который либо разделяется в виде чистого продукта, либо алюминия на бензол). Выбор метода производства является стратегическим решением, которое зависит от доступного сырья, стоимости и спроса на рынке. Сырье, используемое для производства ароматических соединений, пиролитического газа и риформиата, является побочным продуктом процесса производства олефинов и бензина, это также смесь фракций, которые можно разделить способом, который индивидуально выбран под конкретный состав сырья. Наиболее распространенным методом отделения бензола от других компонентов, образующих азеотропную смесь, является сложный метод физического разделения, включая дистилляцию и экстракцию растворителем. Используются азеотропная, экстракционная перегонка, жидкокристаллическая кристаллизация и адсорбция на цеолитах. Установки для производства ароматизаторов, как правило, расположены вблизи комплексов нефтеперерабатывающего отделения. Реакция окисленияАтомы водорода в молекулах могут быть реакцией замещения, что практически подготавливает арены. Метилбензол больше реактивен, чем бензол. Общее вещество характеризуется окислением. Горение связано с выделением углекислого газа и воды. С толуолом и калием метильная молярная категория в передней цепочке молекулы окисляется вплоть до алкилирования карбоновой кислоты. В итоге взаимодействия с формулой толуола химические свойства могут меняться. Бромирование, которое проводят с катализаторами, выходит на галогенированное вещество. Нитрование бромтолуола осуществляется консистенцией, складывающейся из фиксированной серной и азотной кислот. Нитрогруппа толуола имеет возможность откликаться на орто- и параположение. Реакция идёт сообразно электрофильному замещению. При высочайшей температуре элемент может реагировать и бывает обнаружен взрывчатый бензойный тринитротолуол (ТНТ), который несет опасность. Внедрение толуолаВещество имеет многочисленные коммерческие и промышленные применения и является растворителем в красках, лаках, разбавителях, клеях, корректирующей жидкости для снятия лака, а также используется в процессах печати и дубления кожи. Толуол химического качества является весомым сырьём для органического синтеза, изготовления высокооктановых составляющих моторных топлив, приготовления взрывчатых веществ, медицинских препаратов, красителей и растворителей. Как ведомый компонент он входит в состав лаков. Толуол молекулярный обширно применяется в качестве начального вещества в органическом синтезе и гидрировании. Это значительный элемент при дегидрировании большого числа веществ. Использование толуола:
Он сокращает микровязкость покрытий, применяется для лаков и красок. Его сочетания могут вступать в реакцию при многих производствах. Растворители присваивают краске особенную густоту, уничтожают твёрдые вещества (сухой лак). Метилбензол растворяет полимер. Используется вещество в базовом синтезе, парфюмерии и косметологии, военной промышленности, топливной, врачебной, лакокрасочной индустрии. Метилбензол, изготовленный по ГОСТу, доступен для реализации и имеет возможность применяться в будничной жизни. Высочайшая токсичность у метилбензола, он является горючим материалом. Паровоздушная смесь взрывается под определённым воздействием. Изомер огнеопасен. Структурная формула акцентирует представление о составе и текстуре. Есть информация о действии на организм человека. Было определено, что метилбензол токсичен и владеет канцерогенным воздействием. Улетучивания его быстро попадают на кожу, в органы дыхания, провоцируют изменения в нервной системе, недоброкачественность покрова, воспаление. При вдыхании нефтяных паров у человека отмечается затормаживание, трепет, нарушается работа вестибулярного аппарата. При работе с толуолом, красками, растворителями надо всё делать в резиновых перчатках, хорошо проветривать здание. Метилбензол считается наркотическим веществом, вызывающим подневольность при злоупотреблении. Иные побочные эффекты:
Значимость в примененииТолуол производится в больших количествах на нефтезаводах или же в качестве второстепенного продукта на коксохимических предприятиях и имеет различную плотность, массу. Он считается важным сырьём для крупномасштабного органического синтеза, применяемого в фармацевтической индустрии. Метилбензол не опасается света и выпускается буквально во всех формах растворителей, что применяются при работе с красками. При работе с материалом сосредоточение его паров в атмосфере не должно превышать показателей, определённых санитарно-гигиеническими общепринятыми стандартами.
Вещество воздействует на экологию, и это связано с выбросом его в атмосферу:
Ядовитые качества толуола небезопасны для самочувствия человека, вследствие этого его надо использовать с предосторожностью. Реферат: Толуол свойства, применение, получениеВыполнил7. Список литературы Арены или ароматические углеводороды – это соединения, молекулы которых содержат устойчивые циклические группы атомов (бензольные ядра) с особым характером химических связей.
Общая формула класса: Cn H2n-6 . Простейшими представителями класса являются бензол и толуол:
Многоядерные арены: нафталин С10 Н8 , антрацен С14 Н10 и др. Термин “ароматические соединения” возник давно в связи с тем, что некоторые представители этого ряда веществ имеют приятный запах. Однако в настоящее время в понятие “ароматичность” вкладывается совершенно иной смысл. Ароматичность молекулы означает ее повышенную устойчивость, обусловленную делокализацией p-электронов в циклической системе. Критерии ароматичности аренов: 1. Атомы углерода в sp 2 -гибридизованном состоянии образуют циклическую систему. 2. Атомы углерода располагаются в одной плоскости (цикл имеет плоское строение). 3. Замкнутая система сопряженных связей содержит
2. Толуол – формула, строение. Толуол по своему строению подобен бензолу, отличием является лишь замещение одного атома водорода на группу (CH3 ). Рассмотрим строение бензола. В 1825 году английский исследователь Майкл Фарадей при термическом разложении ворвани выделил пахучее вещество, которое имело молекулярную формулу C6 Н6 . Это соединение, называемое теперь бензолом, является простейшим ароматическим углеводородом.
Распространенная структурная формула бензола, предложенная в 1865 году немецким ученым Кекуле, представляет собой цикл с чередующимися двойными и одинарными связями между углеродными атомами:
Четвертая негибридная гантелеобразная p- орбиталь атомов углерода расположена перпендикулярно плоскости направления s- связей. Она состоит из двух одинаковых долей, одна из которых лежит выше, а другая – ниже упомянутой плоскости. Каждая p- орбиталь занята одним электроном. р- Орбиталь одного атома углерода перекрывается с p- орбиталью соседнего атома углерода, что приводит, как и в случае этилена, к спариванию электронов и образованию дополнительной p- связи. Однако в случае бензола перекрывание не ограничивается только двумя орбиталями, как в этилене: р- орбиталь каждого атома углерода одинаково перекрывается с p- орбиталями двух смежных углеродных атомов. В результате образуются два непрерывных электронных облака в виде торов, одно из которых лежит выше, а другое – ниже плоскости атомов (тор – это пространственная фигура, имеющая форму бублика или спасательного круга). Иными словами, шесть р- электронов, взаимодействуя между собой, образуют единое p- электронное облако, которое изображается кружочком внутри шестичленного цикла:
3. Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней не растворяются, однако легко растворяются в органических растворителях – спирте, эфире, ацетоне. Физические свойства некоторых аренов представлены в таблице.
4. Химические свойства. Все свойства толуола можно разделить на 2 типа: А) реакции, затрагивающие бензольное кольцо, Б) реакции, затрагивающие метильную группу.
2) Хлорирование толуола может производиться путём пропускания через толуол газообразного хлора в присутствии хлорида алюминия (реакция проводится в темноте). Хлорид алюминия играет при этом роль катализатора. В этом случае образуется 2- и 4-замещённый изомеры:
3) Сульфирование метилбензола концентрированой серной кислотой тоже приводит к образованию смеси 2- и 4-замещённого изомеров:
Механизм всех реакций электрофильного замещения подобен механизму сообветствующих реакций бензола. В этих реакциях 3-замещённые изомеры образуются в незначительных количествах и ими можно пренебречь. Реакции в боковой цепи. Метильная группа в метилбензоле может вступать в определённые реакции, характерные для алканов, но также и в другие реакции, не характерные для алканов. Обратим внимание, что эта реакция представляет собой замещение. Дальнейшее галогенирование приводит к образованию следующих соединений: Бромирование метилбензола осуществляется при аналогичных условиях и приводит к образованию соответствующих бромозамещающенных соединений. Метильная боковая цепь в толуоле подвергается окислению даже такими сравнительно мягкими окислителями, как оксид марганца (IV):
Более сильные окислители, например перманганат калия, вызывают дальнейшее окисление: Известны следующие способы получения ароматических углеводородов.
Ароматические углеводороды являются важным сырьем для производства различных синтетических материалов, красителей, физиологически активных веществ. Так, бензол – продукт для получения красителей, медикаментов, средств защиты растений и др. Толуол используется как сырье в производстве взрывчатых веществ, фармацевтических препаратов, а также в качестве растворителя. Винилбензол (стирол) применяется для получения полимерного материала – полистирола. |












 Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными “полуторными ” связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp 2 – гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
Однако физическими, химическими, а также квантово-механическими исследованиями установлено, что в молекуле бензола нет обычных двойных и одинарных углерод–углеродных связей. Все эти связи в нем равноценны, эквивалентны, т.е. являются как бы промежуточными “полуторными ” связями, характерными только для бензольного ароматического ядра. Оказалось, кроме того, что в молекуле бензола все атомы углерода и водорода лежат в одной плоскости, причем атомы углерода находятся в вершинах правильного шестиугольника с одинаковой длиной связи между ними, равной 0,139 нм, и все валентные углы равны 120°. Такое расположение углеродного скелета связано с тем, что все атомы углерода в бензольном кольце имеют одинаковую электронную плотность и находятся в состоянии sp 2 – гибридизации. Это означает, что у каждого атома углерода одна s- и две p- орбитали гибридизованы, а одна p- орбиталь негибридная. Три гибридных орбитали перекрываются: две из них с такими же орбиталями двух смежных углеродных атомов, а третья – с s- орбиталью атома водорода. Подобные перекрывания соответствующих орбиталей наблюдаются у всех атомов углерода бензольного кольца, в результате чего образуются двенадцать s- связей, расположенных в одной плоскости.
 Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.
Реакции в ароматическом кольце. Метилбензол вступает во все реакции электрофильного замещения, свойственные для бензола.

 Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.
Подобно алканам, метильная группа может галогенироваться по радикальному механизму. Для осуществления этой реакции хлор продувают через кипящий метилбензол в присутствии солнечного света или источника ультрафиолетового излучения.

 3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).
3) Циклическая тримеризация ацетилена и его гомологов над активированным углем при 600°C (Н.Д.Зелинский).



