Альдегиды


Средняя оценка: 4.2
Всего получено оценок: 418.
Средняя оценка: 4.2
Всего получено оценок: 418.
Органические соединения, содержащие альдегидную группу -СН=О, называются альдегидами. Вместе с кетонами они относятся к карбонильным веществам. Общая формула альдегидов и кетонов – CnH2nO или R-CHO.
Гомологи
Гомологический ряд альдегидов С-С10:
- метаналь или формальдегид (CH2O);
- этаналь или ацетальдегид (C2H4O);
- пропаналь (C3H6O);
- бутаналь (C4H8O);
- пентаналь (C5H10O);
- гексаналь (C6H12O);
- гептаналь (C7H14O);
- октаналь (C8H16O);
- нонаналь (C9H18O);
- деканаль (C10H20O).
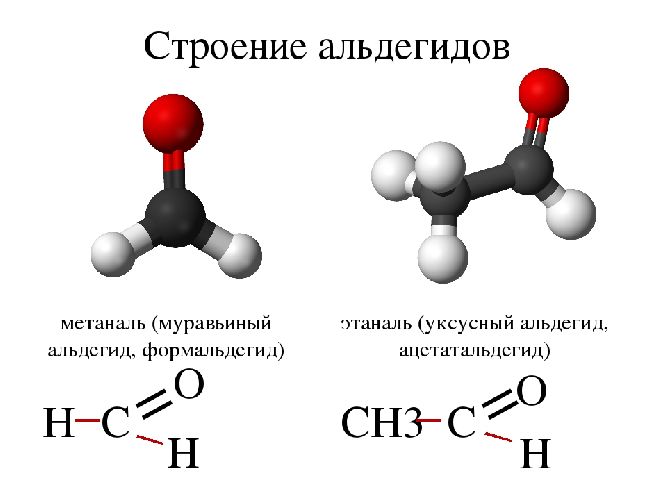 Рис. 1. Схема строения альдегидов.
Рис. 1. Схема строения альдегидов.
Названия альдегидов, согласно номенклатуре ИЮПАК, образуются с помощью прибавления к названию алканов суффикса «аль» или «диаль» (у диальдегидов). Также в литературе встречаются тривиальные названия. Например, альдегид муравьиный (метаналь), уксусный (этаналь), валериановый (пентаналь).
Классификация альдегидов по двум признакам приведена в таблице.
Признак
Описание
Пример
Возможность образовывать новые связи
Содержат максимальное количество атомов водорода
Способны присоединять атомы водорода
Циклические соединения с тремя двойными связями
Количество карбонильных групп
Содержат только одну группу =С=О
Содержат две группы =С=О
Альдегидам, начиная с бутаналя, характерны два вида изомерии: межклассовая с кетонами и структурная. Например, изомерия углеродного скелета: СН3-СН2-СН2-СН=О (бутаналь) и СН3-СН(СН3)-СН=О (2-метилпентаналь). При присоединении к водороду метиленовой группы СН2 из пропаналя образуется пропанол (ацетон): СН3-СН2-СОН → СН3-СО-СН3.
Получение
-
окислением спиртов оксидом меди (II):
Физические свойства
Физическое состояние альдегидов зависит от количества атомов углерода:
- формальдегид – газообразное вещество;
- альдегиды, содержащие от двух до 12 атомов углерода, – жидкости;
- альдегиды с 13 и более атомами углерода – твёрдые вещества.
Температуры кипения альдегидов, имеющих линейное строение, выше, чем у разветвлённых изомеров. Плотность, вязкость, показатель преломления при нормальных условиях увеличиваются с возрастанием молекулярной массы.
Два первых альдегида в гомологическом ряду – формальдегид и этаналь – неограниченно смешиваются с водой. Далее в гомологическом ряду растворимость уменьшается с увеличением углеродного скелета. Альдегиды хорошо растворяются в спиртах, эфирах и других органических растворителях.
Гомологи С8-С13 используются в парфюмерной промышленности.
Химические свойства
Функциональная альдегидная группа определяет химические свойства альдегидов, которые аналогичны свойствам кетонов. Ниже описаны основные реакции с альдегидами.
Реакция
Описание
Уравнение
Альдегиды присоединяют молекулы воды, спиртов, тиололов, неорганических солей, аминов по двойной связи карбонильной группы
При взаимодействии с водородом образуются спирты
Качественные реакции оксидом серебра («серебряное зеркало») и гидроксидом меди (II) с образованием красного осадка

Что мы узнали?
Из урока химии 10 класса узнали, что такое альдегиды. Это родственные кетонам вещества, содержащие группу -СН=О. Альдегиды образуют гомологический ряд с общей формулой CnH2nO. Названия в ряду соответствуют названиям алканов с суффиксом «аль». Простейший альдегид – формальдегид или метаналь – бесцветный газ. Альдегиды ряда С2-С12 – жидкости. Высшие альдегиды с 13 и более атомами углерода – твёрдые вещества. Альдегиды участвуют в реакциях окисления, восстановления, присоединения.
Альдегиды
Альдегиды являются представителями карбонильных соединений.
Карбонильные соединения (оксосоединения) – это производные УВ, содержащие в молекуле карбонильную группу С = О.

Альдегиды – это органические соединения, молекулы которых содержат альдегидную группу, связанную с углеводородным радикалом.
В зависимости от характера углеводородного радикала, связанного с альдегидной группой, альдегиды разделяются на предельные, непредельные и ароматические.
Предельные (насыщенные) альдегиды

Гомологический ряд


Номенклатура и изомерия
Название альдегида по международной номенклатуре образуется от названия соответствующего алкана с таким же числом атомов углерода с добавлением окончания –аль. Нумерацию углеродной цепи начинают от атома углерода альдегидной группы.
В пределах класса альдегидов возможен только один вид изомерии – изомерия углеродной цепи.
Физические свойства
Низшие альдегиды имеют резкий запах, высшие альдегиды, содержащие 8—12 атомов «С», — душистые вещества. Альдегиды с 1—3 атомами «С» хорошо растворяются в воде; с увеличением числа атомов «С» растворимость уменьшается. Все альдегиды растворяются в органических растворителях.
Альдегиды раздражают слизистые оболочки глаз и верхних дыхательных путей, вредно влияют на нервную систему.
Химические свойства
Альдегиды — один из наиболее реакционноспособных классов органических соединений, что связано с наличием в их молекулах высокополяризованной карбонильной группы >С=О.
Для альдегидов характерны реакции присоединения, окисления, полимеризации и поликонденсации.
I. Реакции присоединения
1.Гидрирование (восстановление) с образованием первичных спиртов RCH2ОH:

2.Присоединение спиртов с образованием полуацеталей:

Гидроксильная группа полуацеталей очень реакционноспособна.
В присутствии катализатора – хлороводорода и при избытке спирта образуются ацетали RCH(OR)2:
3.Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов:
Этой реакцией часто пользуются для выделения альдегидов из смесей или с целью их очистки.
II. Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С—Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению. Альдегиды легко окисляются до карбоновых кислот с тем же числом углеродных атомов различными окислителями (сильные окислители: О2 воздуха, подкисленный раствор K2Cr2O7 или КМnО4, слабые окислители: аммиачный раствор оксида серебра (I), щелочной раствор сульфата меди (II) и др.):
Реакции с аммиачным раствором оксида серебра (I) и щелочным раствором сульфата меди (II) являются качественными реакциями на альдегиды.
1.Взаимодействие с аммиачным раствором оксида серебра (I) — «реакция серебряного зеркала».
Оксид серебра (I) образуется в результате взаимодействия нитрата серебра(I) с NH4ОH:
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
2.Взаимодействие с гидроксидом меди (II)
Для реакции используют свежеприготовленный Cu(OH)2 образующийся при взаимодействии растворимой соли меди (II) со щелочью:
III. Реакции полимеризации (характерны для низших альдегидов)
1.Линейная полимеризация
При испарении или длительном стоянии раствора формальдегида происходит образование полимера— параформальдегида:

Полимеризация безводного формальдегида в присутствии катализатора — пентакарбонила железа Fe(CO)5 — приводит к образованию высокомолекулярного соединения— полиформальдегида (полиоксиметилен, полиметиленоксид):

2.Циклическая полимеризация (тримеризация, тетрамеризация)
Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Уксусный альдегид образует циклические триммер и тетрамер: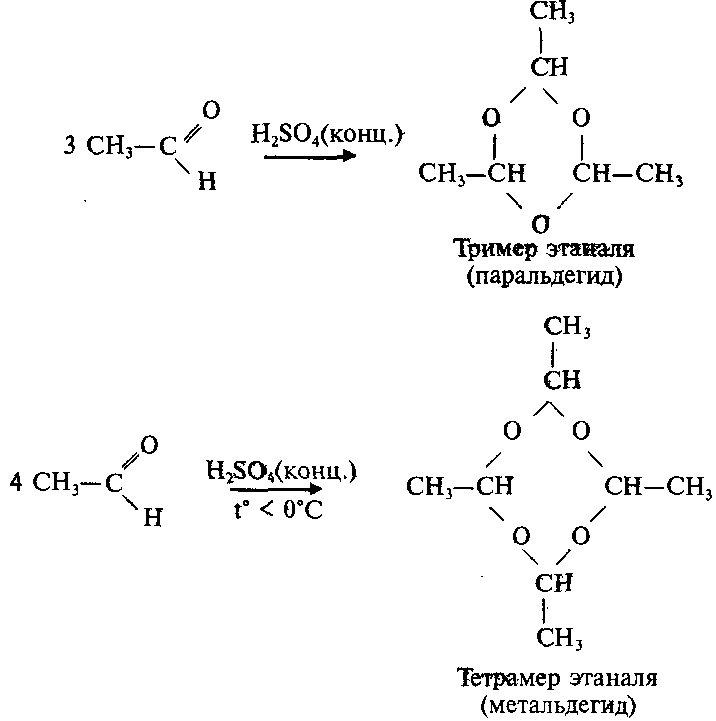
IV. Реакции поликонденсации
Реакции поликонденсации — это процессы образования высокомолекулярных веществ, в ходе которых соединение исходных мономерных молекул сопровождается выделением таких низкомолекулярных продуктов, как Н2О, НCl, NH3 и др.
В кислой или щелочной среде при нагревании формальдегид (образует с фенолом высокомолекулярные продукты — фенолформальдегидные смолы различного строения:
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолоспирта:
При нагревании фенолоспирты конденсируются с образованием фенолформальдегидных полимеров:
Фенолформальдегидные смолы используются для получения пластических масс (фенопластов).
Способы получения
I. Общие методы получения
1.Окисление первичных спиртов:

б) под действием окислителей (K2Cr2O7 или KMnO4 в кислой среде)
2.Каталитическое дегидрирование первичных спиртов:
3.Гидролиз дигалогеналканов, содержащих 2 атома галогена у первого атома углеродного атома:
II. Специфические способы получения
Формальдегид можно получить при каталитическом окислении метана:
Ацетальдегид получают реакцией Кучерова:
или при каталитическом окислении этилена:
Данный способ в последнее время широко используется для промышленного получения ацетальдегида. Однако аналогично могут быть получены и другие альдегиды при окислении гомологов этилена, например:

Скачать бесплатно реферат на тему: «Альдегиды» Альдегиды.docx (230 Загрузок)
Скачать бесплатно реферат на тему: «Альдегиды и кетоны» Альдегиды-и-кетоны.docx (218 Загрузок)
Скачать рефераты по другим темам можно здесь
Фенолы — номенклатура, получение, химические свойства

Фенолы — органические вещества,молекулы которых содержат радикал фенил,связанный с одной или несколькими гидроксогруппами. Так же как и спирты, фенолы классифицируют по атомности, т.е. по количеству гидроксильных групп.
Одноатомные фенолы содержат в молекуле одну гидроксильную группу:

Многоатомные фенолы содержат в молекулах более одной гидроксильной группы:

Существуют и многоатомные фенолы, содержащие три и более гидроксильных групп в бензольном кольце.
Познакомимся поподробнее со строением и свойствами простейшего представителя этого класса- фенолом С6Н5ОН . Название этого вещества и легло в основу в основу названия всего касса — фенолы.
Физические свойства фенола
Фенол-твердое, бесцветное кристаллическое вещества, t°плавления=43°С, t°кипения=181°С, с резким характерным запахом.Ядовит.Фенол при комнатной температуре незначительно растворяется в воде. Водный раствор фенола называют карболовой кислотой.При попадании на кожу он вызывает ожоги,поэтому с фенолом нужно обращаться очень осторожно!
Химические свойства фенола
 Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
Фенолы в большинстве реакций по связи О–Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие неподеленной электронной пары атома кислорода в системе p-сопряжения). Кислотность фенолов значительно выше, чем спиртов. Для фенолов реакции разрыва связи С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара-положениях (+М-эффект ОН-группы)
Кислотные свойства фенола
Атом водорода гидроксильной группы обладает кислотным характером. Т.к. кислотные свойства у фенола выражены сильнее, чем у воды и спиртов, то фенол реагирует не только с щелочными металлами, но и со щелочами с образованием фенолятов:

Кислотность фенолов зависит от природы заместителей (донор или акцептор электронной плотности), положения относительно ОН-группы и от количества заместителей. Наибольшее влияние на ОН-кислотность фенолов оказывают группы, расположенные в орто- и пара-положениях. Доноры увеличивают прочность связи О-Н (тем самым уменьшая подвижность водорода и кислотные свойства), акцепторы уменьшают прочность связи О-Н, при этом кислотность возрастает:

Однако кислотные свойства у фенола выражены слабее, чем у неорганический и карбоновых кислот. Так, например, кислотные свойства фенола примерно в 3000 раз меньше,чем у угольной кислоты. Поэтому, пропуская через водный раствор фенолята натрия углекислый газ, можно выделить свободный фенол.

Добавление к водному раствору фенолята натрия соляной или серной кислоты также приводит к образованию фенола:

Качественная реакция на фенол
Фенол реагирует с хлоридом железа (3) с образованием интенсивно окрашенного в фиолетовый цвет комплексного соединения.Эта реакция позволяет обнаруживать его даже в очень ограниченных количествах.Другие фенолы,содержащие одну или несколько гидроксильных групп в бензольном кольце, также дают яркое окрашивание сине-фиолетовых оттенков в реакции с хлоридом железа(3).
Реакции бензольного кольца фенола
Наличие гидроксильного заместителя значительно облегчает протекание реакций электрофильного замещения в бензольном кольце.
- Бромирование фенола. В отличие от бензола для бромирования фенола не требуется добавление катализатора (бромид железа(3)). Кроме того, взаимодействие с фенолом протекает селективно (избирательно): атомы брома направляются в орто- и пара-положения, замещая находящиеся там атомы водорода. Селективность замещения объясняется рассмотренными выше особенностями электронного строения молекулы фенола.
Так, при взаимодействии фенола с бромной водой образуется белый осадок 2,4,6-трибромфенола:

Эта реакция, так же как и реакция с хлоридом железа(3), служит для качественного обнаружения фенола.
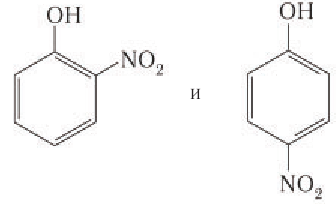
2. Нитрирование фенола также происходит легче, чем нитрирование бензола. Реакция с разбавленной азотной кислотой идет при комнатной температуре. В результате образуется смесь орто- и пароизомеров нитрофенола:

При использовании концентрированной азотной кислоты образуется 2,4,6, тринитритфенол-пикриновая кислота, взрывчатое вещество:

3. Гидрирование ароматического ядра фенола в присутствии катализатора проходит легко:

4. Поликонденсация фенола с альдегидами, в частности, с формальдегидом происходит с образованием продуктов реакции — фенолформальдегидных смол и твердых полимеров.
Взаимодействие фенола с формальдегидом можно описать схемой:

В молекуле димера сохраняются «подвижные» атомы водорода, а значит,возможно дальнейшее продолжение реакции при достаточном количестве реагентов:

Реакция поликонденсаци, т.е. реакция получения полимера, протекающая с выделением побочного низкомолекулярного продукта(воды), может продолжаться и далее (до полного израсходования одного из реагентов) с образованием огромных макромолекул. Процесс можно описать суммарным уравнением:

Образование линейных молекул происходит при обычной температуре. Проведение этой же реакции при нагревании приводит к тому, что образующийся продукт имеет разветвленное строение, он твердый и нерастворим в воде.В результате нагревания фенолформальдегидной смолы линейного строения с избытком альдегида получаются твердые пластические массы с уникальными свойствами. Полимера на основе фенолформальдегидных смол применяют для изготовления лаков и красок, пластмассовых изделий, устойчивых к нагреванию, охлаждению,действию воды, щелочей, кислот.Они обладают высокими диэлектрическими свойствами. Из полимеров на основе фенолформальдегидных смол изготавливают наиболее ответственные и важные детали электроприборов, корпуса силовых агрегатов и детали машин,полимерную основу печатных плат для радиоприборов. Клеи на основе фенолформальдегидных смол способны надежно соединять детали самой различной природы,сохраняя высочайшую прочность соединения в очень широком диапазоне температур. Такой клей применяется для крепления металлического цоколя ламп освещения к стеклянной колбе.Таким образом, фенол и продукты на его основе находят широкое применение.


Получение фенола

Применение фенолов
Фенол — твердое вещество, с характерным запахом, вызывает ожоги при попадании на кожу. Ядовит. Растворяется в воде, его раствор называют карболовой кислотой (антисептик). Она была первым антисептиком введенным в хирургию. Широко используется для производства пластмасс, лекарственных средств (салициловая кислота и ее производные), красителей, взрывчатых веществ.
Фенолы
Гидроксисоединения – это органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Гидроксисоединения делят на спирты и фенолы.

Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.
Классификация фенолов
По числу гидроксильных групп:
- фенолы с одной группой ОН — содержат одну группу -ОН. Общая формула CnH2n-7OH или CnH2n-6O.
- фенолы с двумя группами ОН — содержат две группы ОН. Общая формула CnH2n-8(OH)2 или CnH2n-6O2.

| Соединения, в которых группа ОН отделена от бензольного кольца углеродными атомами – это не фенолы, а ароматические спирты: |

Строение фенолов
В фенолах одна из неподеленных электронных пар кислорода участвует в сопряжении с π–системой бензольного кольца, это является главной причиной отличия свойств фенола от спиртов.

Химические свойства фенолов
Сходство: как фенол, так и спирты реагируют с щелочными металлами с выделением водорода.
Отличия:
1. Кислотные свойства фенолов
| Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. |
Раствор фенола в воде называют «карболовой кислотой», он является слабым электролитом.
1.1. Взаимодействие с раствором щелочей
В отличие от спиртов, фенолы реагируют с гидроксидами щелочных и щелочноземельных металлов, образуя соли – феноляты.
| Например, фенол реагирует с гидроксидом натрия с образованием фенолята натрия |

Так как фенол – более слабая кислота, чем соляная и даже угольная, его можно получить из фенолята, вытесняя соляной или угольной кислотой:

1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Фенолы взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются феноляты. При взаимодействии с металлами фенолы ведут себя, как кислоты.
| Например, фенол взаимодействует с натрием с образованием фенолята натрия и водорода . |

2. Реакции фенола по бензольному кольцу
| Наличие ОН-группы в бензольном кольце (ориентант первого рода) приводит к тому, что фенол гораздо легче бензола вступает в реакции замещения в ароматическом кольце. |
2.1. Галогенирование
| Фенол легко при комнатной температуре (без всякого катализатора) взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола (качественная реакция на фенол). |

2.2. Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара-нитрофенолов.
| Например, при нитровании фенола избытком концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): |

3. Поликонденсация фенола с формальдегидом
С формальдегидом фенол образует фенолоформальдегидные смолы.

4. Взаимодействие с хлоридом железа (III)
При взаимодействии фенола с хлоридом железа (III) образуются комплексные соединения железа, которые окрашивают раствор в сине-фиолетовый цвет. Это качественная реакция на фенол.
5. Гидрирование (восстановление) фенола
Присоединение водорода к ароматическому кольцу.
Продукт реакции – циклогексанол, вторичный циклический спирт.

Получение фенолов
1. Взаимодействие хлорбензола с щелочами
При взаимодействии обработке хлорбензола избытком щелочи при высокой температуре и давлении образуется водный раствор фенолята натрия.

При пропускании углекислого газа (или другой более сильной кислоты) через раствор фенолята образуется фенол.

2. Кумольный способ
Фенол в промышленности получают из каталитическим окислением кумола.
Первый этап процесса – получение кумола алкилированием бензола пропеном в присутствии фосфорной кислоты:

Второй этап – окисление кумола кислородом. Процесс протекает через образование гидропероксида изопропилбензола:

Суммарное уравнение реакции:

3. Замещение сульфогруппы в бензол-сульфокислоте
Бензол-сульфокислота реагирует с гидроксидом натрия с образованием фенолята натрия:

Получается фенолят натрия, из которого затем выделяют фенол:
Фенолы в химии – свойства, формула, получение, номенклатура и определение с примерами
Содержание:
- Строение фенола
- Физические свойства фенола
- Химические свойства фенола
- Получение и применение фенола
Фенолы:
К гидроксилпроизводным органическим соединениям, кроме спиртов, относятся фенолы.
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Число гидроксильных групп в молекуле определяет атомность фенолов. Они могут содержать до шести гидроксильных групп в молекуле. По числу гидроксильных групп фенолы, как и спирты, классифицируют как одно- и многоатомные фенолы.
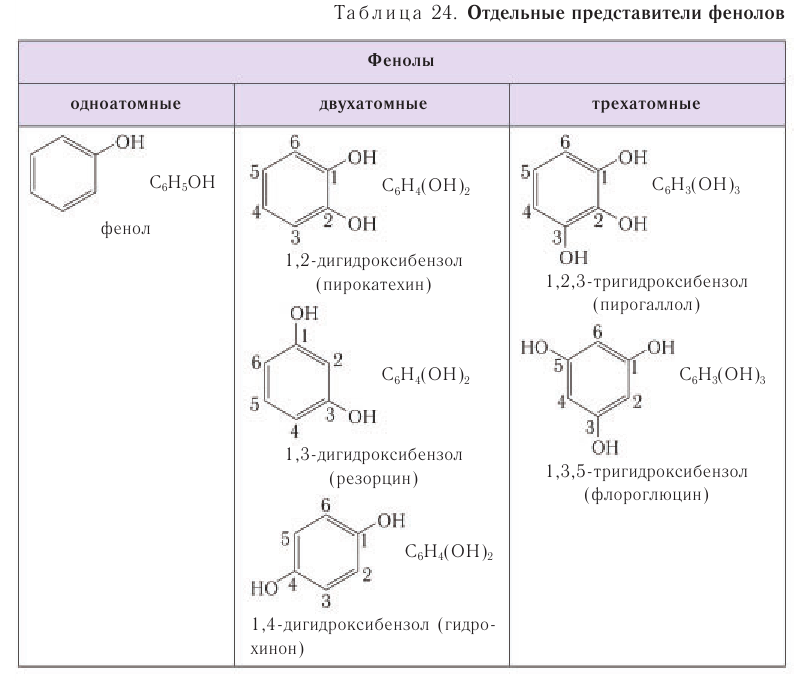
В таблице 24 для ознакомления приведены формулы и названия некоторых фенолов различной атомности.
В данном курсе органической химии вы познакомитесь со строением и свойствами одного представителя класса — фенолом 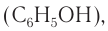
Строение фенола
Фенол 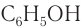 — простейший представитель класса. Группу атомов
— простейший представитель класса. Группу атомов 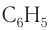 — называют фенильной группой. Структурная формула фенола в основном записывается без указания символов углерода и водорода в бензольном кольце.
— называют фенильной группой. Структурная формула фенола в основном записывается без указания символов углерода и водорода в бензольном кольце.
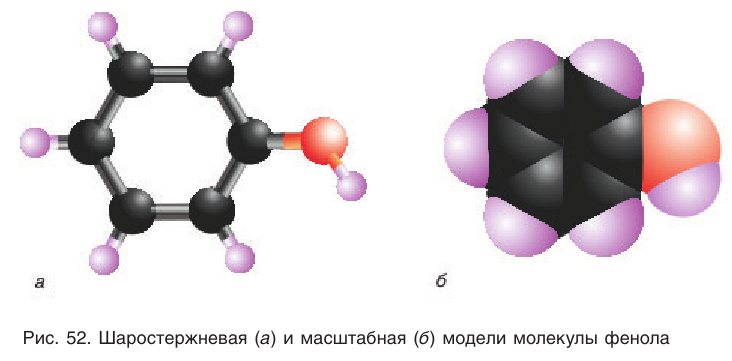
Шаростержневая и масштабная модели молекулы фенола приведены на рисунке 52.
Рассмотрим электронное строение молекулы фенола. Одна из неподеленных электронных пар атома кислорода вступает в сопряжение с  -электронной системой бензольного кольца. При этом происходит смещение электронной плотности в сторону бензольного кольца, что приводит к усилению связи С—О и к ослаблению связи О—Н.
-электронной системой бензольного кольца. При этом происходит смещение электронной плотности в сторону бензольного кольца, что приводит к усилению связи С—О и к ослаблению связи О—Н.
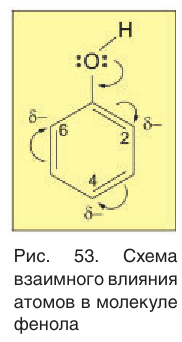
Сопряжение неподеленной электронной пары атома кислорода с  -электронной системой бензольного кольца приводит также к перераспределению в нем электронной плотности. Она понижается на атоме углерода, связанном с гидроксильной группой, и повышается у атомов углерода в положениях 2, 4, 6. Эти процессы можно выразить схемой, показанной на рисунке 53. Таким образом, гидроксильная группа и бензольное кольцо в молекуле фенола взаимно влияют друг на друга.
-электронной системой бензольного кольца приводит также к перераспределению в нем электронной плотности. Она понижается на атоме углерода, связанном с гидроксильной группой, и повышается у атомов углерода в положениях 2, 4, 6. Эти процессы можно выразить схемой, показанной на рисунке 53. Таким образом, гидроксильная группа и бензольное кольцо в молекуле фенола взаимно влияют друг на друга.
Физические свойства фенола
Фенол — бесцветное кристаллическое вещество с резким характерным запахом. Кристаллическое состояние фенола обусловлено наличием прочных водородных связей между его молекулами. При обычной температуре фенол незначительно растворяется в воде, но хорошо раетворяетея в горячей воде. Фенол очень ядовит, при попадании на кожу вызывает cильнейшие ожоги, поэтому работать е ним в школьном химичееком кабинете запрещено.
Химические свойства фенола
Химические свойства фенола обусловлены наличием в молекуле функциональной группы —ОН и бензольного кольца, которые взаимно влияют друг на друга. В молекуле фенола бензольное кольцо влияет на гидроксильную группу, что проявляется в повышенной кислотности фенола по сравнению с насыщенными одноатомными спиртами. Влияние гидроксильной группы на бензольное кольцо обусловливает более легкое замещение в нем атомов водорода на какой-либо заместитель у атомов углерода в положениях 2, 4, 6.
Рассмотрим последовательно химические реакции, протекающие с участием гидроксильной группы и бензольного кольца.
1) Диссоциация в водных растворах. Молекулы фенола диссоциируют в водных растворах по кислотному типу:
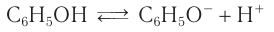
Фенол является слабой кислотой (иногда его называют карболовой кислотой), что отличает его от спиртов, которые практически не диссоциируют в водных растворах.
2) Взаимодействие со щелочными металлами. Наличие в молекуле фенола гидроксильной группы, непосредственно связанной с бензольным кольцом, обусловливает определенное сходство по химическим свойствам с одноатомными спиртами. Если в расплавленный фенол поместить кусочек металлического натрия, то происходит реакция замещения атома водорода в гидроксильной группе. При этом образуется соединение, которое по номенклатуре ИЮПАК называют феноксид. Используется и другое название — фенолят, допускаемое номенклатурой ИЮПАК. В реакции со щелочными металлами фенол проявляет кислотные свойства:
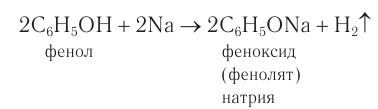
3) Взаимодействие со щелочами. Кислотные свойства у фенола, как вам известно, выражены сильнее, чем у одноатомных насыщенных спиртов. Поэтому, в отличие от них, фенол реагирует не только со щелочными металлами, но и с водными растворами щелочей с образованием феноксидов (фенолятов):
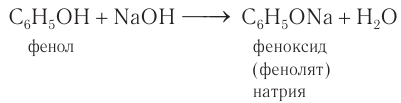
Кислотные свойства у фенола выражены слабее, чем у неорганических кислот, даже таких слабых, как угольная. Поэтому добавление к водному раствору фенолята натрия соли угольной кислоты (кислотные свойства фенола примерно в три тысячи раз слабее, чем угольной кислоты) приводит к образованию фенола. Образуется фенол и при добавлении к водному раствору фенолята сильных минеральных кислот:
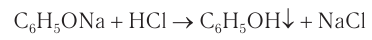
4) Галогенирование. Реакции галогенирования, в частности бромирования, протекают с замещением атомов водорода в бензольном кольце. В отличие от бензола для бромирования фенола не требуется катализатор, так как влияние гидроксильной группы значительно облегчает протекание реакций замещения в бензольном кольце. При действии на фенол раствора брома в воде образуется белый осадок 2,4,6-трибромфенола (рис 54).
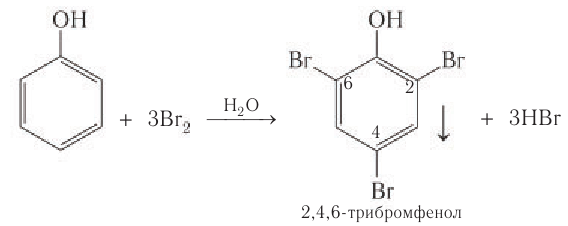
Эта реакция часто используется для качественного обнаружения фенола.
Фенол дает характерное фиолетовое окрашивание с водным раствором хлорида железа(III) вследствие образования комплексной соли железа. Эту реакцию также используют для обнаружения фенола и относят к цветной качественной реакции.
5) Нитрование. Фенол так же, как и бензол, взаимодействует е азотной кислотой, но нитрование фенола протекает легче, чем нитрование бензола. Реакция фенола с разбавленной азотной кислотой идет при комнатной температуре, и в результате образуется смесь изомеров нитрофенола:
2, 4, 5 – Тринитрофенол (пикриновую кислоту) 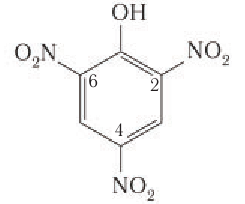
получают из фенола под действием сначала концентрированных серной, а затем азотной кислот. Наличие в молекуле пикриновой кислоты трех заместителей — 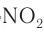 усиливает ее кислотные свойства. Она является сильной кислотой. Пикриновая кислота — взрывоопасное вещество, ее соли применяются в качестве взрывчатых веществ.
усиливает ее кислотные свойства. Она является сильной кислотой. Пикриновая кислота — взрывоопасное вещество, ее соли применяются в качестве взрывчатых веществ.
Фенолами называют производные ароматических углеводородов, в молекулах которых один или несколько атомов водорода, непосредственно связанных с бензольным кольцом, замещены на гидроксильные группы.
Фенол 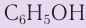 — простейший одноатомный фенол, химические свойства которого определяются наличием в молекуле как гидроксильной группы, так и бензольного кольца, которые оказывают друг на друга взаимное влияние, что обусловливает высокую активность фенола в реакциях замещения в бензольном кольце и большую кислотность по сравнению со спиртами.
— простейший одноатомный фенол, химические свойства которого определяются наличием в молекуле как гидроксильной группы, так и бензольного кольца, которые оказывают друг на друга взаимное влияние, что обусловливает высокую активность фенола в реакциях замещения в бензольном кольце и большую кислотность по сравнению со спиртами.
Для фенола характерны реакции гидроксильной группы (со щелочными металлами, щелочами) и бензольного кольца (галогенирование, нитрование).
Получение и применение фенола
Получение: Одним из основных промышленных методов получения фенола является кумольный метод. Он был разработан в 40-е гг. XX в. в Советском Союзе Р. Ю. Удрисом, Б. Д. Кружаловым, П. С. Сергеевым, М. С. Немцовым и до наших дней не утратил своей эффективности. Для получения фенола используются экономически выгодные исходные вещества — бензол и пропей.
Упрощенно синтез фенола можно представить так. Сначала в реакции бензола с пропеном синтезируют изопропилбензол (кумол):
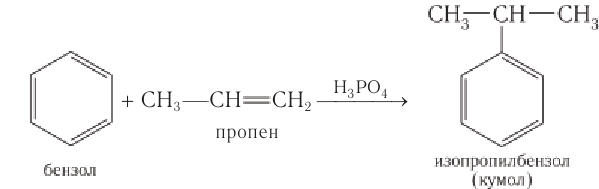
Затем кумол окисляют, продукт окисления кумола разлагают разбавленной серной кислотой и получают при этом фенол и ацетон  важнейшие в производственном отношении продукты:
важнейшие в производственном отношении продукты: 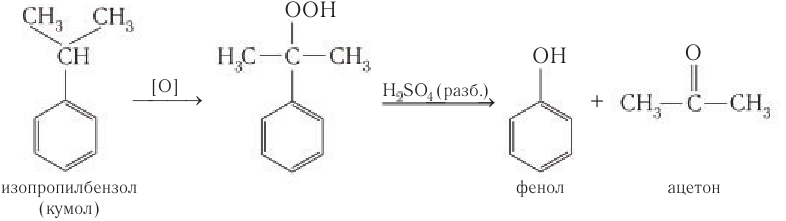
Схема получения из кумола фенола приведена для ознакомления и не требует запоминания.
Ранее фенол выделяли только из каменноугольной смолы, образующейся как побочный продукт коксохимического производства. Каменноугольную смолу обрабатывали щелочами, а, как вам известно, водные растворы щелочей взаимодействуют с фенолом с образованием фенолятов. Затем феноляты обрабатывали минеральными кислотами и получали фенол. Схематически процесс экстрагирования фенола из каменноугольной смолы можно представить так:
каменноугольная смола 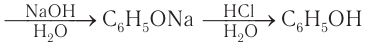
Фенол можно получить, используя в качестве исходного вещества бензол. При хлорировании бензола сначала получают хлорбензол, затем хлорбензол под действием водного раствора гидроксида натрия дает фенолят натрия, который в реакции с минеральными кислотами превращается в фенол:
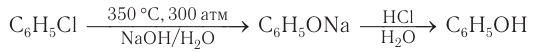
Этот способ получения фенола в настоящее время практически не используется как технически устаревший и экономически нецелесообразный. Однако знакомство с ним представляет интерес как пример генетической связи между углеводородами, галогенпроизводными и гидроксилпроизводными (фенолами).
Применение: Фенол и продукты, получаемые на его основе, находят широкое применение (рис. 55). Практически половина производимого фенола расходуется на синтез фенолформальдегидных смол. Полимеры на основе этих смол применяются для изготовления лаков и красок, пластмассовых изделий, устойчивых к действию кислот и щелочей, нагреванию. Из пластмасс на основе фенолформальдегидных смол изготовляют важные детали электро- и радиоприборов, аппаратуры, используемой для работы при высокой температуре и в агрессивных средах. Клеи, полученные на основе фенолформальдегидных смол, надежно соединяют детали, изготовленные из самых различных веществ, сохраняя высокую прочность соединения.
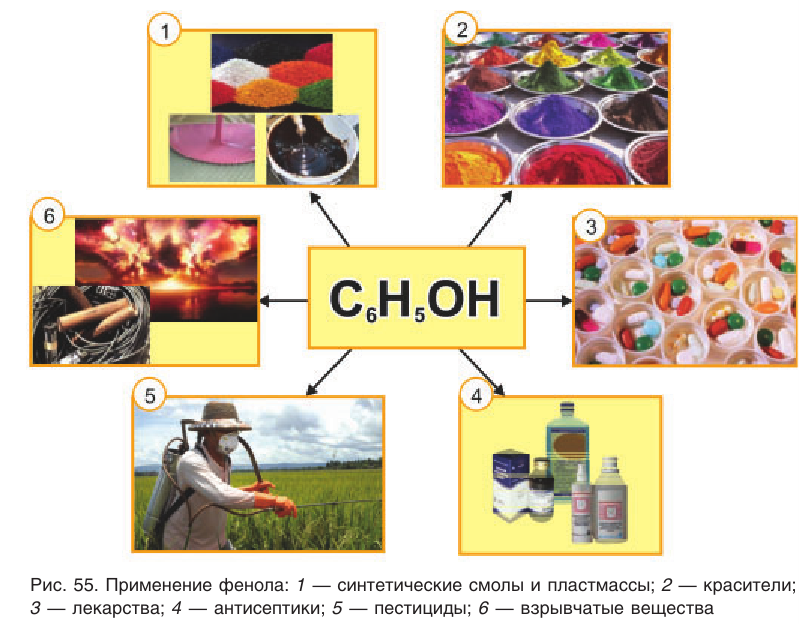
Фенол служит исходным веществом для получения многих лекарственных препаратов, например аспирина, красителей, пестицидов, антисептиков. Он используется в генной инженерии и молекулярной биологии в качестве средства для очистки и выделения молекул ДНК.
Тринитрофенол (пикриновая кислота) находит применение в производстве взрывчатых веществ.
Гидрохинон применяется в фотографии в качестве проявителя, так как он очень легко окисляется.
Пирокатехин используется для получения адреналина — гормона, вырабатываемого надпочечниками.
Резорцин применяется наружно как антисептик при кожных заболеваниях в виде водных и спиртовых растворов; в производстве красителей, стабилизаторов и пластификаторов полимеров.
Фенол и его производные — ядовитые вещества, очень опасные для человека, животных и растительных организмов. Вдыхание паров фенола может привести к ожогам дыхательных путей и последующему отеку легких. При попадании фенола на кожу образуются химические ожоги. Фенол не теряет летучих свойств даже в составе пластмасс, вот поэтому во многих странах мира запрещено производство предметов быта и детских игрушек с использованием фенопластов, представляющих опасность для здоровья людей.
В составе отходов производства могут содержаться чрезвычайно ядовитые вещества, например диоксин:
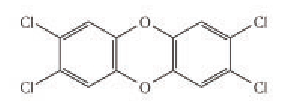
Чтобы предотвратить их попадание в окружающую среду, применяются различные физические и химические методы очистки.
Фенол в основном получают в процессе органического синтеза кумольным методом.
Фенол и его производные применяются в качестве исходных веществ для производства синтетических смол и пластмасс, синтеза красителей, лекарств и многих других ценных продуктов.
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Фенолы – структурная формула, свойства, способы получения и применения
Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп (- ОН), непосредственно соединенных с бензольным кольцом.
Фенолы – это гидроксильные производные бензола.
Общая формула Ar-ОН, где Ar – арил.
Простейшим и наиболее известным представителем этого класса соединений является фенол.
Молекулярная формула фенола С6Н5ОН.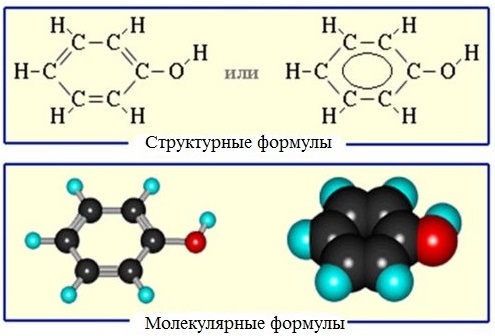
Радикал фенола С6Н5 называется фенил.
Классификация фенолов
В зависимости от числа ОН-групп в молекуле различают одно- , двух- , трехатомные фенолы.
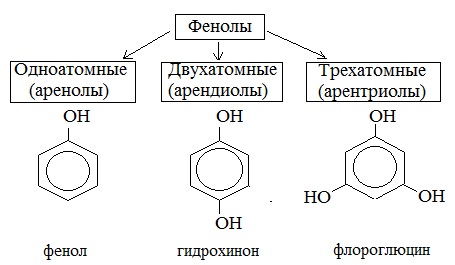
Существуют фенолы и большей атомности.
В соответствии с количеством конденсированных ароматических циклов в молекуле различают сами фенолы (одно ароматическое ядро – производные бензола), нафтолы (2 конденсированных ядра – производные нафталина), антранолы (3 конденсированных ядра – производные антрацена) и фенантролы.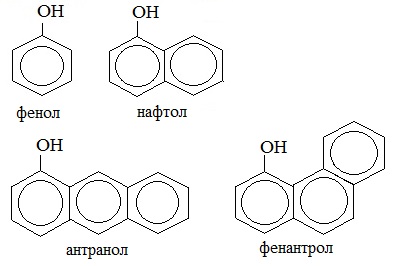
Номенклатура фенолов
Для фенолов широко используют тривиальные названия, сложившиеся исторически: фенол, гидрохинон, резорцин и др. В названиях замещенных моноядерных фенолов используются также приставки орто- , мета- и пара- , употребляемые в номенклатуре ароматических соединений.
Простейшие одноатомные фенолы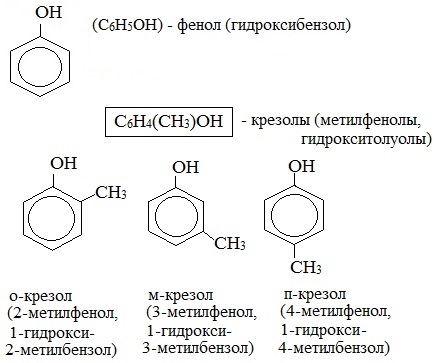
Простейшие двухатомные фенолы
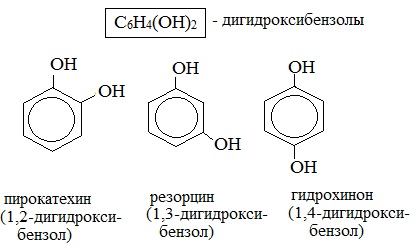
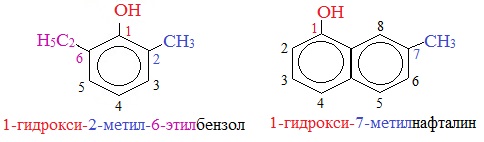
Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов указывают положение заместителей.
При построении номенклатуры фенолов атомы углерода в бензольном кольце обозначают цифрами от 1 до 6, начиная с атома углерода, связанного с гидроксильной группой.
Изомерия фенолов
Для фенолов характерно несколько видов изомерии.
1. Изомерия положения заместителей в бензольном кольце
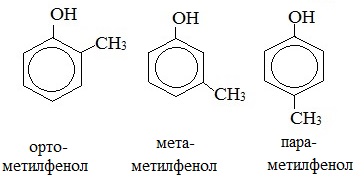
2. Изомерия положения групп –ОН в многоатомных спиртах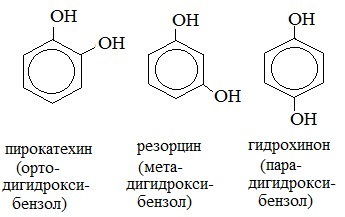
3. Межклассовая изомерия с ароматическими спиртами, простыми эфирами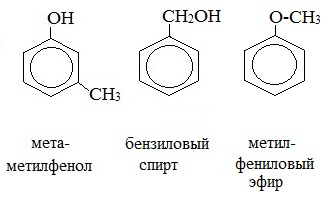
Фенолы. Свойства фенолов.
Фенолы – производные ароматических углеводородов, в состав которых могут входить одна или несколько гидроксильных групп, соединенных с бензольным кольцом.
Как называть фенолы?
По правилам ИЮПАК сохраняется название «фенол». Нумерация атомов идет от атома, который непосредственно связан с гидрокси-группой (если она – старшая) и нумеруют так, чтобы заместители получили наименьший номер.

Строение фенола.
У атома кислорода на внешнем уровне находится неподеленная электронная пара, которая «втягивается» в систему кольца (+М-эффект ОН-группы). В результате могут возникнуть 2 эффекта:
1) повышение электронной плотности бензольного кольца в положения орто- и пара-. В основном, такой эффект проявляется в реакциях электрофильного замещения.
2) уменьшается плотность на атоме кислорода, вследствие чего связь О-Н ослабляется и может рваться. Эффект связан с повышенной кислотности фенола по сравнению с предельными спиртами.
Монозамещенные производные фенола (крезол) могут быть в 3х структурных изомерах:

Физические свойства фенолов.
Фенолы – кристаллические вещества при комнатой температуре. Плохо растворимы в холодной воде, но хорошо – в горячей и в водных растворах щелочей. Обладают характерным запахом. Вследствие образования водородных связей, обладают высокой температурой кипения и плавления.
Получение фенолов.
1. Из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, который после взаимодействия с кислотой, превращается в фенол:

2. Промышленный способ: при каталитическом окислении кумола на воздухе получается фенол и ацетон:

3. Из ароматических сульфокислот с помощью сплавления с щелочами. Чаще проводят реакцию для получения многоатомных фенолов:

Химические свойства фенолов.
р-орбиталь атома кислорода образует с ароматическим кольцом единую систему. Поэтому электронная плотность на атоме кислороде уменьшается, в бензольном кольце – увеличивается. Полярность связи О-Н повышается, и водород гидроксильной группы становится более реакционоспособным и легко может быть замещен атомом металла даже при действии щелочей.
Кислотность фенолов выше, чем у спиртов, поэтому можно проводить реакции:


Но фенол – слабая кислота. Если через его соли пропускать углекислый или сернистый газ, то выделяется фенол, что доказывает, что угольная и сернистая кислота являются более сильными кислотами:

Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются – при введении II.
2) Образование сложных эфиров. Процесс протекает при воздействие хлорангидридов:

3) Реакция электрофильного замещения. Т.к. ОН-группа является заместителем первого рода, то реакционная способность бензольного кольца в орто- и пара- положениях повышается. При действии на фенол бромной воды наблюдается выделение осадка – это качественная реакция на фенол:

4) Нитрование фенолов. Реакцию проводят нитрирующей смесью, в результате чего образуется пикриновая кислота:

5) Поликонденсация фенолов. Реакция протекает под воздействии катализаторов:

6) Окисление фенолов. Фенолы легко окисляются кислородом воздуха:

7) Качественной реакцией на фенол является воздействие раствора хлорида железа и образование комплекса фиолетового цвета.
Применение фенолов.
Фенолы используют при получении фенолформальдегидных смол, синтетических волокон, красителей и лекарственных средств, дезинфицирующих веществ. Пикриновая кислота используется в качестве взрывчатых веществ.






