Классификация катализаторов
Существующее в настоящее время огромное количество катализаторов можно классифицировать по разным критериям: структура, состав, катализируемые процессы, агрегатное состояние и др.
По агрегатному состоянию все катализаторы можно разделить на две большие группы – гомогенные и гетерогенные (Рис. 1.9).
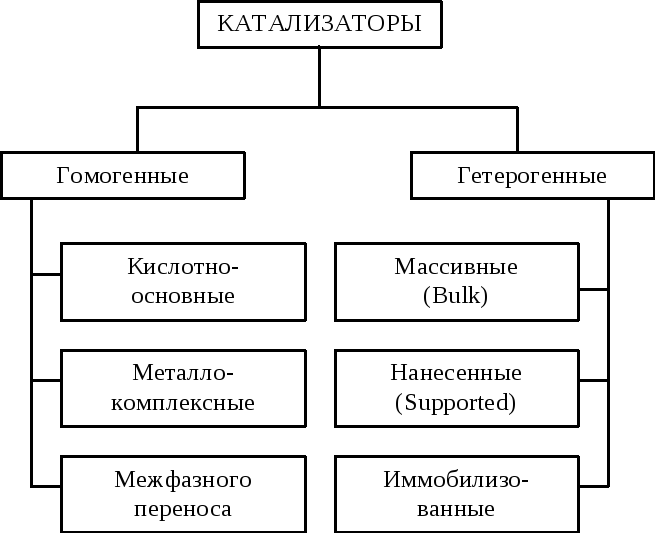
Рис. 1.9. Классификация катализаторов
Гомогенными называются катализаторы, находящиеся в одной фазе с реагентами.
Гетерогенными называются катализаторы, образующие отдельную фазу, не смешивающуюся с реагентами и продуктами. Как правило, это твердые катализаторы.
Каждую из подгрупп катализаторов, представленных на рисунке (1.9) можно, в свою очередь, квалифицировать по различным признакам. Особенно это касается гетерогенных катализаторов, среди которых можно выделить оксидные, кислотные, основные, однокомпонентные, многокомпонентные, металлические и т.д.
Массивный катализатор
(Fe при синтезе NH3
Нанесенный катализатор
(Pt на силикагеле.
Иммобилизованный катализатор
(Активный компонент химически связан с носителем.
Катиониты и аниониты)



Рис. 1.10. Классификация гетерогенных катализаторов по типу активных центров. АК – активный компонент; АЦ – активный центр.
Чаще всего гетерогенные катализаторы классифицируют по типу активных центров (рис. 1.9.) на массивные, нанесенные и иммобилизованные. На рисунке (1.10) схематично изображено строение каждой из этих групп катализаторов.
Массивный катализатор целиком состоит из активного компонента, а активные центры представляют собой доступные для реагентов атомы или группы атомов на поверхности катализатора. Примером служат гранулированный железный катализатор синтеза аммиака, и сетка из сплава платины и родия, являющаяся катализатором окисления аммиака в производстве азотной кислоты.
Нанесенные катализаторы состоят из носителя и нанесенного на его поверхность тем или иным физическим методом активного компонента. При этом носитель может быть как инертным в данном процессе, так и оказывать определенное каталитическое либо промотирующее действие. Примером служит катализатор реформинга, представляющий собой гранулы оксида алюминия с нанесенной на их поверхность металлической платиной.
Иммобилизованные катализаторы это катализаторы, в которых активный компонент химически закреплен на поверхности твердого материала (носителя). Например сульфокатиониты, представляющие собой сульфированный сополимер стирола с дивинилбензолом. Сульфокатиониты содержат -SO3H группы в ароматических фрагментах полимера (носителя) и служат кислотными катализаторами, например, в синтезе метилтретбутилового эфира.
Сравнение гомогенного и гетерогенного катализа
Гомогенные катализаторы отличаются значительно большей степенью дисперсности. Каждая молекула гомогенного катализатора является каталитическим центром, в то время как в гетерогенном катализаторе активны только доступные для реагентов центры на поверхности. Следовательно, гомогенный катализатор обладает гораздо большей активностью на единицу массы катализатора. Это позволяет использовать его в гораздо меньших концентрациях, чем гетерогенный.
Гомогенно-каталитические реакции протекают чаще всего под кинетическим контролем, так как скорость диффузии реагентов к каталитическому центру значительно выше скорости собственно химической реакции.
Так как гомогенные катализаторы – это легко идентифицируемые химические соединения, то механизмы гомогенно-каталитических реакций изучены, как правило, хорошо. Для гетерогенных же каталитических процессов представление о механизме реакций часто достаточно туманны и противоречивы.
Основным недостатком гомогенного катализа является сложность отделения катализатора от продуктов реакции и его рециркуляция. Наоборот, для гетерогенного катализа сепарация (выделение) либо не требуется вообще (в случае стационарного слоя катализатора), либо осуществляется такими простыми способами как фильтрация или центрифугирование. Для выделения гомогенных катализаторов требуются значительно более сложные (энергоемкие) процессы, такие как экстракция, ректификация или ионный обмен. Кратко сравнение достоинств и недостатков гомогенных и гетерогенных катализаторов приведено в таблице 1.1.
Идеальным выглядело бы создание катализаторов, обладающих положительными свойствами как гомогенных (высокая удельная активность и селективность), так и гетерогенных (простота сепарации) катализаторов.
В настоящее время очевидно стремление перехода от гомогенно- к гетерогенно-каталитическим процессам. В современной химической промышленности доля гомогенно-каталитических процессов составляет 10-15%.
За свою историю промышленный катализ прошел огромную эволюцию благодаря развитию инструментальных методов исследования катализаторов и механизмов каталитических реакций. Целью этих исследований является создание общей теории катализа – теории, которая бы позволяла предсказывать и создавать катализаторы для всех типов катализа – гомогенного, гетерогенного и ферментативного. Однако до сих пор этого сделать не удалось.
Сравнение гомогенных и гетерогенных катализаторов.
Предмет каталитической химии
Явление катализа широко распространено в природе: почти все процессы, происходящие в живых организмах, являются каталитическими. Наверное, нет ни одного человека, который не слышал бы слова «катализ» или «катализаторы».
Сейчас, если спросить любого человека на улице: «Что такое катализатор?», вам ответят: «Это то, что используют в автомобилях для нейтрализации (очистки) выхлопных газов».
А современную промышленность нельзя представить себе без использования катализаторов. Только в химической промышленности каталитические процессы обеспечивают более 80% продукции и около 20% ВВП развитых стран. Не менее 90-95% промышленных реакций – это каталитические процессы в химических и нефтехимических производствах,
Каталитические процессы применяются не только в химических и нефтехимических производствах, но и в пищевой, фармацевтической, металлургической, строительной и многих других отраслях промышленности. А что касается биотехнологии, которая в настоящее время бурно развивается, – там все процессы каталитические.
Где используются катализаторы?
Катализаторы незаменимы в следующих областях:
- производство топлива для транспорта (во всем мире работают 440 нефтеперерабатывающих заводов);
- крупнотоннажной и тонкой химической технологии во всех отраслях химической индустрии; только крупнотоннажной химической продукции в мире производится почти на 700 млрд. долл. США (рис. 1);
- предотвращение загрязнения среды через создание малоотходных технологий;
- снижение уровня загрязнения сточных вод, промышленных выбросов и выхлопных газов транспорта.

Рис. 1.1. Производство крупнотоннажной химической продукции в 2005 г.
Следует также отметить, что ежегодно на заводах всего мира производится примерно 200 тыс. тонн катализаторов общей стоимостью около
15 млрд. долл. США. Это гигантский рынок.
Предметом каталитической химии являются явления катализа методы подбора катализаторов, их синтеза и применения в различных областях науки, технологии и техники.
Катализ – явление, которое в настоящее время достаточно хорошо осмыслено на концептуальном уровне.
Каталитическая химия – раздел химии, изучающий явление катализа, методы подбора катализаторов, их синтеза и применения в различных областях науки, технологии и техники.
Катализаторы и реагенты могут быть как неорганическими, так и органическими, поэтому каталитическая химия – междисциплинарная область (рис. 1.2). Она использует представления неорганической, органической, физической химии.
Для подбора эффективных катализаторов учѐные и инженеры пользуются также методами электрохимии, квантовой химии, химии металлоорганических соединений. Для исследования катализаторов применяются разнообразные физические методы и приборы. Поэтому можно с полным правом утверждать, что каталитическая химия находится «на стыке наук», т.е. это интенсивно развивающаяся область химии.

Рис. 1.2. Междисциплинарные связи каталитической химии
Часто говорят об органическом катализе. Что подразумевают под этим термином? Органический катализ является той областью катализа, когда либо реагент, либо катализатор являются органическими соединениями.
Какие же задачи стоят перед каталитической химией?
- теоретические (попытки создания теории предвидения каталитического действия и теории приготовления катализаторов, углубление знаний о механизмах катализа),
- практические (подбор и совершенствование катализаторов промышленных реакций).
Открытие явления катализа
Ещѐ в XV в. алхимики обнаружили, что в присутствии серной кислоты, которая при этом не расходуется, этиловый спирт превращается в диэтиловый эфир (в гомогенной системе):
Тем не менее, первые научные сведения о катализе относятся к началу XIX в. В 1806 г. французские учѐные Н. Клеман и Ш. Дезорм открыли реакцию окисления сернистого ангидрида до серного под действием диоксида азота, который в процессе не расходовался:
Это открытие было использовано для промышленного способа получения серной кислоты (так называемый камерный способ).
В 1811 г. петербуржский академик К.С. Кирхгоф открыл, что разбавленные кислоты способны вызывать превращение крахмала в сахар (глюкозу). И в этом случае кислота не расходовалась. В 1814 г. им же было установлено, что эту реакцию также может катализировать фермент диастаза из ячменного солода. Так было положено начало применению биологических катализаторов – ферментов.
Французский химик Л. Тенар в 1813 г. установил, что аммиак при нагревании разлагается на азот и водород под влиянием некоторых металлов (железо, медь, серебро, платина):
В 1818 г. он же показал, что большое число твѐрдых тел оказывает ускоряющее действие на разложение растворов перекиси водорода, а английский химик Г. Дэви открыл способность паров спирта и эфира окисляться кислородом на поверхности платины. В 1822 г. немецкий химик И. Дѐберейнер установил, что водород и кислород соединяются на платине при обычной температуре. За этим последовало открытие и других фактов сильного положительного воздействия веществ на скорость химических реакций.
Все это привело к выделению особой группы явлений, названных немецким химиком Э. Митчерлихом контактными (1833 г.). Термин катализ (от греч. καταλύειν — разрушение) для таких явлений был введѐн только в 1835 г. великим шведским химиком Й. Берцелиусом, который систематизировал и обобщил все известные к тому времени сведения об ускорении химических реакций под действием катализаторов. В.Ф. Оствальд (1909 г.) показал, что катализатор ускоряет только термодинамически разрешенные процессы. За нахождение связи катализа с термодинамикой ему была присуждена Нобелевская премия.
Развитие понимания явления катализа отставало от его практического применения (рис. 1.3).

Рис. 1.3. К истории гетерогенного катализа
Лишь в начале XX в. стали появляться работы, посвященные попыткам объяснения явления катализа. Так, П. Сабатье (1912 г.) предложил теорию промежуточных соединений и показал, что в присутствии катализаторов реакция идет по иному маршруту, чем в отсутствие катализатора. В 1912 г. он получил Нобелевскую премию за метод гидрогенизации органических соединений в присутствии мелкодисперсных металлов, который резко стимулировал развитие органической химии.
В 1910-1920 гг. практическое применение катализа было развито в работах В.Н. Ипатьева, который ввел в практику катализ при высоком давлении. В 1913 г. впервые был получен в промышленном масштабе аммиак каталитическим синтезом из азота и водорода. Автором каталитического синтеза аммиака является немецкий ученый Ф. Габер. За разработку научных основ процесса синтеза аммиака и за промышленное оформление его Ф. Габеру и К. Бошу в 1918 г. была присуждена Нобелевская премия.
Исследования механизма каталитических реакций стали возможны после работ И. Ленгмюра и С.Н. Хиншельвуда, посвященных изучению процессов адсорбции и созданию кинетической теории. Развитие теоретических представлений (например, теория переходного состояния) и приход в эту область спектральных методов (ИК спектроскопия) открыли новые возможности в установлении связи между каталитическими свойствами и составом и структурой материала. Современное состояние науки о поверхности позволяет выявить структуру адсорбционных центров и их реакционную способность. Разработанная в конце ХХ в. туннельная микроскопия позволяет изучать структуру поверхности и адсорбционных слоев на атомном уровне; некоторые современные методы позволяют изучать катализаторы в процессе их работы (in situ). Развитие получили и численные методы.
Кремний. Химия кремния и его соединений

Кремний
Положение в периодической системе химических элементов
Кремний расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение кремния
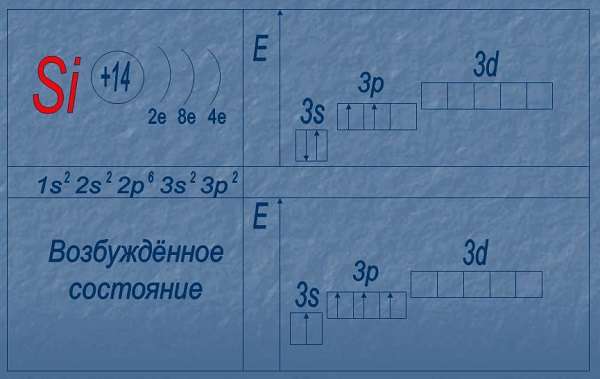
Электронная конфигурация кремния в основном состоянии :
+14Si 1s 2 2s 2 2p 6 3s 2 3p 2 
Электронная конфигурация кремния в возбужденном состоянии :
+14Si * 1s 2 2s 2 2p 6 3s 1 3p 3 
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Физические свойства, способы получения и нахождение в природе кремния
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см 3 . Полупроводник.
Качественные реакции
Качественная реакция на силикат-ионы SiO3 2- — взаимодействие солей-силикатов с сильными кислотами . Кремниевая кислота – слабая. Она легко выделяется из растворов солей кремниевой кислоты при действии на них более сильными кислотами.
Например , если к раствору силиката натрия прилить сильно разбавленный раствор соляной кислоты, то кремниевая кислота выделится не в виде осадка, а в виде геля. Раствор помутнеет и «застынет».
Na2SiO3 + 2HCl = H2SiO3 + 2 NaCl

Видеоопыт взаимодействия силиката натрия с соляной кислоты (получение кремниевой кислоты) можно посмотреть здесь.
Соединения кремния
Основные степени окисления кремния +4, 0 и -4.
Наиболее типичные соединения кремния:
Способы получения кремния
В свободном состоянии кремний был получен Берцелиусом в 1822 г. Его латинское название «силиций» произошло от латинского слова « sile х», что означает «кремень». Аморфный кремний в лаборатории можно получить при прокаливании смеси металлического магния с диоксидом кремния. Для опыта диоксид кремния следует тщательно измельчить. При нагревании смеси начинается бурная реакция. Одним из продуктов этой реакции является аморфный кремний.
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
Еще один способ получения кремния в лаборатории — восстановление из оксида алюминием:
В промышленности использовать дорогие алюминий и магний неэффективно, поэтому используют другие, более дешевые способы:
1. Восстановление из оксида коксом в электрических печах:
SiO2 + 2C → Si + 2CO
Однако в таком процессе процессе образующийся кремний загрязнен примесями карбидов кремния, и для производства, например, микросхем уже не подходит.
2. Наиболее чистый кремний получают восстановлением тетрахлорида кремния водородом при 1200 °С:
SiCl4 +2H2 → Si + 4HCl
или цинком :
SiCl4 + 2Zn → Si + 2ZnCl2
3. Также чистый кремний получается при разложении силана :
Химические свойства
При нормальных условиях кремний существует в виде атомного кристалла, поэтому химическая активность кремния крайне невысокая.
1. Кремний проявляет свойства окислителя (при взаимодействии с элементами, которые расположены ниже и левее в Периодической системе) и свойства восстановителя (при взаимодействии с элементами, расположенными выше и правее). Поэтому кремний реагирует и с металлами , и с неметаллами .
1.1. При обычных условиях кремний реагирует с фтором с образованием фторида кремния (IV):
При нагревании кремний реагирует с хлором, бромом, йодом :
1.2. При сильном нагревании (около 2000 о С) кремний реагирует с углеродом с образованием бинарного соединения карбида кремния (карборунда):
C + Si → SiC
При температуре выше 600°С взаимодействует с серой:
Si + 2S → SiS2
1.3. Кремний не взаимодействует с водородом .
1.4. С азотом кремний реагирует в очень жестких условиях:
1.5. В реакциях с активными металлами кремний проявляет свойства окислителя. При этом образуются силициды:
2Ca + Si → Ca2Si
Si + 2Mg → Mg2Si
1.6. При нагревании выше 400°С кремний взаимодействует с кислородом :
2. Кремний взаимодействует со сложными веществами:
2.1. В водных растворах щелочей кремний растворяется с образованием солей кремниевой кислоты. При этом щелочь окисляет кремний.
2.2. Кремний не взаимодействует с водными растворами кислот , но аморфный кремний растворяется в плавиковой кислоте с образованием гексафторкремниевой кислоты :
При обработке кремния безводным фтороводородом комплекс не образуется:
С хлороводородом кремний реагирует при 300 °С, с бромоводородом – при 500 °С.
2.3. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот :
3Si + 4HNO3 + 12HF → 3SiF4 + 4NO + 8H2O
Бинарные соединения кремния
Силициды металлов
Силициды – это бинарные соединения кремния с металлами, в которых кремний имеет степень окисления -4. Химическая связь в силицидах металлов — ионная.
Силициды, как правило, легко гидролизуются в воде или в кислой среде.
Например , силицид магния разлагается водой на гидроксид магния и силан:
Соляная кислота легко разлагает силицид магния:
Получают силициды сплавлением простых веществ или восстановлением смеси оксидов коксом в электропечах:
2Mg + Si → Mg 2 Si
2MgO + SiO2 + 4C → Mg2Si + 4CO
Силан
Силан – это бинарное соединение кремния с водородом SiH4, ядовитый бесцветный газ.
Если поместить порошок силицида магния в очень слабый раствор соляной кислоты, то на поверхности раствора образуются пузырьки газа. Они лопаются и загораются на воздухе. Это горит силан. Он образуется при взаимодействии кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
На воздухе силан горит с образованием SiO2 и H2O:
Видеоопыт сгорания силана можно посмотреть здесь.
Силан разлагается водой разлагается с выделением водорода:
Силан разлагается (окисляется) щелочами :
Силан при нагревании разлагается :
Карбид кремния
В соединениях кремния с неметаллами — ковалентная связь.
Рассмотрим карбид кремния – карборунд Si +4 C -4 . Это вещество с атомной кристаллической решеткой. Он имеет структуру, подобную структуре алмаза и характеризуется высокой твердостью и температурой плавления, а также высокой химической устойчивостью.
Карборунд окисляется кислородом при высокой температуре:
Карборунд окисляется кислородом в расплаве щелочи :
Галогениды кремния
Хлорид и фторид кремния – галогенангидриды кремниевой кислоты.
SiCl4.
Получают галогениды кремния действием хлора на сплав оксида кремния с углем :
Галогениды кремния разлагаются водой до кремниевой кислоты и хлороводорода:
Хлорид кремния (IV) восстанавливается водородом :
SiCl4 + 2H2 → Si + 4HCl
Оксид кремния (IV)
Физические свойства и нахождение в природе
Оксид кремния (IV) – это твердое вещество с атомной кристаллической решеткой. В природе встречается в виде кварца, речного песка, кремнезема и прочих модификаций:

Химические свойства
Оксид кремния (IV) – типичный кислотный оксид . За счет кремния со степенью окисления +4 проявляет слабые окислительные свойства.
1. Как кислотный оксид, диоксид кремния (IV) взаимодействует с растворами и расплавами щелочей и в расплаве с основными оксидами . При этом образуются силикаты.
Например , диоксид кремния взаимодействует с гидроксидом калия:
Еще пример : диоксид кремния взаимодействует с оксидом кальция.
SiO2 + CaO → CaSiO3
2. Оксид кремния (IV) не взаимодействует с водой , т.к. кремниевая кислота нерастворима .
3. Оксид кремния (IV) реагирует при сплавлении с карбонатами щелочных металлов . При этом работает правило: менее летучий оксид вытесняет более летучий оксид из солей при сплавлении.
Например , оксид кремния (IV) взаимодействует с карбонатом калия. При этом образуется силикат калия и углекислый газ:
4. Из кислот диоксид кремния реагирует только с плавиковой или с газообразным фтороводородом :
5. При температуре выше 1000 °С оксид кремния реагирует с активными металлами, при этом образуется кремний.
Например , оксид кремния взаимодействует с магнием с образованием кремния и оксида магния:
SiO2 + 2Mg → Si + 2MgO
Видеоопыт взаимодействия оксида кремния (IV) с магнием можно посмотреть здесь.
При избытке восстановителя образуются силициды:
SiO2 + 4Mg → Mg2Si + 2MgO
6. Оксид кремния (IV) взаимодействует с неметаллами.
Например , оксид кремния (IV) реагирует с водородом в жестких условиях. При этом оксид кремния проявляет окислительные свойства:
Еще пример : оксид кремния взаимодействует с углеродом. При этом образуется карборунд и угарный газ:
SiO2 + 3С → SiС + 2СО
При сплавлении оксид кремния взаимодействует с фосфатом кальция и углем:
Кремниевая кислота
Строение молекулы и физические свойства
Кремниевые кислоты — очень слабые, малорастворимые в воде соединения общей формулы nSiO2•mH2O. Образует коллоидный раствор в воде.

Метакремниевая H2SiO3 существует в растворе в виде полимера:

Способы получения
Кремниевая кислота образуется при действии сильных кисло т на растворимые силикаты (силикаты щелочных металлов).
Например , при действии соляной кислоты на силикат натрия:
Na 2 SiO 3 + 2 HCl → H 2 SiO 3 + 2 NaCl
Видеоопыт получения кремниевой кислоты из силиката натрия можно посмотреть здесь.
Даже слабая угольная кислота вытесняет кремниевую кислоту из солей:
Химические свойства
1. Кремниевая кислота — нерастворимая. Кислотные свойства выражены очень слабо, поэтому кислота реагирует только с сильными основаниями и их оксидами :
Например , кремниевая кислота реагирует с концентрированным гидроксидом калия:
2. При нагревании кремниевая кислота разлагается на оксид и воду :
Силикаты
Силикаты — это соли кремниевой кислоты. Большинство силикатов нерастворимо в воде, кроме силикатов натрия и калия, их называют «жидким стеклом».
Способы получения силикатов:
1 . Растворение кремния, кремниевой кислоты или оксида в щелочи:
2. Сплавление с основными оксидами:
СаО + SiO2 → CaSiO3
3. Взаимодействие растворимых силикатов с солями:
Оконное стекло (натриевое стекло) — силикат натрия и кальция: Na2O·CaO·6SiO2.
Стекло получают при сплавлении в специальных печах смеси соды Na2CO3, известняка CaCO3 и белого песка SiO2:
Для получения специального стекла вводят различные добавки, так стекло содержащее ионы Pb 2+ – хрусталь; Cr 3+ – имеет зеленую окраску, Fe 3+ – коричневое бутылочное стекло, Co 2+ – дает синий цвет, Mn 2+ – красновато-лиловый.
Кремний (Si)
Соединения кремния:
В чистом виде впервые кремний был выделен в 1811 году (французы Ж. Л. Гей-Люссак и Л. Ж. Тенар). Чистый элементарный кремний был получен в 1825 г. (швед Й. Я. Берцелиус). Свое название “кремний” (в переводе с древнегреческого – гора) химический элемент получил в 1834 году (российский химик Г. И. Гесс).
Кремний является самым распространенным (после кислорода) химическим элементом на Земле (содержание в земной коре 28-29% по массе). В природе кремний чаще всего присутствует в виде кремнезема (песок, кварц, кремень, полевые шпаты), а также в силикатах и алюмосиликатах. В чистом виде кремний встречается чрезвычайно редко. Многие природные силикаты в чистом виде являются драгоценными камнями: изумруд, топаз, аквамари – это все кремний. Чистый кристаллический оксид кремния (IV) встречается в виде горного хрусталя и кварца. Оксид кремния, в котором присутствуют различные примеси, образует драгоценные и полудрагоценные камни – аметист, агат, яшма.
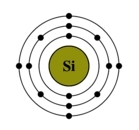
Рис. Строение атома кремния.
Электронная конфигурация кремния – 1s 2 2s 2 2p 6 3s 2 3p 2 (см. Электронная структура атомов). На внешнем энергетическом уровне у кремния находятся 4 электрона: 2 спаренных на 3s-подуровне + 2 неспаренных на p-орбиталях. При переходе атома кремния в возбужденное состояние один электрон с s-подуровня “покидает” свою пару и переходит на p-подуровень, где имеется одна свободная орбиталь. Т. о., в возбужденном состоянии электронная конфигурация атома кремния приобретает следующий вид: 1s 2 2s 2 2p 6 3s 1 3p 3 .
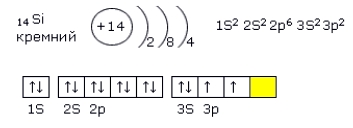
Рис. Переход атома кремния в возбужденное состояние.
Т. о., кремний в соединениях может проявлять валентность 4 (чаще всего) или 2 (см. Валентность). Кремний (так же, как и углерод), реагируя с другими элементами, образует химические связи в которых может как отдавать свои электроны, так и принимать их, но при этом способность принимать электроны у атомов кремния выражена слабее, чем у атомов углерода, по причине большего размера атома кремния.
Степени окисления кремния:
- -4: SiH4 (силан), Ca2Si, Mg2Si (силикаты металлов);
- +4 – наиболее устойчивая: SiO2 (оксид кремния), H2SiO3 (кремниевая кислота), силикаты и галогениды кремния;
- : Si (простое вещество)
Кремний, как простое вещество
Кремний представляет из себя темно-серое кристаллическое вещество с металлическим блеском. Кристаллический кремний является полупроводником.
Кремний образует только одну аллотропную модификацию, подобную алмазу, но при этом не такую прочную, т. к. связи Si-Si не так прочны, как в алмазной молекуле углерода (См. Алмаз).
Аморфный кремний – порошок бурого цвета, с температурой плавления 1420°C.
Кристаллический кремний получают из аморфного путем его перекристаллизации. В отличие от аморфного кремния, который является достаточно активным химическим веществом, кристаллический кремний более инертен в плане взаимодействия с другими веществами.
Строение кристаллической решетки кремния повторяет структуру алмаза, – каждый атом окружен четырьмя другими атомами, расположенными в вершинах тетраэдра. Атомы связываются друг с другом ковалентными связями, которые не так прочны, как углеродные связи в алмазе. По этой причине, даже при н.у. некоторые ковалентные связи в кристаллическом кремнии разрушаются, в результате чего высвобождается некоторая часть электронов, благодаря чему кремний обладает небольшой электропроводностью. По мере нагревания кремния, на свету или при добавлении некоторых примесей, кол-во разрушаемых ковалентных связей увеличивается, вследствие чего и увеличивается кол-во свободных электронов, следовательно, растет и электропроводность кремния.
Химические свойства кремния
Как и углерод, кремний может быть и восстановителем, и окислителем, в зависимости от того, с каким веществом вступает в реакцию.
При н.у. кремний взаимодействует только с фтором, что объясняется достаточно прочной кристаллической решеткой кремния.
В реакцию с хлором и бромом кремний вступает при температурах, превышающих 400°C.
С углеродом и азотом кремний взаимодействует только при очень высоких температурах.
- В реакциях с неметаллами кремний выступает в роли восстановителя:
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
Si + 2F2 = SiF4 - при высоких температурах кремний реагирует с хлором (400°C), кислородом (600°C), азотом (1000°C), углеродом (2000°C):
- Si + 2Cl2 = SiCl4 – галогенид кремния;
- Si + O2 = SiO2 – оксид кремния;
- 3Si + 2N2 = Si3N4 – нитрид кремния;
- Si + C = SiC – карборунд (карбид кремния)
- при нормальных условиях из неметаллов кремний реагирует только с фтором, образуя галогенид кремния:
- В реакциях с металлами кремний является окислителем (образуются салициды:
Si + 2Mg = Mg2Si - В реакциях с концентрированными р-рами щелочей кремний реагирует с выделением водорода, образуя растворимые соли кремниевой кислоты, называемые силикатами:
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑ - С кислотами (за исключением HF) кремний не реагирует.
Получение и применение кремния
Получение кремния:
- в лаборатории – из кремнезема (алюмотерапия):
3SiO2 + 4Al = 3Si + 2Al2O3 - в промышленности – восстановлением оксида кремния коксом (технически чистый кремний) при высокой температуре:
SiO2 + 2C = Si + 2CO - самый чистый кремний получают восстановлением тетрахлорида кремния водородом (цинком) при высокой температуре:
SiCl4+2H2 = Si+4HCl
Применение кремния:
- изготовление полупроводниковых радиоэлементов;
- в качестве металлургических добавок при производстве жаропрочных и кислотоустойчивых соединений;
- в производстве фотоэлементов для солнечных батарей;
- в качестве выпрямителей переменного тока.
Если вам понравился сайт, будем благодарны за его популяризацию  Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
Валентность химических элементов. Степень окисления химических элементов

Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭHx или оксид формулы ЭnOm.
Так, валентность атома азота в молекуле аммиака NH3 равна трём, а атома серы в молекуле H2S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na2O, BaO, Al2O3, SiO2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк — двухвалентны, алюминий — трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента — партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения — FeCl2 и FeCl3, в которых валентность железа равна соответственно 2 и 3.
Степень окисления — понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность — мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 — электроотрицательность элементов по шкале Полинга.
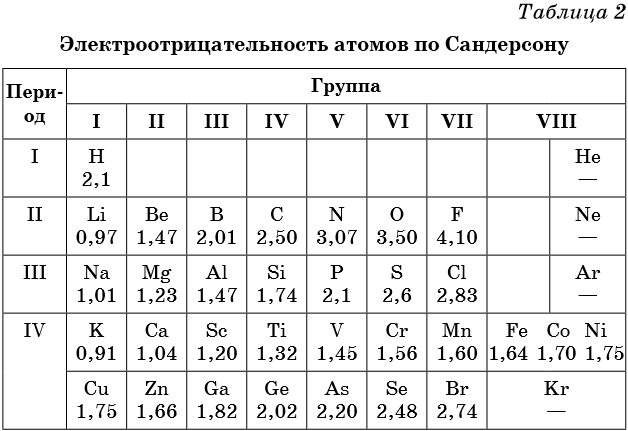
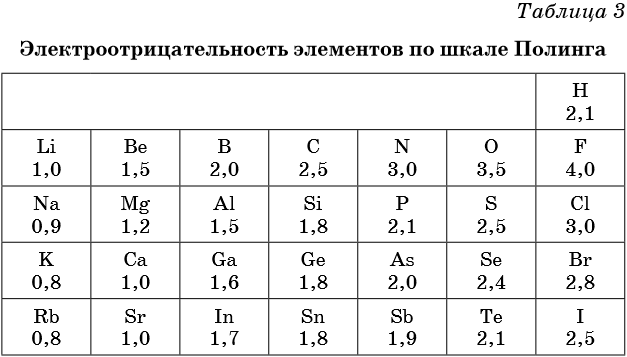
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным — атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше — 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный — на атоме серы.
В молекуле аммиака NH3 значение электроотрицательности атома азота равно 3,0, а водорода — 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный — у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя — октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl3, NO2. Из этого правила есть некоторые исторически сложившиеся исключения, например NH3, PH3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
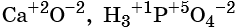
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF2 + 2, в пероксидах металлов типа M2O2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K + — +1, Ba 2+ — +2, Br – — –1, S 2– — –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного — знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K2O, селена SeO3 и железа Fe3O4.
Оксид калия K2O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO3. Молекула SeO3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe3O4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO3, K2Cr2O7.
Молекула NaClO3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K2Cr2O7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO4 2– . Ион SO4 2– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH3 или в молекуле гидразина N2H4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 — номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
2. В каком соединении степень окисления фосфора равна –3?
3. В каком соединении степень окисления азота равна +4?
4. В каком соединении степень окисления азота равна –2?
5. В каком соединении степень окисления серы равна +2?
6. В каком соединении степень окисления серы равна +6?
7. В веществах, формулы которых CrBr2, K2Cr2O7, Na2CrO4, степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) числу электронов, недостающих до завершения внешнего электронного слоя
4) общему числу электронов в элементе
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
11. Фосфор проявляет минимальную степень окисления в соединении
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Валентность и степень окисления
Валентность
Валентность (лат. valere – иметь значение) – мера “соединительной способности” химического элемента, равная числу индивидуальных химических связей, которые может образовать один атом.
Определяют валентность по числу связей, которые один атом образует с другими. Для примера рассмотрим две молекулы

Для определения валентности нужно хорошо представлять графические формулы веществ. В этой статье вы увидите множество формул. Сообщаю вам также о химических элементах с постоянной валентностью, знать которые весьма полезно.

В электронной теории считается, что валентность связи определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии. Мы касались с вами темы валентных электронов и возбужденного состояния атома. На примере фосфора объединим эти две темы для полного понимания.

Подавляющее большинство химических элементов обладает непостоянным значением валентности. Переменная валентность характерна для меди, железа, фосфора, хрома, серы.
Ниже вы увидите элементы с переменной валентностью и их соединения. Заметьте, определить их непостоянную валентность нам помогают другие элементы – с постоянной валентностью.

Запомните, что у некоторых простых веществ валентность принимает значения: III – у азота, II – кислорода. Подведем итог полученным знаниям, написав графические формулы азота, кислорода, углекислого и угарного газов, карбоната натрия, фосфата лития, сульфата железа (II) и ацетата калия.

Как вы заметили, валентности обозначаются римскими цифрами: I, II, III и т.д. На представленных формулах валентности веществ равны:
- N – III
- O – II
- H, Na, K, Li – I
- S – VI
- C – II (в угарном газе CO), IV (в углекислом газе CO2 и карбонате натрия Na2CO3
- Fe – II
Степень окисления
Степенью окисления (СО) называют условный показатель, который характеризует заряд атома в соединении и его поведение в ОВР (окислительно-восстановительной реакции). В простых веществах СО всегда равна нулю, в сложных – ее определяют исходя из постоянных степеней окисления у некоторых элементов.
Численно степень окисления равна условному заряду, который можно приписать атому, руководствуясь предположением, что все электроны, образующие связи, перешли к более электроотрицательному элементу.
Определяя степень окисления, одним элементам мы приписываем условный заряд “+”, а другим “-“. Это связано с электроотрицательностью – способностью атома притягивать к себе электроны. Знак “+” означает недостаток электронов, а “-” – их избыток. Повторюсь, СО – условное понятие.

Сумма всех степеней окисления в молекуле равна нулю – это важно помнить для самопроверки.
Зная изменения электроотрицательности в периодах и группах периодической таблицы Д.И. Менделеева, можно сделать вывод о том какой элемент принимает “+”, а какой минус. Помогают в этом вопросе и элементы с постоянной степенью окисления.
Кто более электроотрицательный, тот сильнее притягивает к себе электроны и “уходит в минус”. Кто отдает свои электроны и испытывает их недостаток – получает знак “+”.

Самостоятельно определите степени окисления атомов в следующих веществах: RbOH, NaCl, BaO, NaClO3, SO2Cl2, KMnO4, Li2SO3, O2, NaH2PO4. Ниже вы найдете решение этой задачи.
Сравнивайте значение электроотрицательности по таблице Менделеева, и, конечно, пользуйтесь интуицией  Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию
Однако по мере изучения химии, точное знание степеней окисления должно заменить даже самую развитую интуицию 

Особо хочу выделить тему ионов. Ион – атом, или группа атомов, которые за счет потери или приобретения одного или нескольких электронов приобрел(и) положительный или отрицательный заряд.
Определяя СО атомов в ионе, не следует стремиться привести общий заряд иона к “0”, как в молекуле. Ионы даны в таблице растворимости, они имеют разные заряды – к такому заряду и нужно в сумме привести ион. Объясню на примере.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Валентность и степень окисления
Кремний общая характеристика химического элемента

Кремний – химический элемент таблицы Менделеева. Попробуем разобраться, что же такое кремний – металл или неметалл?
Какова его природа, общая характеристика и свойства не только в физике, но и в химии? Как реагирует с другими веществами? Какие соединения образуют? Каковы области применения этого элемента?
- Общая характеристика
- Состав и структура кремния
- Физические свойства
- Химические свойства
- Восстановительные процессы
- Окислительные процессы
- Получение кремния
- В лаборатории
- В промышленности
- Области применения
- Плюсы и минусы кремния
- Заключение
Общая характеристика
Обозначение этого элемента в таблице Менделеева – Si (silicium – «силициум»). В таблице он стоит в четвертой группе третьего периода. Является неметаллом.

Первое название этого элемента силиций. В середине 19 века его стали называть «кремнием».
Основные особенности:
- Второй по распространенности элемент таблицы Менделеева.
- Аналог углерода – это элемент (а также его генетический ряд) со своими специфическими особенностями.
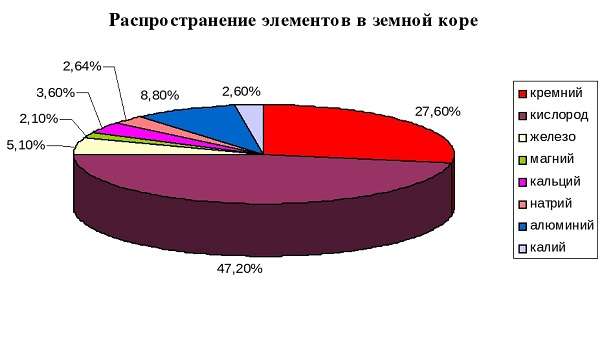
Где можно взять кремний? В основном, в природе он находится в земле в виде оксидов и других структур горных пород (кварц, силикат и т. д.).
Состав и структура кремния
Рассмотрим основные параметры этого элемента в таблице.
| Признак | Характеристика |
| Атомная масса | 28,086 а. е. м. |
| Молекулярная (молярная) масса | 28,086 г/моль |
| Размер атома / заряд ядра | 14 |
| Валентность | 2,4 |
| Степень окисления | ±4, -2 |
| Плотность | 2,33 г/см3 |
| Температура плавления | 1688 К |
| Химическая связь | ковалентная неполярная |
| Кристаллическая решетка | атомная |
У кремния есть 3 изотопа: Si (28), Si (29), Si (30).
Электронное строение атома кремния показано на картинке:
Физические свойства
Строение атома кремния, из которого состоит большинство материалов, позволяет доказать ученым наличие аллотропии у этого элемента.
Выделяют 2 модификации:
- аморфный,
- кристаллический.

Первый представляет собой порошок коричневого цвета, который плавится при температуре свыше 1400 градусов Цельсия.
Второй – кристаллизованный кремний темно-серого оттенка с блестящей поверхностью.

По сравнению с предыдущим, обладает высокими показателями тепло- и электропроводности.
Химические свойства
Поскольку он находится в четвертой группе главной подгруппе таблицы Менделеева, то может проявлять как окислительные, так и восстановительные свойства.
Рассмотрим по отдельности каждый вид реакций.
Восстановительные процессы

С простыми веществами:
Si + 2Br2 = SiBr4,
Со сложными веществами:
3Si + 12HF + 4HNO3 = 3SiF4 + 4NO + 8H2O.
Si + 2NaOH + H2O = Na2SiO3 + 2H2.
Окислительные процессы
Он проявляет при взаимодействии с гидридами, металлами, солями, сильными концентрированными кислотами.
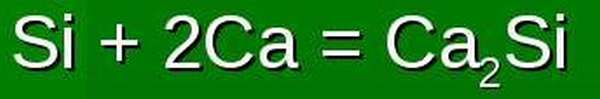
Как правило, в качестве побочных продуктов в таких реакциях выступают окиси неметаллов, сульфаты, нитраты и другие соли, содержащие этот элемент.
Получение кремния
Различают два способа получения кремния: лабораторный и промышленный. Рассмотрим подробно оба.
В лаборатории
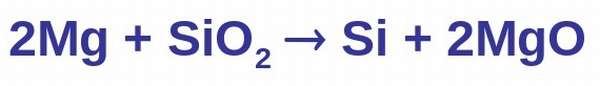
Его восстанавливают с помощью магния или алюминия при нагревании.
В промышленности
Получение этим способом требует больших усилий:
- В печах под действием кокса идет разложение диоксида кремния при температуре свыше 1790 градусов по Цельсию.
- Очищают полученный кремний от примесей. Как правило, получают соль, а затем обрабатывают кислотами.
- Очистку проводят до тех пор, пока массовая доля в образце не будет ниже 95%.
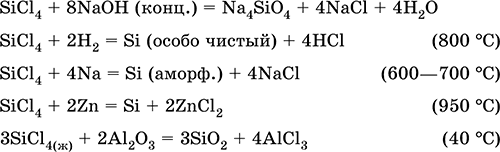
Кроме того, в промышленности в последние годы популярным способом очистки стало хлорирование. Оно используется чаще, поскольку этот метод экономически выгоден и дает большую степень очистки.
В России существует всего два завода по производству технического кремния: Каменск-Уральский и Усолье-Сибирский.
Области применения

Кремний имеет широкую область применения:
- Он является хорошим сырьем для получения его аллотропных модификаций и различных соединений на его основе.
- Это главный компонент при получении различных сплавов. Как правило, в металлургии это главный окислитель и модифицирующий элемент.
- Кремний часто используется для получения стекла и цемента.
- Он является незаменимым компонентом в производстве батарей.
- Кремний чаще всего используется как подручное средство для получения других простых веществ в лаборатории.
Плюсы и минусы кремния
Попробуем разобраться, в чем же заключаются преимущества и недостатки этого элемента? Как он вообще влияет на жизнь различных организмов?

Кремний необходим растениям для питания и роста, некоторым простейшим организмам для правильного протекания процессов жизнедеятельности.
В организмах высших существ он играет важную роль (является одним из незаменимых микроэлементов), но помимо этого может вредить им (вызывать силикоз – отравление солями этого неметалла).
Незаменима его роль в промышленности и технике, металлургии. А вот медицинские показатели еще до конца не изучены, поэтому применять его для лечения различных заболеваний можно с осторожностью и только по рекомендациям врача.
Заключение
Кремний незаменим в химии и физике. Он играет важнейшую роль в биохимических реакциях организма человека. Правда избыток этого элемента может привести к хроническим болезням.





