Метанол (метиловый спирт). Справка
Судмедэксперты индонезийской полиции обнаружили следы метанола в образцах внутренних органов трех российских инженеров, скончавшихся в Индонезии.
Метиловый спирт (метанол, карбинол, древесный спирт) СН3ОН – бесцветная, легкоподвижная жидкость с запахом, аналогичным запаху этилового спирта. Сырьем для производства метилового спирта служат главным образом природный газ и отходы нефтепереработки, а также коксующийся уголь, газы производства ацетилена пиролизом природного газа и др.
Метанол получают в промышленности восстановлением монооксида углерода при 400° С под давлением 20-30 МПа (мегапаскаль) в присутствии катализатора, состоящего из оксидов меди, хрома, и алюминия.
Метиловый спирт смешивается во всех соотношениях с водой, спиртами, ацетоном, бензолом; образует азеотропные смеси (смеси жидкостей, которые кипят при постоянной температуре и перегоняются без изменения состава) с ацетоном, бензолом, сероуглеродом, тетрахлорид углеродом и мн. др. соединениями.
До 1960-х гг. метиловый спирт синтезировали только на цинкхромовом катализаторе при 300-400°С и давлении 25-40 МПа. Впоследствии распространение получил синтез метилового спирта на медьсодержащих катализаторах (медьцинкалюмохромовом, медь‑цинкалюминиевом или др.) при 200-300°С и давлении 4-15 МПа.
Впервые метиловый спирт был выделен из продуктов сухой перегонки древесины Жаном Батистом Дюма и Эженом Пелиго, которые, сопоставив его свойства со свойствами винного спирта, дали первые представления о классе спиртов (1835). В 1857 г. французский химик Марселен Бертло синтезировал метиловый спирт омылением метилхлорида. Синтетический метиловый спирт начали получать с 1923 г.
Метанол используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных смол. Большие объемы метанола используют при добыче и транспорте природного газа.
Его используют также для получения лекарственных веществ, как добавку к бензину и для получения бензина в целях экономии нефтяного сырья. Разрабатываются процессы получения из метилового спирта уксусного ангидрида, винилацетата, этанола, ацетальдегида, этиленгликоля и др. многотоннажных нефтехимических продуктов.
Метанол – наиболее токсичное соединение среди всех спиртов. Он окисляется в организме человека значительно медленнее, чем этиловый спирт, и в ходе его окисления образуются различные ядовитые вещества.
Метиловый спирт быстро всасывается в желудке и тонком кишечнике. Почти весь метанол (90%) метаболизируется в печени при помощи фермента алкогольдегидрогеназы, в результате чего образуются формальдегид и муравьиная кислота, обладающие высокой токсичностью. Метаболиты метанола удаляются почками, а меньшая часть (15%) в неизменном виде выделяется через легкие.
Метанол является сильным ядом преимущественно нервного и сердечно-сосудистого действия с выраженными кумулятивными свойствами. Токсическое действие метанола связано с угнетением центральной нервной системы, развитием тяжелого метаболического ацидоза (изменение кислотно-щелочного баланса организма), поражением сетчатки глаза и дистрофией зрительного нерва.
Острое отравление при вдыхании паров встречается редко. Опасен прием метанола внутрь: 5-10 мл могут вызвать тяжелые отравления и слепоту, а 30 мл – привести к смертельному исходу. Острое отравление характеризуется состоянием легкого опьянения, тошнотой, рвотой, сильной головной болью, резким ухудшением зрения вплоть до слепоты; при утяжелении состояния – цианоз (синюшная окраска кожи и слизистых оболочек), затрудненное дыхание, расширение зрачков, судороги и смерть от остановки дыхания.
Диагноз подтверждается обнаружением в моче муравьиной кислоты.
При очень больших дозах отравление может протекать в молниеносной форме, смерть наступает в течение 2-3 часов. Летальность при отравлении метиловым спиртом значительна.
Хронические отравления характеризуются головокружением, головной болью, бессонницей, повышенной утомляемостью, желудочно-кишечными расстройствами, болями в области сердца и печени, нарушением функции зрения, прежде всего цветного.
Материал подготовлен на основе информации открытых источников
Метанол — химические и физические свойства, общая характеристика





Молекулярная и структурная формула метанола
Чтобы правильно понимать суть происходящего, стоит обратить внимание на название вещества. В его составе 4 атома водорода и по одному атому углерода и кислорода.

Молекулярная формула выглядит так — CH3OH.
Плотность находится на отметке 0,8101 г/см3.
Структура отображается в таблице следующим образом:
| Название вещества | Число атомов | Процент содержания массы | Молярный вес каждого по отдельности |
| O2 — кислород | 1 | 49,9% | 16 |
| H2 — водород | 4 | 37,5% | 1,008 |
| С — углерод | 1 | 12,6% | 12,011 |
Общая схема установки

Работа общей схемы: из газовой магистрали метан поступает через вентиль (14) в теплообменник (3.1), разогревается до 250—300°C, затем поступает в фильтрующий реактор (15), который работает по принципу каталитического насоса (как на рис.2, только диаметр трубы — 8см) и содержит в себе окись цинка — для очистки газа от примесей серы и лишь затем газ поступает в смеситель-диспергатор (2), где насыщается парами воды.
Вода (дистиллированная) добавляется в диспергатор непрерывно из бачка (1).
Вышедшая газовая смесь поступает в теплообменник (3.2), где разогревается до 500—600°C и идет в конвертор (4). На катализаторе при температуре 800°C происходит реакция [2]. Для создания этой температуры работают горелки (12).
После установления температурных режимов включается компрессор (5) и постепенно подается воздух в смеситель (11).
Повышение давления осуществляется путем вворачивания винта в клапане (8). Одновременно уменьшаем пламя на горелках (12) при помощи вентиля (14.2).
Полученный на выходе синтез-газ поступает в теплообменники (3.1; 3.2), где охлаждается до температуры 320—350°. Затем синтез-газ поступает в синтезатор метанола (6), где на катализаторе из смеси одинакового количества ZnO, CuO, CoO происходит превращение его в метанол СН3ОН.
Смесь газообразных продуктов на выхода охлаждается в теплообменнике (3.3), который описан выше (см. рис. 1) и поступает в накопительный бачок (10). В верхней его части находится трубка — фитиль (13), где дожигаются продукты, которые не прореагировали в процессах.
ВНИМАНИЕ: сжигание непрореагировавших газов совершенно необходимо!
Метан через вентиль (14) поступает в теплообменник (3.1), разогревается до 250—300 градусов и поступает через реактор-фильтр (15) в смеситель—диспергатор (2), где насыщается парами воды.
Вода добавляется в диспергатор непрерывно из бачка(1). Вышедшая газовая смесь поступает в теплообменник (3.2), где разогревается до 500—600 градусов и идет в конвертор (4).
На NiO — катализаторе при температуре 800—900 градусов происходит реакция [2]. Рабочую температуру создают горелки (12).
Важные советы
Катализаторы можно готовить самому путем прокаливания порошковых металлов на воздухе.
Измерение температуры можно осуществлять при помощи термоиндикаторных красок, которые в настоящее время достаточно распространены. Измерение нужно проводить на входных и выходных трубках.
Если термокрасок вы не достанете, можно изготовить сплав олово — свинец — цинк. При определенных, найденных экспериментально, пропорциях смешения они будут иметь необходимую температуру плавления. Нанося полученные сплавы на трубки и следя за их плавлением, можно с некоторой погрешностью контролировать температуру.
Если вы не допустили образования газовых карманов (т.е. полностью заполнены все полости соответствующей крошкой), если устранили утечки и самое главное — своевременно зажжен и постоянно горит фитиль (11), то установка будет абсолютно безопасна.
Подбирая катализаторы можно повышать тепловой КПД, увеличить процент выхода метанола. Для достижения оптимума здесь требуются эксперименты. Они проводятся во многих институтах разных стран. В России к числу таких НИИ относится, например, ГИАП (Государственный институт азотной промышленности).
Следует иметь в виду, что получение метанола из природного газа в компактных установках — новое дело, и многие процессы еще недостаточно изучены. В то же время метанол — одно из самых экологически чистых и практически идеальных топлив. И, самое главное, получение его основано на безграничных и возобновляемых ресурсах — метане.
Производство метанола
Промышленность занимается его выпуском в крупных масштабах. Причем способов для этого довольно много. Одним из самых востребованных является синтезирование метана.

Процесс реакции связан с неполным окислением и образованием формы эфира. Еще один способ, разрешенный стандартами ГОСТ, связан с разложением солевых отложений муравьиной кислоты.
Применение метилового спирта
Органическая химия использует его как растворитель. Нефтегазовая и техническая промышленность с его помощью предотвращает появление кристаллических соединений. Это связано с низкой температурой порога замерзания.

В домашних условиях синтез подразумевает окрашивание с помощью лакокрасочных продуктов. Ведь их получение и начальная консистенция зависит от нескольких составляющих.
Насчет суррогатного алкоголя стоит понять одну простую вещь. При попадании в организм, вред неизбежен и необратим вообще. Вероятность отравления и смертельного исходя очень высока.











Токсичность[править | править вики-текст]
Метанол — опаснейший яд, приём внутрь порядка 10 мл метанола может приводить к тяжёлому отравлению (одно из последствий —слепота)[14], попадание в организм более 80-150 миллилитров метанола (1-2 миллилитра чистого метанола на килограмм тела[15]) обычносмертельно[16]. LD50 для животных — от единиц до десятка г/кг[17]. Токсический эффект метанола развивается на протяжении нескольких часов, и эффективные антидоты способны уменьшить наносимый вред[14]. Опасен для жизни не только чистый метанол, но и жидкости, содержащие этот яд даже в сравнительно небольшом количестве.
В США максимальное суточное употребление метанола (Reference Dose), не связанное с какими-либо эффектами на здоровье, составляет 2 мг на кг веса тела (с 1988 года).[18]
Предельно допустимая концентрация метанола в воздухе рабочей зоны равна 5 мг/м³[19] (у изопропилового спирта 10 мг/м³[20], у этанола — 1000 мг/м³), ПДК в воздухе населенных мест равна 1,0 мг/м³ (у изопропилового спирта 0,6 мг/м³, у этанола — 5 мг/м³[21]).
Наиболее легкая форма отравления характеризуется наличием головной боли, общей слабостью, недомоганием, ознобом, тошнотой, рвотой.
Токсичность метанола состоит в том, что при попадании в организм он с течением времени окисляется до ядовитого формальдегида, который вызывает слепоту, вредно влияет на нервную систему, вступает в реакции с белками.
Особая опасность метанола связана с тем, что по запаху и вкусу он неотличим от этилового спирта, из-за чего и происходят случаи его употребления внутрь. Йодоформная реакция: с этиловым спиртом выпадет йодоформ жёлтого цвета, а с метанолом ничего не выпадает (реакция не подходит для определения содержания метанола в растворе этанола)[22].
Как указано в руководстве для врача скорой медицинской помощи, при отравлении метанолом антидотом является этанол, который вводится внутривенно в форме 10 % раствора капельно или 30—40 % раствора перорально из расчёта 1—2 грамма раствора на 1 кг веса в сутки[23]. Полезный эффект в этом случае обеспечивается отвлечением фермента АДГ I на окисление экзогенного этанола[24].
Следует учесть, что при недостаточно точном диагнозе за отравление метанолом можно принять алкогольную интоксикацию, отравление дихлорэтаномили четырёххлористым углеродом — в этом случае введение дополнительного количества этилового спирта опасно[23].
Известно множество массовых отравлений метанолом, в частности, массовое отравление метиловым спиртом 9-10 сентября 2001 года в городе Пярну(Эстония). Источником метанола могут быть фальсифицированные незамерзающие жидкости для автомобилей[25], контрафактный алкоголь[26], метанол, выдаваемый за этиловый спирт.
Самое серьезное заблуждение покупателей зимних незамерзающих жидкостей состоит в том, что они считают безопасной жидкость, которая практически не пахнет. Наоборот, не имеет резкого запаха только метанол. Стеклоомывающие жидкости на его основе также имеют слабо выраженный запах. Разрешенный к применению изопропиловый спирт пахнет достаточно резко, поэтому его приходится маскировать большим кол-вом специальных отдушек. Также достаточно весомым критерием оценки качества жидкости является её цена, которая не может быть менее 120—150 рублей в розницу для жидкости на минус 20 градусов. Изопропиловый спирт дорог. Как правило, «метанольные» жидкости повально реализуются на автомагистралях. На всех подобных бутылках написано «без метанола». Так как производители ядовитых жидкостей для стекол работают «в тени», то и температуры кристаллизации ими не соблюдается. Так, любая жидкость с трассы не рассчитана, как правило, на температуры ниже минус 5 градусов, не смотря на надписи на этикетках.
Физические свойства
По сути, метанол это бесцветная жидкость. Теплопроводные свойства древесного спирта в два раза меньше, чем у бензина. Участвует в образовании взрывоопасных веществ из-за собственной горючести. Температура кипения метанола 64,70С.

Температура горения начинается от 460 градусов. Смешивается с различными жидкостями без каких-либо проблем. Таким способом получения добиваются образования веществ на жидкой основе, не содержащих алифатические углеводы. Азеотропные смеси появляются после тщательного смешивания с ацетоном или дихлорэтаном. Очень токсичен.
Химические свойства и реакции
Как и горючие смеси, метанол имеет собственное октановое число, даже в газообразном состоянии. Оно равняется 111 единицам, что допускает использование в двигателях внутреннего сгорания. Причем это получается даже в состоянии метилового спирта.

Также возможен вариант замены водорода щелочными металлами. Сложные эфиры получаются при взаимодействии с карбоновыми кислотами или минеральными. Положительно реагирует на галогениды фосфора.
Нахождение в природе
В свободном состоянии метиловый спирт встречается в природе лишь изредка и в очень небольших количествах (например в эфирных маслах), но производные его распространены довольно широко. Так, например, многие растительные масла содержат сложные эфиры метилового спирта: масла гаултерии — метиловый эфир салициловой кислоты C6H4(OH)COOCH3, масло жасмина — метиловый эфир антраниловой кислоты C6H4(NH2)COOCH3. Простые эфиры метилового спирта чрезвычайно часто встречаются среди природных веществ, например природных красителей, алкалоидов и т. п.
В промышленности метиловый спирт раньше получали исключительно путём сухой перегонки дерева. В жидких погонах, так называемом «древесном уксусе», наряду с уксусной кислотой (10 %), ацетоном (до 0,5 %), ацетальдегидом, аллиловым спиртом, метилацетатом, аммиаком и аминами содержится также 1,5—3 % метилового спирта. Для отделения уксусной кислоты продукты сухой перегонки пропускают через горячий раствор известкового молока, задерживающий её в виде уксуснокислого кальция. Значительно труднее отделить метиловый спирт от ацетона, так как температуры кипения их очень близки (ацетон, т.кип. 56,5°; метиловый спирт, т.кип. 64,7°). Все же путём тщательной ректификации на соответствующих колоннах в технике удается почти полностью отделить метиловый спирт от сопутствующего ему ацетона. Неочищенный метиловый спирт называется также «древесным спиртом».
Влияние на человеческий организм
Патологические изменения наступают после превышения допустимой нормы. Но слепота это только начало. Дальнейшие действия приведут к поражению участков головного мозга, полному нарушению работы мочевыводящих органов.

Моментальная смерть наступает при содержании в организме до 2 граммов на каждый килограмм веса. Это вызвано тем, что одноатомный спирт окисляется до яда формальдегид, который применялся раньше в качестве бесшумного убийцы. Он сразу парализует нервную систему и воздействует на белковые соединения. При этом токсический эффект появляется только через несколько часов.
Фосфорная кислота: получение и свойства
Строение молекулы и физические свойства
Фосфор в степени окисления +5 образует несколько кислот: орто-фосфорную H3PO4, мета-фосфорную HPO3, пиро-фосфорную H4P2O7.
Фосфорная кислота H3PO4 – это кислота средней силы, трехосновная, прочная и нелетучая. При обычных условиях фосфорная кислота – твердое вещество, хорошо растворимое в воде и гигроскопичное.

Валентность фосфора в фосфорной кислоте равна V.
При температуре выше +213 °C орто-фосфорная кислота переходит в пирофосфорную H4P2O7.

При взаимодействии высшего оксида фосфора с водой на холоде образуется метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу.

Способы получения
Наибольшее практическое значение из фосфорных кислот имеет ортофосфорная кислота.
1. Получить орто-фосфорную кислоту можно взаимодействием оксида фосфора (V) с водой:
2. Еще один способ получения фосфорной кислоты — вытеснение фосфорной кислоты из солей (фосфатов, гидрофосфатов и дигидрофосфатов) под действием более сильных кислот (серной, азотной, соляной и др.) .
Промышленный способ получения фосфорной кислоты обработка фосфорита концентрированной серной кислотой:
3. Фосфорную кислоту также можно получить жестким окислением соединений фосфора в водном растворе в присутствии кислот.
Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты:
Химические свойства
Фосфорная кислота – это кислота средней силы (по второй и третьей ступени слабая) .
1. Фосфорная кислота частично и ступенчато диссоциирует в водном растворе.
HPO4 2– ⇄ H + + PO4 3–
2. Фосфорная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , фосфорная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии фосфорной кислоты с гидроксидом калия образуются фосфаты, гидрофосфаты или дигидрофосфаты:
3. Фосфорная кислота вытесняет более слабые кислоты из их солей (карбонатов, сульфидов и др.). Также фосфорная кислота вступает в обменные реакции с солями.
Например , фосфорная кислота взаимодействует с гидрокарбонатом натрия:
4. При нагревании H3PO4 до 200°С происходит отщепление от нее молекулы воды с образованием пирофосфорной кислоты H2P2O7:
5. Фосфорная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , фосфорная кислота реагирует с магнием:
Фосфорная кислота взаимодействует также с аммиаком с образованием солей аммония:
7. Качественная реакция на фосфат-ионы и фосфорную кислоту — взаимодействие с нитратом серебра. При этом образуется ярко-желтый осадок фосфата серебра:

Видеоопыт взаимодействия фосфата натрия и нитрата серебра в растворе (качественная реакция на фосфат-ион) можно посмотреть здесь.
Фосфорная кислота [H3PO4]: Структура | Свойства | Применение

Фосфорная кислота – это коррозионно-активная неорганическая кислота с химической формулой H3PO4. Это слабая кислота, доступная в различных количествах, чистоте и различных классах реагентов.
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Номенклатура ИЮПАК для этого соединения – ортофосфорная кислота. Орто – это греческий термин, означающий «истинный», поэтому приставка «орто» относится к истинной форме фосфорной кислоты, то есть H3PO4.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
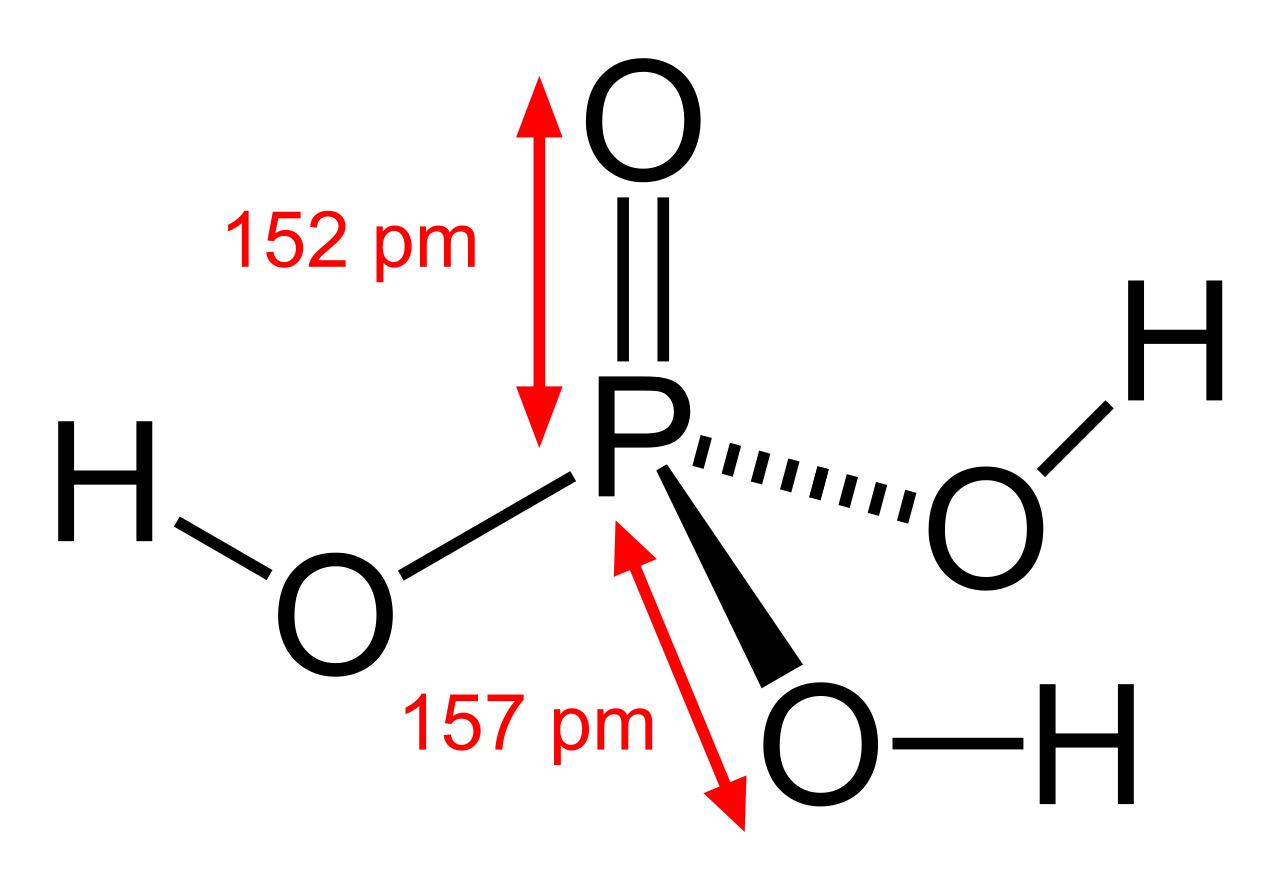
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
Фосфор может иметь расширенный октет (более восьми валентных электронов), поэтому он получает формальный заряд +1, в то время как кислород (тот, который не присоединен к атому водорода) получает формальный заряд -1. Образуя двойную связь, фосфор и кислород теряют свои заряды.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
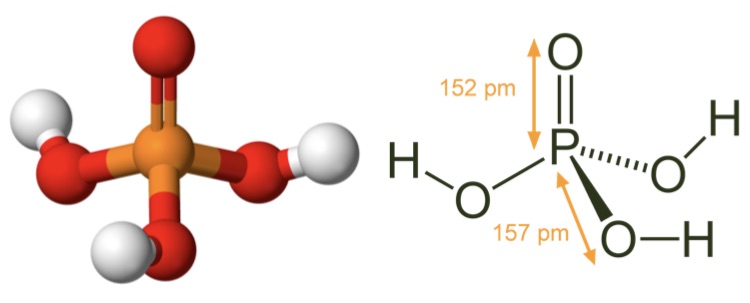
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
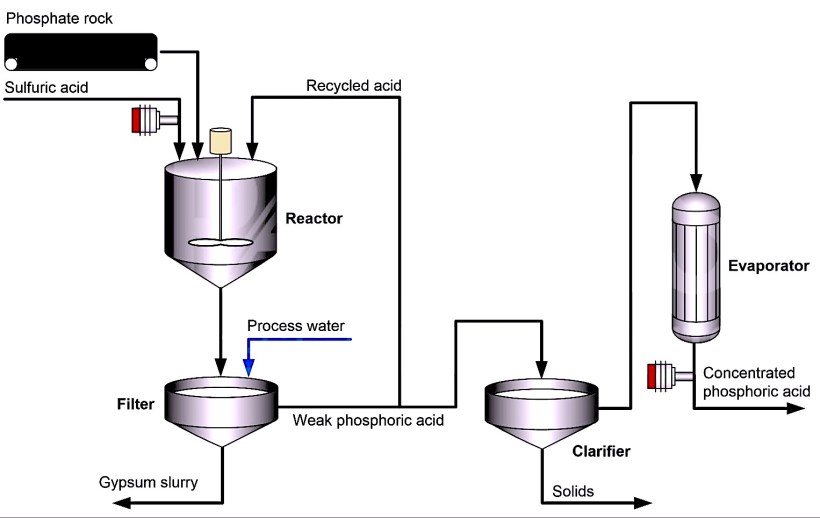
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.

В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
- Когда один протон удаляется, в результате образуется дигидрофосфат-Ион H 2 PO 4 −
- Когда два протона удаляются, в результате образуется Ион фосфата водорода HPO 4 2−
- Удаление всех трех протонов дает ортофосфат-Ион PO 4 3− .
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
- Трифосфат натрия используется в мыле и моющих средствах.
- Дикальцийфосфат используется в зубной пасте как полирующее средство.
- Фосфатное покрытие наносится на стальные детали для защиты от коррозии и смазки.
- Он используется для контроля pH косметических средств и средств личной гигиены.
- В строительной отрасли он используется для удаления минеральных отложений и чистых пятен от жесткой воды,
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Ортофосфорная кислота

Ортофосфорная кислота (фосфорная кислота) — неорганическая кислота средней силы с химической формулой H3PO4, которая при стандартных условиях представляет собой бесцветные гигроскопичные кристаллы. Обычно ортофосфорной (или просто фосфорной) кислотой называют 85 %-й водный раствор (бесцветная сиропообразная жидкость без запаха). Растворима в этаноле и других растворителях.
Содержание
- 1 Физические свойства
- 2 Химические свойства
- 3 Получение
- 3.1 Термический способ
- 3.2 Экстракционный способ
- 3.3 Концентрирование и очистка
- 3.4 Экономические и экологические аспекты
- 4 Применение
- 4.1 Авиационная промышленность
- 4.2 Пищевая промышленность
- 4.3 Сельское хозяйство
- 4.4 Стоматология
- 5 Безопасность

Физические свойства
В чистом виде фосфорная кислота представляет собой бесцветное кристаллическое вещество с температурой плавления 42,35 °С. Кристаллы имеют моноклинную сингонию. Твёрдая фосфорная кислота гигроскопична и расплывается на воздухе; она смешивается с водой во всех соотношениях, но коммерчески обычно доступна в трёх концентрациях:
Из 85 %-ой фосфорной кислоты можно получить безводную при испарении воды в вакууме при 80 °С. Из концентрированных растворов она осаждается в виде гемигидрата H3PO4·0,5H2O.
В твёрдом состоянии и концентрированных растворах между молекулами фосфорной кислоты существуют водородные связи. При снижении концентрации до 40-50 % более устойчивой является водородная связь между фосфат-анионами и молекулами воды. Также в растворах фосфорная кислота обменивается атомами кислорода с водой.
Химические свойства
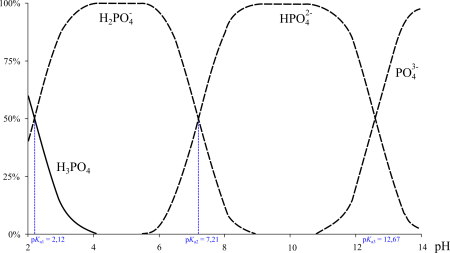
Фосфорная кислота — трёхосновная кислота средней силы. В водных растворах она подвергается диссоциации по трём ступеням c константами диссоциации K1 = 7,1⋅10 –3 (pKa1 2,12); K2 = 6,2⋅10 –8 (pKa2 7,20); K3 = 5,0⋅10 –13 (pKa3 12,32). Экзотермична только диссоциация по первой ступени; по второй и третьей ступени она эндотермична.
| H3PO4(aq) + H2O(l) ⇌ H3O(aq) + + H2PO4(aq) − |
| H2PO4(aq) − + H2O(l) ⇌ H3O(aq)+ + HPO4(aq) 2− |
| HPO4(aq) 2− + H2O(l) ⇌ H3O(aq) + + PO4(aq) 3− |
Как следствие, фосфорная кислота может образовывать как средние (фосфаты), так и кислые соли (гидрофосфаты и дигидрофосфаты). Однако при нормальных условиях она малоактивна и вступает в реакции только с карбонатами, гидроксидами и некоторыми металлами. Выше 80 °С фосфорная кислота реагирует также с неактивными оксидами, кремнезёмом и силикатами. Также фосфаты образуются в процессе фосфатирования, при помощи которого чёрные и цветные металлы покрывают защитной плёнкой для улучшения их характеристик.
Нагревание фосфорной кислоты приводит к отщеплению воды с образованием пирофосфорной кислоты и метафосфорной кислоты:
Отличительной реакцией ортофосфорной кислоты от других фосфорных кислот является реакция с нитратом серебра: при этом образуется жёлтый осадок, тогда как другие фосфорные кислоты дают белый осадок:
Качественной реакцией на ион H2PO4 − является образование ярко-жёлтого осадка молибденофосфата аммония:
H3PO4 + 12[NH4]2MoO4 + 21HNO3 → [NH4]3PMo12O40 ⋅ 6H2O↓ + 21NH4NO3 + 6H2O 
Получение
Впервые фосфорную кислоту из оксида фосфора(V) получил Роберт Бойль в 1694 году. Лабораторный метод получения заключается в окислении фосфора азотной кислотой:
Термический способ
В промышленности используют два основных способа получения фосфорной кислоты: термический и экстракционный. Термический способ заключается в сжигании фосфора до оксида фосфора(V) и реакции последнего с водой:
Технически этот процесс реализуется по-разному. В так называемом IG-процессе (от названия фирмы IG) обе реакции проводятся в одной реакционной колонне. Сверху в неё сжатым воздухом или паром под давлением 1,5 МПа через сопло подаётся фосфор, который сгорает при температуре >2000 °C. Полученный оксид фосфора(V) поглощается фосфорной кислотой, которая стекает сверху по стенкам колонны, целиком покрывая их. При этом она одновременно выполняет несколько функций: растворяет оксид фосфора(V), отводит теплоту из реакции сгорания и защищает стенки колонны от пламени. Полученная фосфорная кислота собирается под колонной, пропускается через теплообменник и подаётся в верхнюю часть колонны, откуда снова стекает по стенкам. Материалом для установки по получению фосфорной кислоты служит нержавеющая сталь с низким содержанием углерода. До 100 °C она устойчива к концентрированной фосфорной кислоте.
Получаемая этим способом фосфорная кислота практически не содержит примесей соединений фосфора в низших степенях окисления (содержание фосфористой кислоты H3PO3 составляет всего 0,1 %). Однако её необходимо очистить от примесного мышьяка, который в низких концентрациях содержится даже в очень чистом фосфоре. Эта очистка осуществляется воздействием сероводорода (для его получения в фосфорную кислоту вводят сульфид натрия) и осаждением сульфида мышьяка с последующим фильтрованием.
На этих реакциях основан также TVA-процесс (от Tennessee Valley Authority ), однако сжигание фосфора и поглощение оксида фосфора(V) проводится отдельно. Фосфор и воздух подаются в стальную камеру сгорания с внешним охлаждением, после чего продукты сгорания через верхнюю часть камеры подпадают в камеру поглощения, где и образуется фосфорная кислота. В Хёхст-процессе (от названия фирмы Hoechst) сгорание и поглощение проводятся отдельно, однако он отличается тем, что теплота сгорания фосфора там используется для генерирования пара.
Экстракционный способ
Экстракционный способ производства фосфорной кислоты заключается в обработке природных фосфатов неорганическими кислотами (в странах СНГ преимущественно хибинского апатитового концентрата и фосфоритов Каратау). Фосфаты обрабатывали серной кислотой ещё в середине 1880-х гг., однако развитие этой области началось после Второй мировой войны благодаря повышенному спросу на минеральные удобрения.
Разложение сырья происходит по следующей схеме (x от 0,1 до 2,2):
Побочным продуктом этой реакции является сульфат кальция, который в зависимости от температуры и концентрации фосфорной кислоты может выпадать в виде дигидрата (CaSO4·2H2O) или гемигидрата (CaSO4·0,5H2O). По этому признаку экстракционные процессы получения фосфорной кислоты делят на дигидратные, гемигидратные и комбинированные (дигидратно-гемигидратный и гемигидратно-дигидратный). Существует также ангидритный метод (с осаждением безводного сульфата кальция), который, однако, в промышленности не используется, так как он связан с серьёзными коррозионными проблемами.
Дигидратный процесс является классическим методом получения фосфорной кислоты. Его преимущества заключаются в относительно низкой температуре, благодаря чему удаётся избежать коррозии. Кроме того, можно использовать различное фосфатное сырьё и перерабатывать его в больших количествах. Для начала сырьё измельчают до размера частиц меньше 150 мкм. Фосфат и серная кислота подаются в реактор по отдельности, чтобы образование слоя сульфата кальция на частицах не затрудняло дальнейшего разложения. Температура процесса составляет 70-80 °С, а концентрация фосфорной кислоты в системе равна 28-31 % в пересчёте на P2O5. В этих условиях сульфат кальция образуется в виде дигидрата. Недостатком метода является то, что исходное сырьё необходимо перемалывать, а полученную фосфорную кислоту дополнительно концентрировать до 40-55 % и даже до 70 % P2O5.
Гемигидратный процесс был разработан для того, чтобы избежать необходимости концентрирования полученной фосфорной кислоты. Он проводится при более высокой температуре (80-100 °С) — в условиях, когда более устойчивой формой является гемигидрат сульфата кальция. Фосфорная кислота при этом получается в концентрации 40-48 %. Гемигидратно-дигидратный процесс разработан в Японии в связи с тем, что он позволяет получать практически чистый гипс, залежи которого в этой стране отсутствуют. Обработка сырья ведётся при высокой температуре, и образуется гемигидрат сульфата кальция, однако затем его перекристаллизовывают в дигидрат.
Концентрирование и очистка
Для концентрирования фосфорной кислоты, полученной дигидратным процессом, используют вакуумное испарение, хотя на старых заводах до сих пор применяют погружное горение. Иногда используют последовательно несколько испарителей, так что пары с одного испарителя используются для нагрева раствора в следующем испарителе. Кроме того, при испарении воды из фосфорной кислоты также удаляется фтор в виде смеси SiF4 и HF. Так, при повышении концентрации фосфорной кислоты с 30 до 50 % P2O5 из неё удаляется 50-60 % фтора. Поскольку выбросы фтора регулируются законами, эти вещества направляют на производство кремнефтористоводородной кислоты H2SiF6.
Разнообразные неорганические примеси удаляют осаждением и экстракцией. Осаждать необходимо примеси мышьяка (в виде сульфида мышьяка), кадмия (в виде комплекса с эфирами дитиофосфорной кислоты), а также примеси катионных металлов (обработкой гидроксидом натрия). Экстракция основана на переводе фосфорной кислоты в органическую фазу и промывках водой, разбавленной фосфорной кислотой и растворами фосфатов. При этом удаляются как катионные, так и анионные примеси. Сама фосфорная кислота отделяется от растворителя перегонкой. В качестве растворителей используют бутанол-1, амиловый спирт, метилизобутилкетон, трибутилфосфат, диизопропиловый эфир и др.
Экономические и экологические аспекты
Мировая потребность в фосфорной кислоте по состоянию на 1989 г. оценивается в 40,6 млн тонн в год в пересчёте на P2O5. Экстракционный способ производства является преобладающим (95 % от общего количества), поскольку он потребляет меньше энергии. Остальные 5 % производятся термическим способом. Основным производителем (и потребителем) экстракционной фосфорной кислоты являются США: их доля от общего производства фосфорной кислоты составляет 90 %.
В 1980-е гг. произошло сокращение производства фосфорной кислоты из-за отказа от фосфорсодержащих детергентов и минеральных удобрений. Это было связано с загрязнением фосфатными удобрениями грунтовых вод и эвтрофикацией водоёмов.
Экстракционное производство фосфорной кислоты связано с образованием отвалов сульфата кальция: на 1 т P2O5 производится 4,5-5,5 т загрязнённого сульфата кальция, который необходимо утилизировать. По состоянию на 2008 год существует три варианта:
- затопление в водоёмах (10 %);
- сваливание на суше (около 88 %);
- использование в качестве сырья.
При затоплении в водоёмах сульфат кальция быстро растворяется: его растворимость в морской воде составляет 3,5 г/л, а природное содержание — 1,6 г/л. Примеси оксида кремния и оксида алюминия остаются нерастворёнными. Загрязнение воды тяжёлыми металлами мало по сравнению с существующими концентрациями, однако загрязнение кадмием значительно.

Применение
Используется при пайке в качестве флюса (по окисленной меди, по чёрному металлу, по нержавеющей стали), для исследований в области молекулярной биологии. Применяется также для очищения от ржавчины металлических поверхностей. Образует на обработанной поверхности защитную плёнку, предотвращая дальнейшую коррозию. Также применяется в составе фреонов, в промышленных морозильных установках как связующее вещество.
Авиационная промышленность
В авиационной промышленности ортофосфорная кислота используется в составе гидрожидкости НГЖ-5У и её иностранных аналогов.
Пищевая промышленность
Ортофосфорная кислота зарегистрирована в качестве пищевой добавки E338. Применяется как регулятор кислотности в газированных напитках, например в Кока-Коле. По вкусу подслащённые слабые водные растворы ортофосфорной кислоты напоминают крыжовник.
Сельское хозяйство
В звероводстве (в частности, при выращивании норок) используют выпойку раствора ортофосфорной кислоты для профилактики повышенного pH желудка и мочекаменной болезни.
Также ее применяют в гидропонных системах для регулировки уровня pH питательного раствора.
Стоматология
Ортофосфорная кислота применяется для протравливания (снятия смазанного слоя) эмали и дентина перед пломбированием зубов. При применении адгезивных материалов 2-го и 3-го поколений требуется протравливание эмали зуба кислотой с последующим промыванием и просушиванием. Кроме дополнительных временных затрат на проведение, данные этапы несут в себе опасность возникновения различных ошибок и осложнений.
При нанесении ортофосфорной кислоты сложно проконтролировать степень и глубину деминерализации дентина и эмали. Это приводит к тому, что нанесённый адгезив не полностью (не по всей глубине) заполняет открытые дентинные канальцы, а это в свою очередь не обеспечивает образование полноценного гибридного слоя.
Кроме того, не всегда удаётся полностью удалить ортофосфорную кислоту после её нанесения на дентин. Это зависит от того, каким способом сгущена фосфорная кислота. Остатки ортофосфорной кислоты ухудшают прочность связывания, а также приводят к образованию так называемой «кислотной мины».
С появлением адгезивных материалов 4-го и 5-го поколений стали использовать технику тотального протравливания (дентин — эмаль). В адгезивных системах 6-го и 7-го поколений отдельный этап протравливания кислотой отсутствует, так как адгезивы являются самопротравливающимися. Однако некоторые производители всё же рекомендуют для усиления адгезии кратковременно протравливать эмаль даже при использовании самопротравливающих адгезивов.

Безопасность
Фосфорная кислота не оказывает специфического токсического действия. Системная токсичность низкая. Её растворы раздражают глаза, дыхательные пути и слизистые оболочки. При концентрации > 10 % она оказывает раздражающее действие, а выше 25 % — также коррозионное. При глотании большого количества возникает тошнота, рвота, диарея, кровавая рвота и гиповолемический шок. Концентрированные растворы вызывают ожоги слизистой оболочки рта, пищевода и желудка. При попадании рекомендуется промыть кожу или промыть глаза тёплой водой или физиологическим раствором. При глотании фосфорной кислоты в качестве первой помощи необходимо поддерживать дыхание и внутривенно восполнять жидкость.
У добровольцев, получавших фосфорную кислоту перорально в количестве 2-4 г/кг в день в течение 10 дней или 3,9 г/кг в день в течение 14 дней, не обнаружено негативных для метаболизма последствий. Допускается использовать 0,5–1 г/л фосфорной кислоты в напитках.
Фосфорная кислота — формула, характеристика и свойства химического вещества
Почитатели «Кока-колы» редко задумываются, что за живительный вкус любимого напитка отвечает, среди прочих компонентов, пищевая добавка E338, наносящая вред костным тканям и зубной эмали. Под этим названием скрывается фосфорная кислота, формула которой известна всем, кто бывал на уроках химии в восьмом классе. Другие области применения вещества — машиностроение и сельское хозяйство, производство удобрений и красок, авиация и стоматология.

Физические свойства
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:

| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 1,633 | |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO4 3- и молекулами воды H2O.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.

При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Основные способы получения

Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:

При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:

Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.

Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.

Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.

Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Применение ортофосфорной кислоты

- Характеристики
- Сферы применения
- Правила работы
- Применение от ржавчины
- Применение для металла
Нередко металл и изделия из него подвергаются характерной «болезни», которая проявляется в виде рыжего налета, разъедающего металл. Речь идет о ржавчине. Ее образование происходит благодаря воздействию на поверхность металлического изделия углекислого газа, кислорода и воды. Безусловно, для того чтобы продлить срок службы изделия из металла необходимо как можно скорее начать борьбу с коррозией. Помочь в этом может обработка ортофосфорной кислотой.
Характеристики ортофосфорной кислоты
 Услышав слово кислота, человек невольно напрягается, ведь еще из давних уроков химии в школьные годы известно, что кислота может оказывать довольно значимое влияние на предметы или, к примеру, кожу человека. А что собой представляет ортофосфорная кислота? Опасна ли ортофосфорная кислота, применение которой рекомендуется как один из способов борьбы с налетом ржавчины?
Услышав слово кислота, человек невольно напрягается, ведь еще из давних уроков химии в школьные годы известно, что кислота может оказывать довольно значимое влияние на предметы или, к примеру, кожу человека. А что собой представляет ортофосфорная кислота? Опасна ли ортофосфорная кислота, применение которой рекомендуется как один из способов борьбы с налетом ржавчины?
Ортофосфорная или попросту фосфорная кислота представляется в виде продукта, имеющего неорганическое происхождение. В условиях нормальной комнатной температуры ортофосфорная кислота имеет вид небольших ромбовидных кристалликов.
Чаще всего же ортофосфорная кислота имеет вид сиропообразного 85%-процентного раствора, не имеющего характерного запаха. Кристаллики ортофосфорной кислоты довольно хорошо растворяются в воде или этаноле.
Уравнение ортофосфорной кислоты
Применяется ортофосфорная кислота в следующих отраслях человеческой деятельности:
- Создание удобрений (фосфатных),
- Производство специальных чистящих средств, относящихся к классу бытовой химии,
- Стоматология,
- Вещества для борьбы с коррозией металла,
- Звероводство,
- Пищевая промышленность.
Если температура окружающей среды, например, в условиях лабораторных исследований превышает показатели в 213 градусов Цельсия, ортофосфорная кислота преобразуется в пирофосфорную кислоту. Состав ортофосфорной кислоты и ее химическая формула, соответственно, изменяется.
Таблица 1. Физико-химические показатели ортофосфорной кислоты согласно ГОСТ 10678-76.
| Наименование показателя | Норма | ||
|---|---|---|---|
| Марка А | Марка Б | ||
| 1-й сорт | 2-й сорт | ||
| 1. Внешний вид | Бесцветная жидкость прозрачная в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или со слабо-желтым оттенком жидкость в слое 15-20 мм при рассмотрении на белом фоне | Бесцветная или окрашенная жидкость с оттенком от слабо-желтого до коричневого, не прозрачная в слое 15-20 мм при рассмотрении на белом фоне |
| 2. Массовая доля ортофосфорной кислоты (H3PO4), %, не менее | 73 | 73 | 73 |
| 3. Массовая доля хлоридов, %, не более | 0,005 | 0,01 | 0,02 |
| 4. Массовая доля сульфатов, %, не более | 0,010 | 0,015 | 0,020 |
| 5. Массовая доля нитратов, %, не более | 0,0003 | 0,0005 | 0,0010 |
| 6. Массовая доля железа, %, не более | 0,005 | 0,010 | 0,015 |
| 7. Массовая доля тяжелых металлов сероводородной группы, %, не более | 0,0005 | 0,002 | 0,005 |
| 8. Массовая доля мышьяка, %, не более | 0,0001 | 0,006 | 0,008 |
| 9. Массовая доля восстанавливающих веществ, %, не более | 0,1 | 0,2 | Не нормируется |
| 10. Наличие метафосфорной кислоты | Выдерживает испытание | ||
| 11. Массовая доля взвешенных частиц, %, не более | Выдерживает испытание | 0,3 | |
| 12. Наличие желтого фосфора | Выдерживает испытание | Не нормируется | |
Таблица 2. Физико-химические показатели ортофосфорной кислоты согласно ГОСТ 6552-80.
1. Внешний вид и цвет
2. Массовая доля ортофосфорной кислоты (H3PO4), %, не менее
3. Плотность Р4 20 , г/см 3 , не менее
4. Массовая доля остатка после прокаливания, %, не более
5. Массовая доля летучих кислот (СН3СООН), %, не более
6. Массовая доля нитратов (NO3), %, не более
7. Массовая доля сульфатов (SO4), %, не более
8. Массовая доля хлоридов, (Cl)%, не более
9. Массовая доля аммонийных солей (NН4), %, не более
10. Массовая доля железа (Fe), %, не более
11. Массовая доля мышьяка (As), %, не более
12. Массовая доля тяжелых металлов (Pb), %, не более
13. Массовая доля веществ, восстанавливающих KMnO4 (H3PO3), %, не более
Сферы применения фосфорной кислоты
 Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты.
Современная наука довольно часто позволяет использовать одно и то же химическое вещество или один и тот же химический состав в совершенно различных целях. То же самое можно сказать и о вариантах применения ортофосфорной кислоты.
На сегодняшний день, существует немалое количество разнообразных сфер применения ортофосфорной кислоты. Так, к примеру, данную кислоту могут применять при органическом синтезе. Применяют ее в случаях, когда требуется создать фосфорные соли натрия, кальция, алюминия, марганца.
Велико значение и использование ортофосфорной кислоты в промышленности по металлобработке, поскольку тут практически незаменима ортофосфорная кислота, влияние которой доказано при удалении ржавчины или предотвращении ее появления.
Ортофосфорную кислоту можно обнаружить и в составе большого количества веществ, предназначенных для использования хозяйками в быту. Известно и об ее использовании в медицинской и пищевой промышленности.
Среди прочих сфер, где можно обнаружить применение ортофосфорной кислоты, можно назвать:
- Нефтяную промышленность,
- Изготовление спичек,
- Изготовление кинопленки,
- Производство противопожарных или огнеупорных предметов и материалов.
Велика роль ортофосфорной кислоты и в процессе подпитки растений, поскольку широко известно, благотворное влияние фосфора на способность растений давать высокие урожаи. Сельскохозяйственные культуры благодаря этой кислоте приобретают устойчивость к заморозкам и прочим неблагоприятным условиям.
Благотворное воздействие на почву также отмечается во многих источниках, относящихся к предмету земледелия или народного хозяйства.
Значение ортофосфорной кислоты важно и для животных. Она не только совместно с другими органическими веществами участвует в метаболических процессах животного организма, но еще и помогает в образовании у некоторых видов животных панцирей и других естественных наростов, поскольку в их составе имеется фосфат кальция.
Применяется ортофосфорная кислота и в виде пищевой добавки в некоторых продуктах питания. Она имеет код Е 338. Свое назначение в пищевой промышленности данная кислота находит в производстве колбас, некоторых видов плавленых сыров, газированных напитков.
Следует отметить, что не стоит злоупотреблять продуктами питания, в составе которых отмечено присутствие ортофосфорной кислоты, поскольку не выяснено какова норма потребления ее человеком в сутки. Но в любом случае польза от ее потребления несоизмеримо мала, если даже не сказать, ничтожна, в сравнении с тем вредом, который она может нанести в виде нарушения работы желудочно-кишечного тракта, возникновения кариеса, развития остеопороза.
Правила работы с ортофосфорной кислотой
 Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами.
Как и любая другая кислота, ортофосфорная требует от человека предельной внимательности, аккуратности и выполнения всех правил безопасности при работе с кислотами.
Ортофосфорная кислота является довольно агрессивным химическим веществом при неправильном ее использовании и пренебрежение техникой безопасности применение ортофосфорного соединения может вызвать возникновение ожогов на кожных покровах. Пары фосфорной кислоты, могут спровоцировать ожоги слизистой дыхательных путей, а также проявление признаков серьезной интоксикации организма человека. Помимо этого, ортофосфорная кислота является пожаро- и взрывоопасным соединением. Именно поэтому весьма важно соблюдать предписанные правила при работе с фосфорной кислотой.
Правила работы с ортофосфорной кислотой.
- Работать с кислотой нужно только в условиях хорошо проветриваемого помещения.
- При работе с кислотой, следует особое внимание уделить защитной экипировке в виде перчаток, маски или лучше респиратора и очков для защиты глаз.
- Не допускать попадания кислоты на открытые участки тела, иначе могут возникнуть сильнейшие ожоги.
- Если кислота, все же, попала на кожу, ее следует как можно скорее смыть большим количеством проточной воды и обязательно обратиться в больницу.
Транспортировка и хранение ортофосфорной кислоты также требует обязательного соблюдения определенных условий.
Хранить кислоту можно только в стеклянных емкостях, а также в полимерных сосудах и сосудах из нержавеющей стали.
Перевозить реагент разрешается только специальными автотранспортными средствами, которые оснащены металлическими цистернами, не подвергающимися воздействию кислоты. Транспортировка допускается также и другими видами транспорта, например, поездами или водными судами, но при условии полного соблюдения требований техники безопасности.
Условия хранения кислоты предусматривают ее помещение в такое место, куда не проникает солнечный свет. Хранить в таких условиях ортофосфорное соединение можно не более одного года.
Применение от ржавчины ортофосфорной кислоты
 Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности.
Ортофосфорная кислота, влияние которой на ржавчину широко известно, может применяться как в промышленных масштабах, так и для удаления коррозии металла в домашних условиях. Разумеется, что подобные действия должны проводиться с учетом описанных выше правил безопасности.
Явным преимуществом именно фосфорной кислоты является то, что при условиях химической очистки с поверхности металла при помощи фосфорной кислоты можно не только убрать рыхлые окислившиеся массы, но и создать тем самым небольшую защитную пленку на поверхности металлического изделия. Образование такой пленки происходит следующим образом: оксид железа разъедается и поглощается кислотой, вместо этого происходит фосфарирование поверхности металла. Люди, проделывающие подобную процедуру очищения, свидетельствуют о том, что после снятии ржавчины посредством применения кислоты ортофосфорной на поверхности металлического изделия образуется маслянистая пленка серого оттенка.
На данном этапе можно назвать несколько основных способов борьбы с образованием окислов на металлических поверхностях:
- Травление металла, предусматривающее полное его погружение в раствор кислоты,
- Распыление соединения при помощи пульверизатора или нанесение ее посредством валика,
- Механическая очистка металла от окислов с последующим применением кислоты.
Наиболее подходящий и действенный метод очистки металла от коррозии подбирается в каждом конкретном случае с учетом индивидуальных условий, в которых возможно проведение процедуры.
Ортофосфорная кислота для металла
 Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.
Учитывая, что существует несколько вариантов очищения металла с применением ортофосфорного соединения, следует рассмотреть каждый из них подробнее.
Очищение с полным погружением очищаемой детали, к примеру, требует предварительного очищения детали от жиров любого происхождения. Для этого достаточно промыть металлическое изделие при помощи любого моющего средства. Далее нужно растворить в одном литре воды 150 мл кислоты. После того, как раствор будет готов нужно опустить в него деталь на один час. При этом требуется постоянно размешивать раствор, чтобы кислота лучше действовала.
После того, как кислота оказала свое действие, и ржавчина растворилась, необходимо смыть ортофосфорную кислоту при помощи специального раствора, составе которого имеется 50 частей воды, 2 части нашатырного спирта, 48 частей спирта.
Окончанием процедуры станет ополаскивание детали проточной водой и сушка.
Если металлическое изделие по причине его больших размеров нельзя погрузить в контейнер, то тут можно применить другой способ удаления ржавчины. Для этого нужно нанести ортофосфорную кислоту при помощи распылителя, валика или обычной кисти на поверхность металла. В некоторых случаях, возможно, потребуется предварительная ручная очистка ржавчины. После того, как часть ржавчины буквально отодрана с поверхности металлического изделия, на металл наносится раствор кислоты, выдерживается определенное время, после чего изделие омывается нейтрализующим кислоты раствором и производится его сушка.
В обоих случаях при необходимости можно увеличивать период воздействия кислоты на окислы металла.
Возможно применение ортофосфорной кислоты и при необходимости очистки домашних унитазов, ванн и раковин. Но следует запомнить, что не стоит применять ортофосфорную кислоту, как и другие виды кислот для очищения акриловых сантехнических элементов.
Фаянсовые и эмалированные поверхности можно очистить следующим способом. Предварительно обезжиренную любым моющим средством поверхность обрабатывают кислотным раствором. Для его приготовления нужно взять и перемещать 1 литр воды с 200 гр фосфорной кислоты. В зависимости от степени загрязнения кислоту нужно оставить на поверхности на 1-12 часов. По истечении времени кислоту нужно нейтрализовать раствором соды и смыть.
материалы по теме

Завод «Пигмент» увеличивает объемы выпуска акриловых эмульсий и сульфаминовой кислоты
На протяжении трех кварталов нынешнего года на модернизацию техпроцессов и оснащения ПАО «Пигмент» (Тамбов) потратил более 366 млн рублей. Проекты по наращиванию мощности реализуются в производствах акриловых эмульсий и сульфаминовой кислоты. В цехах по производству пигментов, отбеливателей и полуфабрикатных лаков проводятся работы по улучшению качественных характеристик материалов, применяются новые технологии.

В Кургане начнут выпускать емкости для транспортировки соляной кислоты
В ходе реализации планов по импортозамещению на производственных площадках завода «Курганхиммаш» впервые в нашем государстве выпущена партия офшорных танк-контейнеров. Тара изготавливается из нержавеющей стали толщиной 6 мм, внутренняя поверхность которых покрыта особым материалом для защиты от действия агрессивных сред. Данные емкости позволяют хранить и транспортировать соляную кислоту под давлением не выше 0,4 МПа при температурах окружающей среды от –40 до +500 °С.

Применение лакокрасочных материалов
Применение ЛКМ обусловлено различными требованиями. Но наиболее распространенные – это для декоративной отделки и для защиты различных материалов от неблагоприятных воздействий для сохранения их долговечности.


