Нефть: свойства, способы добычи и переработки

Нефть – природное ископаемое топливо, представляющее собой маслянистую жидкость мутно-жёлтого или светло-коричневого – вплоть до чёрного цветов, обладающую специфическим запахом. Вследствие содержания в составе значительного количества разнообразных углеводородов, это естественное сырьё стало занимать лидирующее положение среди других энергетических ресурсов.
- Методы добычи
- Первичный
- Вторичный
- Третичный
- Процессы переработки
- Первичные
- Вторичные
- Хранение и транспортировка
- Продукты переработки
- Топливо
- Пластик
- Синтетические ткани
- Каучук
- Пищевой блок
- Применение в медицине и косметике
- Месторождения в России и мире
- Мировые запасы
- Страны, добывающие нефть
Важнейшим достоинством нефти является возможность выделять при сгорании значительное количество тепловой энергии. Именно это качество, а также возможность транспортировки на значительные расстояния, превратили её в чёрное золото – самый востребованный энергоресурс планетарного масштаба. Кроме того, этот вид минерального сырья является основой нефтехимической отрасли, позволяющей получать широкий спектр веществ, столь необходимых для многих отраслей промышленности, энергетики и транспорта.
Методы добычи
Основные залежи нефти присутствуют в подземных месторождениях, представляющих собой пустоты, расположенные на глубине, не превышающей 3-х км. Чтобы её извлечь, строятся скважины, позволяющие с помощью шахт достичь необходимой отметки залегания.
Не вдаваясь во все технологические тонкости, методы добычи нефти в зависимости: от уровня давления внутри пласта, способа его обеспечения и технологии извлечения, подразделяются на три вида.
Первичный
Нефтесодержащая жидкость покидает своё место пребывания (коллектор нефтяной залежи) в результате воздействия естественных сил природы. Обычно её место занимает вода или газы. Если существующего давления не достаточно для самостоятельного выхода нефти (фонтанирования), то подключается специальные насосы. При таком методе добычи нефтеотдача скважины, как правило, не превышает 15%.
Вторичный
После исчерпания возможностей первичного метода нефтедобычи, на смену ему приходит вторичный метод, суть которого заключается в искусственном нагнетании давления внутрь залежи. Осуществляется это с помощью закачивания в пласт воды из близлежащих пресных водоёмов или газов естественного происхождения (воздух и продукты его разделения, попутный или природный газ). Подобные технологические решения увеличивают нефтеотдачу до 30%.
Третичный
Следующим этапом увеличения добычи нефти, позволяющим повысить продуктивность до 45%, является третичный метод. В основу, которого положены воздействия, повышающие энергетический уровень залегающего природного ресурса. Легко догадаться, что это, прежде всего повышение температуры, приводящее к увеличению, столь необходимого для извлечения нефти физического параметра – давления.
Но именно третичный метод, взятый на вооружение нефтяниками III-го тысячелетия, позволил обеспечить мировую экономику миллионами баррелей нефти.
Процессы переработки
Полученная в результате добычи нефть мало используется в чистом виде. Гораздо больший интерес представляют продукты её переработки – разнообразные виды топлива, а также исходные материалы для химической промышленности.
Первичные
Поступающее по трубопроводам или по железной дороге, а также транспортируемое водным путём с помощью танкеров сырьё, подвергается очистке и разделяется на фракции на нефтеперерабатывающих заводах. В этом и заключается суть первичной переработки.

Подготовка нефти
Доставленная на предприятия нефть содержит в своём составе примеси: газ, воду, твёрдые частицы, от которых необходимо избавиться. На этапе подготовки она подвергается:
- очистке от примесей механического происхождения,
- освобождению от углеводородов пониженной плотности (обычно – газообразных),
- обезвоживанию совместно с электрообессоливанием.
Атмосферная перегонка
Очищенная нефть поступает в цилиндрическую вертикальную (ректификационную) колонну, где подвергается воздействию пара, движущегося снизу вверх. В результате нагрева, доходящего до температуры достигающей 400 0 С, она разделяется на фракции:
- бензиновую,
- керосиновую,
- дизельную,
- жидкий мазут.
Вакуумная дистилляция
Вакуум-дистилляция применяется для выделения из мазута масляных дистиллятов и вакуумного газойля. Продукции, необходимой для выпуска топлива, масел, парафина и целого ряда продуктов нефтепереработки и нефтехимии. Оставшаяся тяжёлая фракция представляет собой гудрон, служащий для производства таких строительных материалов как битум и мазут.
Вторичные
Так как продукция первичной переработки нефти не отличается необходимыми товарными свойствами, то для улучшения качества её подвергают вторичной переработке.
Риформинг
Процесс каталитического риформинга, в основе которого лежит просачивание жидкости сквозь слой платинового катализатора, предназначен для получения высокооктанового бензина и ароматических углеводородов.
Гидроочистка
Этот технологический процесс предназначен для снижения количества примесей под воздействием водорода. При этом уменьшается количество смол, асфальтенов, а также веществ, имеющих в своём составе большое количество кислорода.
Каталитический крекинг
Каталитический крекинг – один из основных процессов вторичной переработки нефти, имеющий целью: повышение октанового числа бензина, получение углеводородных газов и кокса. Суть его заключается в получении мелких молекул из более крупных соединений с помощью нагрева и применения катализатора.
Гидрокрекинг
Для получения дизельного топлива и одного из компонентов автомобильного бензина – бензина гидрокрекинга, осуществляется расщепление средней фракции вакуумной дистилляции (газойля) в присутствии значительного количества водорода.
Коксование
Процесс бескислородного нагрева тяжёлых нефтяных фракций остатков вторичной переработки носит название «коксование». Целью его является получения нефтяного кокса – продукта, имеющего высокую стойкость против воздействия коррозии.
Изомеризация
Получение изомерного углеводородного сырья для нефтехимии и ряда компонентов бензина не может обойтись без изомеризации – изменения молекулярной структуры вещества с сохранением его качественных и количественных параметров.
Алкилирование
Цель повышения октанового числа бензина заставила технологов разработать данный процесс использования малоценных крекинговых продуктов в качестве важных компонентов бензина. Суть его заключена в молекулярном воздействии на исходный материал с помощью алкилов – частиц предельных углеводородов.
Хранение и транспортировка
Для хранения нефти применяют специальные вертикальные резервуары надземного и подземного типов. Как правило, современные хранилища представляют собой хорошо организованные структуры – нефтебазы, предназначенные для приёмки и распределения нефти.
Транспортировка голубого топлива осуществляется с помощью:
- Нефтеналивных танкеров – судов ёмкостью до 30 000 тонн, перевозящих этот жидкий вид энергоресурса по морям и рекам.
- Нефтепроводов, позволяющих перемещать огромные объёмы нефти на значительные расстояния с минимумом затрат подземным способом.
- Железнодорожных цистерн, доставляющих нефть в незначительных объёмах в отдалённые местности.
Автомобильный вид транспорта экономически не выгоден для доставки сырой нефти, поэтому его используют для перевозки готовых нефтепродуктов конечным потребителям.
Продукты переработки
Уникальность нефти заключается в том, что из неё посредством переработки получают продукцию, задействованную во всех отраслях народного хозяйства: от промышленности – до повседневного быта.
Топливо
Нефтяные топлива подразделятся на группы, основными из которых являются:
- авиационный и автомобильный бензин,
- дизельное топливо,
- мазут,
- керосин.
Они находят своё применение на транспорте и в энергетике.
Пластик
Пластмассы – одно из выдающихся изобретений учёных 20-го века. Эти высокомолекулярные соединения, благодаря своим свойствам: лёгкости, устойчивости к влаге и ряду агрессивных жидкостей, а также низкой тепло- и электропроводности, наряду с физиологической безвредностью для человеческого организма, широко используются в качестве сырья для изготовления ёмкостей, изоляционных материалов и даже предметов мебели.
Производство столь необходимого материала, каким сегодня является пластик, доходит до 200 млн. т в год.
Синтетические ткани
Широчайший спектр современных тканей, к которым относятся: полиэстер (лавсан), холлофайбер, акрил, капрон, нейлон, стрейч-ткани, а также искусственный мех и искусственная кожа, – являются продукцией нефтепереработки. Кроме чисто бытового назначения, обусловленного прочностью, эластичностью, стойкостью и практичностью этих материалов, синтетика находит использование в авиации, строительстве и сельском хозяйстве.
Каучук
Синтетические полимеры, обладающие эластичностью, вязкостью, водоотталкивающими и диэлектрическими свойствами, получили распространение благодаря изготавливаемой из них продукции: резины и эбонита. Если первые можно встретить в качестве шин для автомобилей, самолётов и велосипедов, то вторые незаменимы в качестве электроизоляционных материалов.
Пищевой блок
Проблема недостатка пищевых продуктов с каждым днём всё острее стоит перед человечеством. Вполне возможно, что на смену натуральным вскоре придут синтезированные из нефти продукты питания. Современная пищевая индустрия активно выдвигает на рынок: искусственную икру, жевательную резинку, ванилин, красители и концентраты. Естественно, что все они являются продукцией нефтепереработки.

Применение в медицине и косметике
Производные нефти уже давно заняли своё место на прилавках аптек в качестве средств от аллергии, головной боли, повышенной температуры, инфекций и стресса. Не говоря уже о множестве ёмкостей, используемых в чисто медицинских целях, можно отдельно отметить перспективы создания целого класса пластмассовых протезов, изготовленных при помощи 3D-моделирования.
Ещё одно направление использования нефтепродуктов заключается в том, что современные представительницы прекрасного пола не обходятся без целого набора косметических средств нефтяного происхождения. Это лаки, тени, карандаши, красители, бижутерия и парфюм. Стандартного набора средств, являющихся отличным дополнением к одежде, обуви и галантерее, также изготовленных на основе нефти.
Понятно, что столь широкий спектр употребления продуктов нефтепереработки требует открытия всё новых и новых месторождений.
Месторождения в России и мире
Россия занимает восьмое место в мире по запасам нефти. Крупнейшие месторождения расположены в Западной Сибири, на территории республик Башкортостан и Татарстан, а также на Кавказе, в Красноярском крае, Астраханской области и острове Сахалин.
Мировые нефтяные месторождения географически распределены следующим образом:
- Ближний Восток – 67%.
- Латинская Америка – 8%.
- Западная Африка – 7%.
- Россия и Средняя Азия – 6%.
- Северная Америка – 5%.
- Западная Европа – 3%.
- Юго-Восточная Азия – 3%.
Мировые запасы
Согласно последним данным февраля 2020 года, лидерами по запасам нефти являются:
- Венесуэла – 16,9% общемировых запасов, что составляет 300,878 млрд. баррелей.
- Саудовская Аравия – 16,7% =” 297,7 млрд. баррелей.
- Иран – 11,9% =” 211,6 млрд. баррелей.
- Канада – 9,5% =” 169,709 млрд. баррелей.
- Ирак – 8% =” 142,503 млрд. баррелей.
- ОАЭ – 5,9% =” 105,8 млрд. баррелей.
- Кувейт – 5,7% =” 101,5 млрд. баррелей.
- Россия – 4,5% =” 80,0 млрд. баррелей.
Необходимо отметить, что эти данные постоянно уточняются, благодаря геологоразведке. Также имеются огромные залежи углеводородов на дне Мирового океана.
Страны, добывающие нефть
Вследствие целого ряда экономических, политических и исторических причин, перечень государств, занимающих первые строчки рейтингов по уровню нефтедобычи, несколько отличаются от списка стран, располагающих значительными запасами этого вида природного топлива.
Список стран-лидеров по уровню добычи нефти:
- США – 18,7% =” 15,043 млн. баррелей/сутки.
- Саудовская Аравия – 14,9% =” 12,0 млн. баррелей/сутки.
- Россия – 13,4% =” 10,8 млн. баррелей/сутки.
- Ирак – 5,5% =” 4,452 млн. баррелей/сутки.
- Иран – 5,0% =” 3,991 млн. баррелей/сутки.
Вполне очевидно что, несмотря на ограниченные запасы (хотя, точный уровень этих запасов очень трудно оценить даже приблизительно), нефть ещё достаточно долгое время сохранит свои лидирующие позиции в качестве основного природного энергоресурса мировой экономики.
Нефть Что такое, описание, как добывают, запасы, сорта, фото и видео
Нефть – самое популярное сырье, которым торгуют в розницу, оптом, на биржах и даже впрок. Человечество нашло ей применение практически в каждой сфере жизнедеятельности. Она используется в промышленности, при изготовлении товаров народного потребления, бытовых предметов, в косметологической и медицинской области, из нее делают одежду и даже детские игрушки.
Что такое нефть
Нефть – это полезное ископаемое маслянистой консистенции. Жидкость горюча, зачастую черного цвета, хотя также может быть вишневой, коричневой, желтой, зеленой и в некоторых случаях прозрачной. С точки зрения химии является сложной смесью, состоящей из углеводородов, серы, водорода с добавлением различных соединений. Запах отличается с учетом наличия в составе ароматических веществ.
Гипотезы происхождения
Существует несколько теорий. Представители органической утверждают, что нефть появилась в осадочных породах коры вследствие трансформации остатков растительных и животных организмов, которые населяли древние океаны.
Приверженцы неорганической гипотезы считают, что она образовалась в мантии при синтезе водорода и углерода под действием повышенного давления и температуры. Есть даже космическая теория, подтверждающая это. Она базируется на последних научных достижениях в сфере планетарной космогонии.
Изучение спектров планет доказало, что в атмосфере Юпитера находятся соединения водорода и углерода. Во всех метеоритах найдены простейшие органические соединения, с помощью экстрагирования определены битумы, где выявлены глюкоза, аминокислоты ароматического и алифатического характера.
С учетом этой информации российский ученый В.Д. Соколов создал теорию, по которой углеводороды появились на первых высокотемпературных этапах существования планеты, на стадии ее «горячего развития» за счет синтеза водорода и углерода.
В 1957 году другой исследователь В.Б. Порфирьев представил обновленную гипотезу космической теории. По его понятиям, углеводороды, которые существовали в первозданном веществе, в процессе остывания Земли и ее формирования впитывались магмой и через время, выходя по трещинам, осаждались в верхних слоях.
История добычи нефти
Человечеству нефть известна с древних времен. Существует достоверная информация, что еще 6000 лет назад народы, которые жили на территории сегодняшнего Ирака, добавляли ее в стройматериалы во время сооружения домов, защищая так стены и кровлю от влаги.
В Древнем Египте черную жидкость использовали для освещения, герметизации досок кораблей и в качестве составляющей для мумифицирования человеческих останков.
В Китае, 2500 лет назад, с помощью бамбуковых стволов со стальным буром делали глубокие скважины, добывая газ и нефть. Пока не ясно, как использовалась последняя, но с помощью летучего горючего вещества они выпаривали воду для добычи соли.
Современная история нефтяной промышленности датируется 1853 г., когда изобретатель из Польши – Лукасевич создал керосиновую лампу. Он же в 1856 г. открыл завод возле городка Ulaszowice. Здесь из нефти извлекали керосин.
Зарождением российской нефтедобычи является 1864 г., когда на Кубани перешли от ручного бурения скважин к ударно-штанговому с помощью паровой машины.
Началом мировой промышленности является 1859 г. В этом году из пробуренной Эдвином Дрейком первой в Америке скважины получили фонтан нефти с фиксированным дебитом. Ее глубина составляла 21,2 м, находилась она в городке Тайтусвилл, штат Пенсильвания. В дальнейшем бурение здесь скважин зачастую сопровождалось нахождением нефти.
Сорта нефти
Нефть, которая подготовлена к поставке конечному потребителю с учетом правил действующих нормативных актов, называют товарной. В ГОСТ Р 51858-2002 она делится на типы, степени подготовки, классы, виды, группы, содержанию меркаптанов и серы.
 Сорта нефти
Сорта нефти
По количеству серы вся продукция делится на классы:
- 1-й класс: малосернистая, содержание серы – 0,6%;
- 2-й класс: сернистая, содержание серы – 0,61-1,8%;
- 3-й класс: высокосернистая, содержание серы – 1,81-3,5%;
- 4-й класс: особо высокосернистая, содержание серы – 3,6%.
По доле парафина, выходу фракций и плотности классифицируется на 5 типов:
- особо легкая;
- легкая;
- средняя;
- тяжелая;
- битуминозная.
По содержанию меркаптанов и сероводорода, уровню подготовки к перевозке и переработке выделяют три группы – с 1 по 3.
Оборудование трубопроводных магистралей подачи и нефтеперерабатывающих промышленных заводов, как правило, подстраивается под конкретный сорт перерабатываемой рабочей жидкости, чтобы достичь максимальной эффективности в процессе ее обработки. Самыми популярными в мире считаются следующие:
- WTI (содержание серы – 0,24%);
- Brent (содержание серы – 0,37%);
- Siberian Light (содержание серы – 0,57%);
- Urals (содержание серы – 1,3%);
- Dubai Crude (содержание серы – 2%).
Из чего состоит нефть
С точки зрения химии нефть – это взаиморастворимый состав твердых, жидких и газообразных углеводородов с добавлением гетероорганических веществ, таких как: кислород, азот, сера. С учетом количества различных элементов жидкость может иметь разные варианты оттенков, которые варьируются от черного до темно-коричневого.
Типичный состав отличается для разных сортов и мест добычи. В среднем его можно охарактеризовать следующим образом:
- водород – (11,5-14,5%);
- углерод – (82,5-87%);
- сера – не более 10%;
- азот – не выше 1,8%;
- кислород – (0,1-0,35%);
- в некоторых случаях возможно добавление в малых количествах железа, магния, ванадия, никеля и других элементов.
Помимо этого, выделяют большое количество углеводородных соединений:
- ароматические;
- нафтеновые;
- парафиновые — большая часть, в основном, это жидкие соединения, но в растворенном виде встречаются твердые и газообразные.
Размещение месторождений
Сегодня на планете насчитывается примерно 600 бассейнов с нефтью различной площади. В сумме она составляет приблизительно 80 млн кв.км. На промышленный поток поставлены только 160 из них, остальные в разработке.
Месторождения нефти определены на всех материках Земли (за исключением Антарктиды) и на огромных пространствах прилегающих акваторий:
- самые крупные – в Персидском заливе и на Востоке;
- чуть меньше – в Индии, Австралии, Малайзии, Мьянме;
- наиболее мелкие – в Японии.
B Северной Америке открыто более 20 000 месторождений, которые расположены на Аляске, в Texace, Оклахоме, Калифорнии и других штатах. B Южной Америке самый большой бассейн находится в Венесуэле. Единичные крупные провинции определены в Колумбии и Аргентине, чуть поменьше на острове Тринидад и в Бразилии.
В европейской части (за исключением территории Российской Федерации) большие месторождения выявлены только в Англии и Норвегии.
Нефть была найдена в морях:
- Черном;
- Каспийском;
- Средиземном;
- Северном;
- Охотском;
- Японском;
- Яванском.
На сегодняшний день поиск ресурсов местонахождения нефти в Мировом океане происходит в акваториях континентальных окраин на глубине более 1,5 тыс. метров.
Как добывают нефть
Нефть добывается фонтанным или газлифтным способом, глубинными или электроцентробежными насосами:
- Фонтанный. При этом жидкость самотеком перемещается по насосному трубопроводу на поверхность. Скважина плотно накрывается фонтанной арматурой, которая требуется для вывода добытого ресурса в сборный нефтепровод.
- Газлифтный. Подъем нефти производится за счет сжатого газа, нагнетаемого в скважину с поверхности через клапан. Так жидкость попадает в трубопровод и выходит наверх.
- Штанговый насос. Оборудование может работать на глубине до 2500 м. Возвратно-поступательные движения плунжер помпы получает от установленной качалки за счет колонны штанг.
- Электроцентробежный насос. Оборудование изготавливается мощностью в пределах 40-700 м3/сутки, и имеет длину до 1700 метров. Наземное устройство в себя включает станцию управления, трансформатор и устьевую арматуру. В секционном электроцентробежном насосе находится 80-400 отделений. Одновременно с мотором и гидрозащитой помпу подают в скважину. Установка насоса производится перед самим спуском. Электропитание к двигателю подается с помощью бронированного провода. В полном сборе размер подземной части оборудования может доходить до 35 м и более.
Геология нефти
Породы, которые заключают в себе нефть, имеют относительно высокую пористость и проницаемость, достаточную для поднятия. Участки, где происходит свободное передвижение и скопление в них жидкости, называют коллекторами. Их пористость будет зависеть от уровня отсортированности зерен, а также наличия цемента, особенностей укладки и формы.
Главные коллекторы нефти – это конгломераты, пески, известняк, доломиты и иные проницаемые породы, находящиеся среди гипса или глины. Если условия благоприятны, то на них могут располагаться метаморфические элементы, которые установлены по соседству с осадочными нефтяными пластами.
Как ищут нефть
Перед разработкой скважины производятся поисково-разведочные работы. В первую очередь нефтеразведчики подбирают конкретный участок для поиска залежей природного ресурса. Для чего определяется потенциальная осадочная провинция, где уже производится более тщательное изучение.
После нахождения структур (ловушек), которые могут иметь нефтяные запасы, выполняют бурение скважин для исследования объемов залежей и расчета потенциала выкачки. Количество находящихся ресурсов, свойства жидкости и показатели породы, которая вмещает в себе нефть, исследуют и анализируют для определения целесообразности дальнейших работ.
Переработка нефти
Для получения топлива и необходимого сырья, нефть перерабатывают разными методами, все они имеют ряд этапов.
Первичные работы не подразумевают изменения химической формулы, в этом случае происходит только физическое деление на фракции. Вначале нефть очищается от примесей, воды и газа. Это так называемая первичная сепарация.
Основные задачи вторичных работ – увеличение видов изготавливаемого двигательного топлива. Процесс обусловлен значительным химическим изменением молекул углеводородов с дальнейшей трансформацией форм, которая больше всего удобна для последующего окисления.
Масштабы мировых запасов
Сегодня активно начинают продвигать сланцевую нефть. Ее общий объем в мире приблизительно 345 млрд баррелей. Однако добыча сланца экономически выгодна только в местах, в которых слой пласта не более 30 м, а количество нефти – 90 л на 1 т породы. Самая большая среди этих территорий находится в Америке.
По добыче сырой нефти Россия в десятке первых с показателем 554,3 млн тонн, или 12,7% от общей выкачки сырья в мире. Лидером в этом плане является Саудовская Аравия, которая ежегодно поставляет на рынок приблизительно 585,6 млн тонн, что в долевом соотношении равняется около 13,5%. Показатели Америки составляют порядка 545 млн. тонн, в том числе и сланец (12,5%).
В различных первоисточниках рейтинг государств по запасам «черного золота» не совпадает с реально добываемым его количеством.
Самые большие ресурсы – 17,7% или 300,8 млрд баррелей, в том числе тяжелой нефти пояса Ориноко, находятся в Венесуэле. Затем, с 266,9 млрд. баррелей идет Саудовская Аравия, Канада с 171,6 млрд., Иран – 158,5 млрд., Ирак – 154 млрд., Россия – 109,6 млрд., Кувейт – 101,7 млрд., ОАЭ – 97,7 млрд.
Остальные государства, в том числе Ливия и Америка, имеют в общем 347,8 млрд баррелей нефти.
Что делают из нефти
Есть множество сфер, где используют нефть. Некоторые области применения многие знают, но существует и необычная продукция.
- синтетический каучук;
- полиэтилен;
- дизель;
- бензин;
- мазут;
- лигроин;
- пропиленгликоль;
- CD-диски;
- подгузники;
- детские соски.
Также из нефти получают:
- искусственный мех;
- ткани;
- полиэстер;
- полиамид;
- нейлон;
- тени для век;
- шампуни;
- материалы для обивки мебели;
- духи;
- аспирин;
- антибиотики.
- антисептики;
- успокаивающие средства;
- противотуберкулезные препараты;
- резину;
- коврики;
- битум;
- краски;
- охлаждающую жидкость;
- масла;
- удобрения;
- воск.
Из нефти также делают:
- гудрон;
- кокс;
- серу;
- вазелин;
- парафин;
- моющие средства;
- жевательную резинку;
- панели солнечных батарей;
- ядохимикаты;
- пищевые загустители и ароматизаторы;
- продукты.
Современное развитие инновационных технологий открыло много новых сфер использования нефти, и, вероятно, это одна из главных причин увеличения ее стоимости. Потому нефтяники во всем мире могут не переживать за свой бизнес – их продукция будет стабильно востребована, по крайней мере ближайшие несколько десятилетий.
Какие сорта нефти добывают в России
На территории России нефть добывается в разных местах, после чего смешивается в определенные сорта. Основным является Urals, содержание серы которого находится в диапазоне 1,3%. Также получаются сорта ESPO и Siberian Light. Последний формируется за счет смешивания нефти из Западной Сибири. ESPO состоит из зарождений, добытых в Центральной, Восточной и Западной Сибири. Urals формируется из нефти Тимано-Печорской провинции, Урало-Поволжского региона и Западной Сибири.
Какими способами добывают нефть в России
На территории России в основном используется два способа добычи нефти:
- Газлифтный. В скважину закачивается газообразное вещество, которое снижает плотность нефти. Это способствует подъему жидкости вверх. Также может применяться бескомпрессорный газлифт, когда используется сжатый воздух.
- Насосный. На территории РФ в основном используются штанговые насосы. Специальное оборудование устанавливается в скважине, его запитывают с поверхности. Насосы работают на углублении до 400 м, скорость добычи примерно 500 м3/ч.
Также в России могут применяться винтовые насосы, роторы которых имеют спиралевидную форму.
Интересное видео про нефть
Если Вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Алкены
Алкены – непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда – этилену – CH2=CH2. Общая формула их гомологического ряда – CnH2n.
Номенклатура и изомерия алкенов
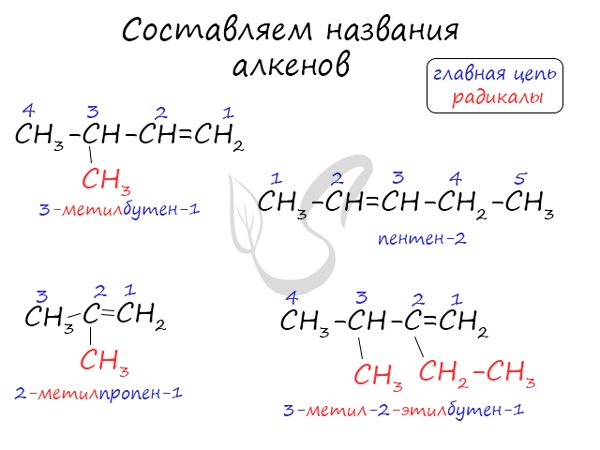
Названия алкенов формируются путем добавления суффикса “ен” к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.
Атомы углерода, прилежащие к двойной связи находятся в sp 2 гибридизации.
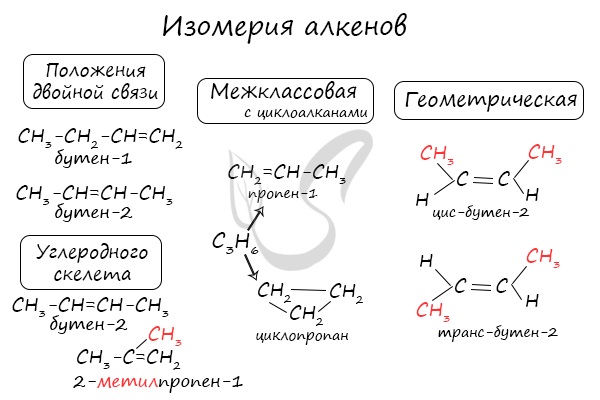
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.
Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) – sp 2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
-
Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее – вторичный и заметно труднее – первичный.

В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

В подобных реакциях применяется цинк (цинковая пыль) – двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

При нагревании спиртов c серной кислотой – H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены – ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

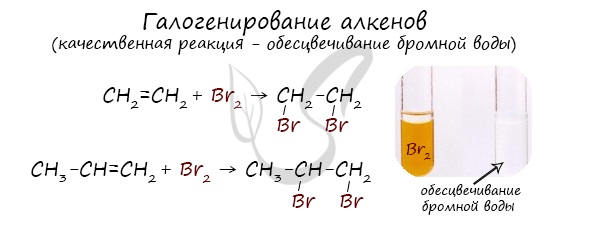
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена – к наименее гидрированному атому углерода.

Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа – к наименее гидрированному.

При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды – полное окисление. При неполном окислении образуются окиси.

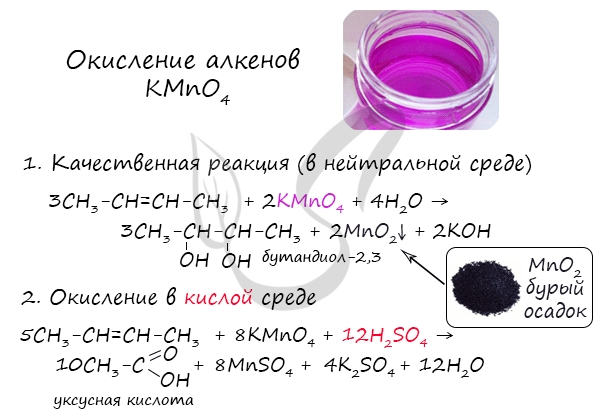
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета – MnO2.
В более жестких условиях – при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы – двойной связи.
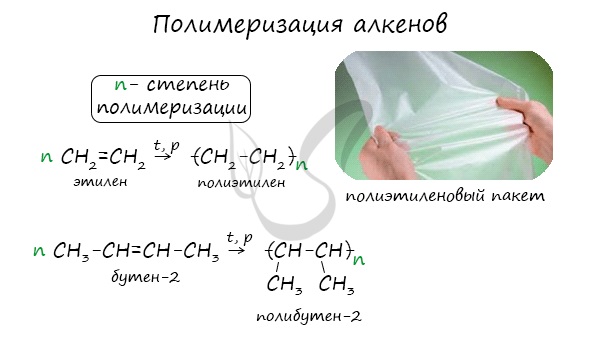
Полимеризация – цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс “n”, степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Алкены — номенклатура, получение, характерные химические свойства
К непредельным относят углеводороды, содержащие в молекулах кратные связи между атомами углерода. Непредельными являются алкены, алкины, алкадиены (полиены). Непредельным характером обладают также циклические углеводороды, содержащие двойную связь в цикле (циклоалкены), а также циклоалканы с небольшим числом атомов углерода в цикле (три или четыре атома). Свойство «непредельности» связано со способностью этих веществ вступать в реакции присоединения, прежде всего водорода, с образованием предельных, или насыщенных углеводородов — алканов.
Строение алкенов
Алкены — ациклические углеводороды, содержащие в молекуле помимо одинарных связей, одну двойную связь между атомами углерода и соответствующие общей формуле СnН2n. Свое второе название — олефины — алкены получили по аналогии с жирными непредельными кислотами (олеиновая, линолевая), остатки которых входят в состав жидких жиров — масел.
Атомы углерода, между которыми есть двойная связь, находятся в состоянии sр 2 -гибридизации. Это означает, что в гибридизации участвуют одна s- и две р-орбитали, а одна р-орбиталь остается негибридизованной. Перекрывание гибридных орбиталей приводит к образованию σ-связи, а за счет негибридизованных р-орбиталей
соседних атомов углерода образуется вторая, π-связь. Таким образом, двойная связь состоит из одной σ- и одной π — связи. Гибридные орбитали атомов, образующих двойную связь, находятся в одной плоскости, а орбитали, образующие π -связь, располагаются перпендикулярно плоскости молекулы. Двойная связь (0,132 им) короче одинарной, а ее энергия больше, т. к. она является более прочной. Тем не менее, наличие подвижной, легко поляризуемой π -связи приводит к тому, что алкены химически более активны, чем алканы, и способны вступать в реакции присоединения.


Образование двойной связи в алкенах
Гомологический ряд этена
Неразветвленные алкены составляют гомологи- ческий ряд этена (этилена): С2Н4 — этен, С3Н6 — пропен, С4Н8 — бутен, С5Н10 — пентен, С6Н12 — гексен, С7Н14 — гептен и т.д.
Изомерия алкенов
Для алкенов характерна структурная изомерия. Структурные изомеры отличаются друг от друга строением углеродного скелета. Простейший алкен, для которого характерны структурные изомеры, — это бутен:

Особым видом структурной изомерии является изомерия положения двойной связи:

Алкены изомерны циклоалканам (межклассовая изомерия), например:

Вокруг одинарной углерод-углеродной связи возможно практически свободное вращение атомов углерода, поэтому молекулы алканов могут приобретать самую разнообразную форму. Вращение вокруг двойной связи невозможно, что приводит к появлению у алкенов еще одного вида изомерии — геометрической, или цис- и транс-изомерии.


Цис-изомеры отличаются от транс-изомеров пространственным расположением фрагментов молекулы (в данном случае метильных групп) относительно плоскости π -связи, а следовательно, и свойствами.
Номенклатура алкенов
1. Выбор главной цепи. Образование названия углеводорода начинается с определения главной цепи — самой длинной цепочки атомов углерода в молекуле. В случае алкенов главная цепь должна содержать двойную связь.
2. Нумерация атомов главной цепи. Нумерация атомов главной цепи начинается с того конца, к которому ближе находится двойная связь.
Например,правильное название соединения:

Если по положению двойной связи нельзя определить начало нумерации атомов в цепи, то его определяет положение заместителей так же, как для предельных углеводородов.

3. Формирование названия. В конце названия указывают номер атома углерода, у которого начинается двойная связь, и суффикс -ен, обозначающий принадлежность соединения к классу алкенов. Например:

Физические свойства алкенов
Первые три представителя гомологического ряда алкенов — газы; вещества состава С5Н10 — С16Н32 — жидкости; высшие алкены — твердые вещества.
Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Химические свойства алкенов
Реакции присоединения. Напомним, что отличительной чертой представителей непредельных углеводородов — алкенов является способность вступать в реакции присоединения. Большинство этих реакций протекает по механизму электрофильного присоединения.
1. Гидрирование алкенов. Алкены способны присоединять водород в присутствии катализаторов гидрирования, металлов — платины, палладия, никеля:

Эта реакция протекает при атмосферном и повышенном давлении и не требует высокой температуры, т. к. является экзотермической. При повышении температуры на тех же катализаторах может пойти обратная реакция — дегидрирование.
2. Галогенирование (присоединение галогенов). Взаимодействие алкена с бромной водой или раствором брома в органическом растворителе (СС14) приводит к быстрому обесцвечиванию этих растворов в результате присоединения молекулы галогена к алкену и образования дигалогеналканов.
3. Гидрогалогенирование (присоединение галогеноводорода).

Эта реакция подчиняется правилу Марковникова:
При присоединении галогеноводорода к алкену водород присоединяется к более гидрированному атому углерода, т. е. атому, при котором находится больше атомов водорода, а галоген — к менее гидрированному.


4. Гидратация (присоединение воды). Гидратация алкенов приводит к образованию спиртов. Например, присоединение воды к этену лежит в основе одного из промышленных способов получения этилового спирта.

Обратите внимание на то, что первичный спирт (с гидроксогруппой при первичном углероде) образуется только при гидратации этена. При гидратации пропена или других алкенов образуются вторичные спирты .

Эта реакция протекает также в соответствии с правилом Марковникова — катион водорода присоединяется к более гидрированному атому углерода, а гидроксогруппа — к менее гидрированному.
5. Полимеризация. Особым случаем присоединения является реакция полимеризации алкенов:

Эта реакция присоединения протекает по свободнорадикальному механизму.
Реакции окисления.
1. Горение. Как и любые органические соединения, алкены горят в кислороде с образованием СО2 и Н2О:

2. Окисление в растворах. В отличие от алканов алкены легко окисляются под действием растворов перманганата калия. В нейтральных или щелочных растворах происходит окисление алкенов до диолов (двухатомных спиртов), причем гидроксильные группы присоединяются к тем атомам, между которыми до окисления существовала двойная связь:
Урок 19. Алкены
Гомологический ряд, номенклатура, изомерия
Алкены — это нециклические углеводороды, в молекулах которых есть одна двойная связь.
Алкены относятся к группе непредельных углеводородов. Непредельными углеводородами являются вещества, в состав молекул которых входит меньшее, чем у алканов, число атомов водорода. Поэтому они способны к реакциям присоединения, т. е. являются ненасыщенными.
Вопрос. Может ли существовать алкен, в состав которого входит один атом углерода?
Поскольку двойная связь связывает два атома углерода, минимальное число атомов углерода в молекуле алкена равно двум. Сравним состав алкана и алкена:
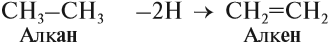
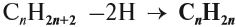
Таким образом, алкены образует гомологический ряд, общая формула которого
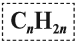
Вопрос. Почему в названиях алкенов появился суффикс ЕН? (См. урок 17.7.)
Упражнение 19.1. Составьте графические формулы алкенов для n = 4.
Решение. Состав этого углеводорода С4Н8. Он содержит двойную связь. Для него возможны три углеродные цепочки:
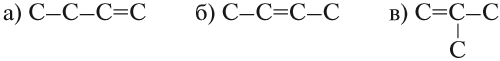
Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры.
Вывод. Начиная с бутена (n = 4) у алкенов возможна структурная изомерия, которая связана
- со строением углеродной цепи: (а) и (в);
- с положением двойной связи: (а) и (б).
Кроме того, для некоторых алкенов возможна пространственная (цис-транс-) изомерия. Цис-транс-изомеры отличаются друг от друга расположением одинаковых атомов или групп атомов по отношению к двойной связи. Такие изомеры есть у алкенов, в молекулах которых около двойной связи имеются разные радикалы (атомы, группы). Например, у бутена-2 [это формула (б)] второй и третий атомы углерода связаны с двумя разными группами: –СН3 и –Н:

Задание 19.1. Назовите оставшиеся два изомера бутена (а) и (в).
Таким образом, в названиях алкенов присутствие двойной связи обозначают при помощи суффикса ЕН, а положение двойной связи показывают цифрой, которую записывают после суффикса. Эта цифра указывает на меньший номер атома углерода при двойной связи. Нумерация атомов углерода основной, главной цепи начинается с того конца, к которому ближе двойная связь.
Упражнение 19.2. Назвать углеводород:
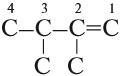
Решение. Основная цепь содержит 4 атома углерода, причём двойная связь соединяет атомы углерода № 1 и № 2 (нумеруем справа налево, так как к правому концу ближе двойная связь). Получаем: бутен-1.
У второго и третьего атомов углерода имеются радикалы «метил», всего их два (обозначение — ДИ); получаем: 2,3-диметилбутен-1.
Задание 19.2. Составьте графические формулы изомеров алкена с n = 5; назовите полученные соединения.
Кроме рассмотренных выше названий по международной номенклатуре IUPAC, на практике применяются и так называемые тривиальные названия. Например, этен обычно называют этилен, пропен — пропилен и т. д. Поэтому алкены называются «этиленовые углеводороды», тем более что по свойствам похожи на этилен.

Строение молекул
Молекулы алкенов отличаются по строению от молекул алканов тем, что они содержат двойную связь. Рассмотрим строение этой связи. Эта связь ковалентная, но неоднородная. Одна из двух связей имеет ту же природу, что и связь в молекулах алканов, т. е. это прочная σ-связь. Другая связь двойной связи образуется иначе, она менее прочная и обозначается буквой π(пи). Это π-связь. Таким образом, в молекуле этена (этилена) имеется:
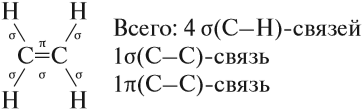
Вопрос. Какая связь будет легче разрушаться в химических реакциях: σ- или π-связь?
В результате алкены (и любые другие углеводороды), имеющие π-связь, легко, иногда даже при обычных условиях, вступают в химические реакции, причём эти реакции происходят за счёт разрыва π-связи.
Свойства алкенов
Физические свойства
По физическим свойствам алкены почти не отличаются от алканов: низшие алкены (этилен, пропилен и др.) — газы, а с увеличением молекулярной массы увеличиваются и температуры кипения и температуры плавления. Это неполярные вещества, поэтому они практически нерастворимы в воде, но хорошо растворяются в бензине, маслах.
Химические свойства
Наиболее характерной реакцией для алкенов является реакция присоединения. В ходе этой реакции разрывается непрочная π-связь, в результате у обоих атомов углерода, которые соединялись этой связью, появляются «свободные» валентности, за счёт чего и происходит присоединение:
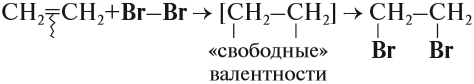
Эта реакция бромирования этилена (и других алкенов) происходит при нормальных условиях под действием раствора брома в воде (бромной воды). В результате цвет бромной воды изменяется: был жёлтым, становится бесцветным.
Поэтому реакция обесцвечивания бромной воды является качественной* на двойную связь.
* Качественной называется химическая реакция, при помощи которой можно обнаружить вещество в смеси или в растворе. В результате качественной реакции изменяется цвет, выделяется газ, осадок.
Упражнение 19.3. В двух пробирках находятся бесцветные жидкости: н-пентан и пентен-1. Как при помощи химической реакции определить, где какая жидкость находится?
Решение. В обе пробирки добавляем жёлтую бромную воду и сильно встряхиваем: в пробирке, где был пентен-1, смесь обесцветится, а в другой пробирке цвет бромной воды не изменится.
Задание 19.3. Составьте уравнения реакций этих процессов.
Аналогично происходят и другие реакции присоединения: с Н2 (гидрирование), с Н2O (гидратация), с НСl и т. д. При этом в результате реакции присоединения двойная связь всегда разрушается (разрывается π-связь). Изменяется характер химической связи: вместо двойной связи появляется простая связь. Образуется одно вещество:
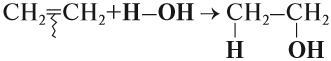
Задание 19.4. Составьте уравнения реакций:
- пропен + водород;
- бутен-2 + вода.
Во всех случаях, которые рассматривались ранее, в результате реакции присоединения могло получиться только одно вещество (один изомер). Но так бывает не всегда. Попробуем составить уравнение реакции пропена с хлороводородом:
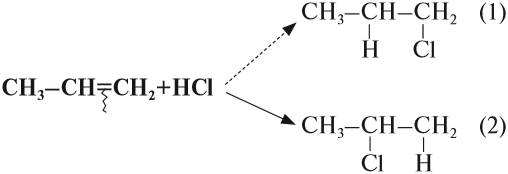
Какой изомер получится: (1)? или (2)? или оба? Эта задача решается при помощи правила Марковникова (1869 год)*.
* Марковников Владимир Васильевич (25.12.1837–11.02.1904) — русский химик-органик. Ввёл понятие о взаимном влиянии атомов как главном содержании теории химического строения.
Соединения типа Н-Х присоединяются по месту разрыва двойной связи так, что при этом атом водорода (вещества Н-Х) присоединяется к атому углерода, у которого было больше атомов водорода (наиболее гидрогенизированный атом углерода).
Вопрос. Какой изомер получился при гидрировании бутена-2: (1) или (2)?
При составлении уравнений таких реакций, конечно, нужно «считать» атомы водорода только у тех атомов углерода, которые связаны двойной связью:
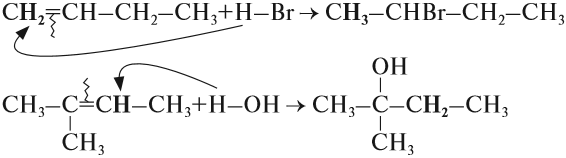
Задание 19.5. Составьте уравнения реакций:
- пропен + бром;
- бутен-1 + хлороводород;
- 2-метилпропен + вода.
В отличие от алканов, алкены вступают в реакции окисления* и при обычных условиях. Так, если этилен пропустить через розовый раствор перманганата калия (КМnО4), то раствор станет бесцветным:
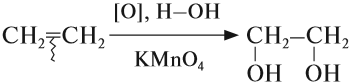
* Реакции мягкого окисления, в которых не разрушается углеродная цепь атомов, обозначается [O], а формула вещества-окислителя записывается под стрелочкой.
Вопрос. Является ли эта реакция качественной на двойную связь?
Таким образом, для обнаружения двойной связи в углеводороде, можно воспользоваться любой из качественных реакций:
- обесцвечивание бромной воды;
- обесцвечивание раствора перманганата калия.
Алкены горят, но, в отличие от газообразных алканов, пламя которых бесцветно, газообразные алкены горят светящимся (ярким) пламенем.
Задание 19.6. Составьте уравнение реакции горения этилена.
Алкены легко вступают в реакцию полимеризации. Это процесс, при котором из большого числа молекул (мономеров) образуется ОДНА большая молекула (полимер):
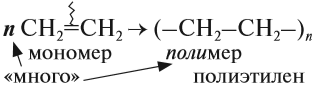
Вопрос. Является ли полиэтилен химически активным веществом? Почему?
Полиэтилен, в отличие от этилена, уже не содержит двойной связи, поэтому он химически инертен, т. е. практически не вступает в химические реакции. Поэтому из него делают плёнки, различные изделия, которые широко применяются в быту (полиэтиленовые пакеты*) и в химической промышленности (трубы, ёмкости и др.).
* Полиэтиленовые пакеты часто неправильно называют «целлофановыми», хотя целлофан — совсем другой материал (см. урок 26).

Получение и применение алкенов
Главный промышленный источник алкенов — природный газ, нефть и продукты их переработки (например, продукты крекинга).
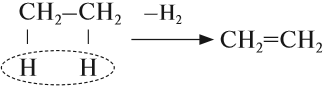
Основным способом получения алкенов является реакция отщепления. В этом случае от двух соседних атомов углерода отщепляется по одному атому или группе:
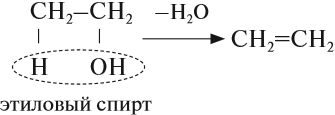
В лаборатории алкены можно получить реакцией дегидратации (отщепления воды) спиртов. Эта реакция происходит при нагревании в присутствии концентрированной серной кислоты:
Упражнение 19.4. Какую молекулу нужно отщепить от хлорэтана, чтобы получить алкен?
Решение. Сравним состав хлорэтана и этилена:
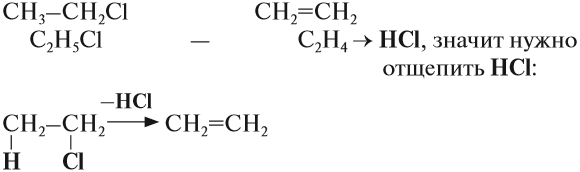
Эта реакция происходит под действием спиртового раствора щёлочи. Уравнение этого процесса записывается так:
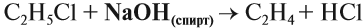
Вопрос. Какую молекулу нужно отщепить от 1,2-дихлорэтана для получения этилена?
Алкены легко вступают в химические реакции, поэтому они применяются для получения различных веществ: спиртов, растворителей, полимеров. Например, из этилена получают этиловый спирт, растворители (хлорэтан и дихлорэтан), полиэтилен.
Задание 19.7. Составьте уравнения реакций получения перечисленных веществ.
Плёнки полиэтилена находят большое применение не только для хранения пищевых продуктов: ими устилают дно каналов, чтобы уменьшить потери влаги; полиэтиленовую пленку используют для устройства парников; ею оборачивают трубы, чтобы уменьшить потери от коррозии и т. д.
Понятие об алкадиенах (диены)
Алкадиены — это углеводороды, в молекулах которых есть две двойные связи.
Алкадиены относят к группе непредельных ненасыщенных углеводородов.
Для того чтобы вывести общую формулу гомологического ряда алкадиенов, сравним состав алканов и алкадиенов:
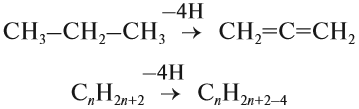
Таким образом, алкадиены образуют гомологический ряд, общая формула которого
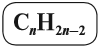
Первый член гомологического ряда алкадиенов С3Н4 называется пропадиен. Таким образом, названия составляют, используя те же принципы номенклатуры IUPAC, с использованием суффикса диен.
Вопрос. На что указывает этот суффикс?
Некоторые диены (так кратко обозначают представителей этого гомологического ряда) имеют тривиальные названия. Например, бутадиен-1,3 известен под названием дивинил, поскольку каждая его половинка является непредельным радикалом, который называется «винил»:
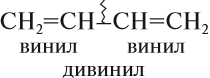
Его гомолог — 2-метилбутадиен-1,3 называется изопрен.
Задание 19.8. Составьте графическую формулу этого соединения.
Начиная с n = 4, возникает изомерия, которая связана не только со строением углеродной цепи, но и положением кратных связей. По этому признаку различают:
- диены с кумулированными связями С–С–С=С=С;
- диены с сопряжёнными связями С–С=С–С=С;
- диены с изолированными связями С=С–С–С=С.
Наибольшее значение и применение имеют диены с сопряжёнными связями. Рассмотрим их свойства.
Для алкадиенов, как и для алкенов, характерны реакции присоединения, которые идут в две стадии. Но диены с сопряжёнными связями вначале присоединяют бром (или другое вещество) в положение 1,4:
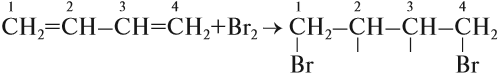
Образовавшиеся «свободные валентности» замыкаются, образуя двойную связь.
Вопрос. Возможна ли для полученного соединения реакция присоединения?
Поскольку полученное вещество содержит двойную связь, возможна вторая стадия этого процесса:
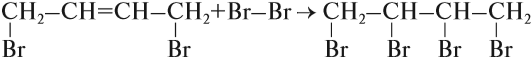
Установлено, что на первой стадии присоединения образуется 2 изомера: 80 % указанного вещества (1,4-дибромбутен-2) и 20 % 3,4-дибромбутена-1*.
* Здесь нумерация цепи идёт по двойной связи, так как галогены не являются функциональной группой.
Задание 19.9. Составьте формулы обоих соединений.
Большое практическое значение имеет процесс полимеризации сопряжённых диенов. Вначале, как в случае бромирования, возникает двойная связь в положении 2,3:
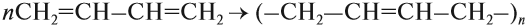
Поскольку в полученном полимере имеется двойная связь, такие полимеры имеют два изомера: цис- и транс- (см. урок 19.1). Цис-изомеры таких полимеров являются эластичными и называются каучуки.
Каучуки — это эластичные полимеры, из которых получают резину. Резина образуется из каучука в результате вулканизации. Дело в том, что чистый каучук имеет крайне низкие эксплуатационные качества. Он становится твёрдым и хрупким на морозе, липким на жаре, быстро окисляется, крайне непрочен.
Бутадиен получают синтезом Лебедева**, который заключается в том, что этиловый спирт в присутствии определённых катализаторов подвергают одновременно дегидрированию и дегидратации:
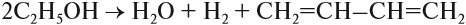
** Лебедев Сергей Васильевич (25.07.1874–02.05.1934) — советский химик. Впервые получил (1910) образец синтетического бутадиенового каучука, разработал (1930) методы получения резины и резинотехнических изделий из синтетического каучука. По способу Лебедева впервые получен (1932) промышленный синтетический каучук.
Для алкадиенов, так же как и для алкенов, характерна реакция окисления. Например, они обесцвечивают раствор перманганата калия. При этом образуются многоатомные спирты.
Производные изопрена широко распространены в природе. К ним относятся многие душистые вещества (мяты, лимона), витамины (каротин, витамин А), а также холестерин.

Выводы
Алкены и алкадиены — это непредельные углеводороды, содержащие двойные связи. Для таких веществ характерны реакции
- присоединения;
- окисления;
- полимеризации.
Все они происходят за счёт разрыва π-связи, которая входит в состав двойной связи.
Алкадиены с сопряжёнными связями образуют полимеры с особыми свойствами — каучуки.
Алкены
Алкены – это нециклические, непредельные УВ, в молекулах которых два атома углерода находятся в состоянии sp 2 -гибридизации и связаны друг с другом двойной связью. Общая формула: CnH2, n≥2
Одновалентный радикал этилена СН2=СН – называется винилом.
Изомерия и номенклатура
Для алкенов возможны 3 типа изомерии: изомерия углеродной цепи, изомерия положения двойной связи, цис-транс-изомерия.
Первые 2 члена гомологического ряда – этен и пропен – изомеров, относящихся к классу алкенов, не имеют.

Алкены изомерны другому классу соединений – циклоалканам. Они имеют одинаковую общую формулу CnH2n.

Физические свойства
Плохо растворимы в воде.
Химические свойства
Алкены обладают большей реакционной способностью, чем алканы. Это обусловлено наличием в их молекулах двойной связи. π-связь менее прочная, чем σ-связь. Она легко разрушается под воздействием различных реагентов. Освободившиеся в результате разрыва π-связи валентности углеродных атомов используются для присоединения атомов или групп атомов молекулы реагента. Для алкенов характерны реакции присоединения.
I. Реакции присоединения

1. Присоединение водорода (+Н2) – гидрирование, образуются алканы:

2. Присоединение галогенов (+F2, Cl2, Br2, I2) – галогенирование, образуются дигалогеналканы:

Бромная вода (раствор Br2 в воде) имеет желтый цвет. При взаимодействии с алкенами бромная вода обесцвечивается, поэтому реакция с бромной водой используется для идентификации алкенов.
Как уже указывалось при изучении неорганической химии, реакции, которые используются для идентификации различных веществ, называются качественными реакциями.
Реакция с бромной водой является качественной реакцией на все непредельные углеводороды, в том числе на алкены.
3. Присоединение галогеноводородов (+HHal) — гидрогалогенирование, образуются моногалогеналканы:

Присоединение галогеноводородов к несимметричным алкенам происходит по правилу В. В. Марковникова.
Правило Марковникова. При присоединении веществ типа НХ (Х = Hal, ОН и т. д.) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. Например:

Механизм присоединения по правилу Марковникова
Ориентация присоединения объясняется поляризацией молекулы несимметричного алкена в результате действия индуктивного эффекта.
Алкильные группы как электронодонорные заместители определяют место присоединения протона.

Метильная группа отталкивает электроны связи СН3—С, что приводит к поляризации π-связи. Электроны π-связи являются очень подвижными, т. е. легко смещаются к атому C(l). Это смещение показывают изогнутой стрелкой. В результате на атоме C(l) возникает частичный отрицательный заряд δ — , а на атоме С(2) — частичный положительный заряд δ + . При присоединении галогеноводорода протон Н + присоединяется к атому СО), несущему частичный отрицательный заряд:

При наличии в молекулах непредельных углеводородов заместителей, проявляющих значительный электроноакцепторный эффект, реакция идет против правила Марковникова:

4. Присоединение воды (+Н2О) — гидратация, образуются предельные одноатомные спирты (алканолы CnH2n+lOH). Присоединение воды происходит по правилу Марковникова:

II. Реакции окисления
- Горение:
б) неполное (недостаток О2)
- Взаимодействие с О2 в присутствии катализаторов (образуются эпоксиды):

- Неполное окисление под действием окислителей типа KMnO4, K2Cr2O7.
При действии разбавленного водного раствора KMnO4 в щелочной среде происходит гидроксилирование алкенов (введение гидроксогруппы) с образованием диолов (реакция Е.Е. Вагнера). Раствор KMnO4 при этом обесцвечивается:

Аналогично происходит реакция алкена с разбавленным раствором KMnO4 в кислой среде. Реакция с KMnO4 является качественной реакцией на непредельные УВ, в том числе на алкены.
III. Реакции полимеризации
Процесс полимеризации алкенов открыт А.М.Бутлеровым.
Полимеризацией называется процесс соединения одинаковых молекул (мономеров), протекающий за счет разрыва кратных связей, с образованием высокомолекулярного соединения (полимера).


Получение
В промышленности:
2) дегидрирование алканов

3) гидрирование алкинов

В лаборатории:

При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А.М. Зайцева):

2) Дегидрогалогенирование моногалогеналканов (- HHal) действием твердой щелочи или ее спиртового раствора.
Происходит по правилу А.М. Зайцева:

3) Дегалогенирование (- 2Hal) дигалогеналканов с атомами галогена у соседних атомов «С» действием Zn или Mg:

Применение этилена

Скачать:
Скачать бесплатно реферат на тему: «Этилен и его производные в промышленном органическом синтезе» Этилен-и-его-производные-в-промышленном-органическом-синтезе.doc (Одна Загрузка)
Скачать рефераты по другим темам можно здесь
Похожее
Добавить комментарий Отменить ответ

Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Получение и свойства алкенов
Способы получения и свойства алкенов имеют существенные отличия по сравнению с алканами. Двойная связь в составе углеродной цепи алкенов очень реакционноспособна, поэтому они охотно вступают в реакции присоединения, в отличие от алканов, для которых характерны реакции замещения. Далее подробно рассмотрим способы получения, физические и химические свойства алкенов.
Физические свойства алкенов
Физические свойства алкенов, такие как температура плавления и кипения немного ниже температуры кипения соответствующих алканов.
Первые представители данного класса с C1по C4 — газообразные вещества, практически не имеющие запаха, C5-C17 – жидкости с резким запахом, более 17 атомов углерода – твердые вещества.
Растворимость. Они плохо растворимы в воде, и хорошо растворимы в органических соединениях. Их плотность меньше плотности воды.
Алкены-неполярные соединения, практически нерастворимые в воде и растворимые в органических растворителях. Они менее плотные, чем вода.
Температура плавления и кипения. Температура кипения/плавления увеличивается прямо пропорционально относительной молекулярной массы соединения. В таблице представлены некоторые физические характеристики алкенов, а на рисунке зависимость температур их кипения/плавления от числа углеродных атомов.
![]()
![]()
Устойчивость алкенов. В целом цис-алкен менее устойчив, чем его стерео транс-изомер. Это обусловлено нестабильностью цис-изомера вследствие влияния стерического фактора.
![]()
Получение алкенов
Алкены получают следующими способами:
1.Термический крекинг алканов. При Т=450-700°С разложение алканов приводит к образованию более низкомолекулярных алканов и алкенов:
2.Дегидрирование алканов. Реакция протекает в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO при Т
![]()
3.Неполное гидрирование алкинов в присутствии катализатора (Ni, Pt, Pd) при T
![]()
4.Реакция отщепления (элиминирование) – дегидратация, дегалогенирование, дегидрогалогенирование.
- Дегидратация спиртов при Т≥ 150°С, в присутствии водоотнимающего агента — серной кислоты:
![]()
- Дегидрогалогенирование моногалогеналкановпод действием спиртового раствора щелочи:
![]()
- Дегалогенирование дигалогеналканов при действии активных металлов:
![]()
При протекании реакций элиминирования с участием спиртов и моногалогеналканов отщепление атома водорода происходит от менее гидрогенизированного атома углерода (т.е. того атома углерода, который соединен с наименьшим числом атомов водорода). Это правило известно, как правило Зайцева.
Химические свойства алкенов
Химические свойства алкенов обусловлены наличием двойной связи, которая состоит из сильной сигма (σ) связи и слабой пи (π) связи. Типичные реакции алкенов протекают с разрывом этой более слабой π-связи и формированием двух σ-связей. При взаимодействии электофильного агента (E + ) с алкеном образуется очень реакционноспособный карбкатион, который очень быстро присоединяет нуклеофильный агент (Nu — ):
1 стадия – образование карбкатиона протекает медленно:
![]()
2 стадия – присоединение нуклеофила протекает очень быстро:
![]()
Реакции присоединения
1.Гидрирование алкенов в присутствии платинового или никелевого катализатора. Реакция является экзотермической.
![]()
2.Галогенирование алкенов в инертном растворителе, например, четыреххлористый углерод. Алкены реагируют с галогенами с образованием дигалоалканов. Реакционная способность галогенов уменьшается в ряду: хлор > бром > йод.
Для обнаружения двойной углерод-углеродной связи используют бром. При добавлении к алкену 5% раствора брома в тетрахлорметане, последний обесцвечивается, что указывает на наличие двойной связи в молекуле.
![]()
3.Гидрогалогенирование алкенов концентрированными водными растворами галогенводородов. Реакционная способность растет в ряду HI > HBr > HCl.
Симметричные алкены дают только один продукт из-за эквивалентности двух атомов углерода.
В несимметричных алкенах добавление галогенводорода происходит таким образом, что атом галогена (отрицательная часть молекулы) присоединяется к атому углерода, который соединен с меньшим количеством атомов водорода (т.е. наименее гидрогенезированный). Это правило известно как правило Марковникова (1869 г.):
![]()
Однако в некоторых случаях присоединение галогенводорода происходит против правила Марковникова. Например, в присутствии кислорода и пероксидов проявляется пероксидный эффект:
![]()
Присоединение против правила Марковникова может также идти в случае наличия в молекуле алкена электронноакцепторных групп, например, -СООН, –СN, –CHal3 (Hal–галоген), –C(O)–R, –COOR, –NO2, –N=O, –SO3H и т.п.:
![]()
4.Гидратация алкенов в присутствии разбавленных кислот и катализатора. Например, при пропускании смеси этена и пара над фосфорной кислотой и кремнеземом под давлением 65 атм, а при 300С получают этанол.
![]()
5.Сульфирование алкенов концентрированной серной кислотой протекает в соответствии с правилом Марковникова:
![]()
6.Гипогалогенирование алкенов происходит по правилу Марковникова:
![]()
7.Алкилирование алкенов в кислой среде:
![]()
8.Присоединение альдегидов алкенами (реакция Принса):
![]()
Изомеризация алкенов
![]()
Полимеризация алкенов
Полиприсоединение — это процесс, с помощью которого большое количество молекул одного вида объединяются (без выделения простых молекул, таких как НHal, Н2О и т.д.) для образования гигантской молекулы, называемой полимером. Алкены подвергаются полимеризации при нагревании под давлением в присутствии подходящих катализаторов. Например, при нагревании этена до 1000 о С под давлением 1000 атм. в присутствии кислорода получают полиэтилен.
![]()
Реакции окисления
Окисление алкенов происходит легко, но продукт окисления зависит от окисляющего агента. Существует множество вариантов окисления алкенов. Рассмотрим основные из них:
- Горение алкенов. Алкены, как и алканы, очень горючие. Алкены горят светящим пламенем. Реакции их горения являются экзотермическими.
![]()
- Окисление кислородом воздуха при Т=200-500 о С, в присутствии серебряного катализатора или надкислотами (реакция Прилежаева) ведет к образованию эпоксидов:
![]()
- Окисление алкенов под действием холодного щелочного раствора перманганата калия приводит к образованию дигидроксильных соединений (диолы или гликоли). Перманганат калия при этом обесцвечивается, поэтому реакция является качественной на присутствие кратных связей. Такая реакция носит имя Вагнера:
![]()
- Окисление алкенов под действием подкисленного раствора перманганата или бихромата калия или окиси хрома (III) приводит к образованию кислоты и кетона:
![]()
- Озонирование алкенов приводит к образованию озонидов, которые далее под действием воды в присутствии восстановителя образуют альдегиды (Реакция Гарриеса). Окисление алкенов озоном с последующим разложением образовавшегося озонида водой называют озонолизом. Характер продуктов (альдегидов и кетонов), образующихся вследствие озонолиза, зависит от расположения двойной связи в материнском алкене. Поэтому такая реакция обеспечивает очень удобный способ определения положения двойной связи в любой молекуле:
![]()
Более высокомолекулярные алкены, содержащие длинную С-С цепь, обладают алкан-подобной структурой. Вследствие этого они могут вступать в реакции замещения подобно алканам.
Применение алканов
Где применяются представители ненасыщенных соединений -алкены? Этилен — ценное сырье для химического производства. Из него получают стирол, винилхлорид, этанол, уксусный альдегид, уксусную кислоту, и также дихлорэтан.
Полимеризацией алкенов получают различные полимеры, смазочные материалы и резиновые изделия.
В среднем мировое производство полиэтилена составляет 100 миллионов тонн в год. В промышленных объемах из пропилена получают полипропилен. Кроме того, пропилен — стартовый материал для производства окиси, изопропилового спирта, кумола, бутиральдегида, глицерина.
Бутены, главным образом, необходимы производстве полиизобутилена, метилэтилкетона, бутилкаучука, изопрена. Изобутилен — превосходное химическое сырье для производства третичного бутанола, бутилкаучука, а также изопрена. Применяется при алкилировании фенолов для изготовления сурфактантов (особые вещества, покрывающие альвеолы легких).
Сополимеры с бутенами используются в качестве изолятора и добавок для масел.
Высшие алкены используются не только в производстве полимерных материалов, но также и в производстве высших органических спиртов.






