Полимеры. Общие сведения

Что такое полимер?
Полимерами называют высокомолекулярные химические соединения (ВМС) вещества, обладающие молекулярной массой от тысяч до нескольких миллионов атомных единиц. Макромолекулы полимеров образовываются из огромного количества повторяющихся мономерных звеньев. Свойства полимеров зависят от химической природы мономера, молекулярной массы, методом производства полимера, стереоструктурой молекул (расположением в пространстве) и степенью их разветвленности, а также связей между молекулами различной природы.
Большинство полимеров являются по природе диэлектриками, также имеют низкую теплопроводность и достаточно высокие механические характеристики.
Классификация полимеров
Разделение полимеров на четкие классы – достаточно сложное дело. В современной теории существует несколько подразделений полимерных материалов по видам:
- полимеры могут быть природными или синтетическими, также бывают модифицированные полимеры;
- по типу реакции образования полимеры делятся на полимеризационные и поликонденсационные;
- в зависимости от химического состава полимеры подразделяются на неорганические (например, силиконы), органические полимеры (например, полистирол) и элементоорганические полимеры (например, фторопласты). При этом основной вид используемых полимеров – органические;
- по методу переработки и соответствующему отношению к воздействию на них температуры полимеры делят на термопластичные (термопласты) и термореактивные (реактопласты). Первые способны перерабатываться многократно, вторые – как правило, нет;
- по составу мономерных звеньев полимеры делят на гомополимеры и сополимеры (гетерополимеры);
- также полимеры разделяются по строению главной цепи на гомоцепные и гетероцепные, по пространственному расположению мономерных звеньев на стереорегулярные и атактические (нестереорегулярные), по степени разветвления на линейные, разветвленные, лестничные и сшитые и т.д.
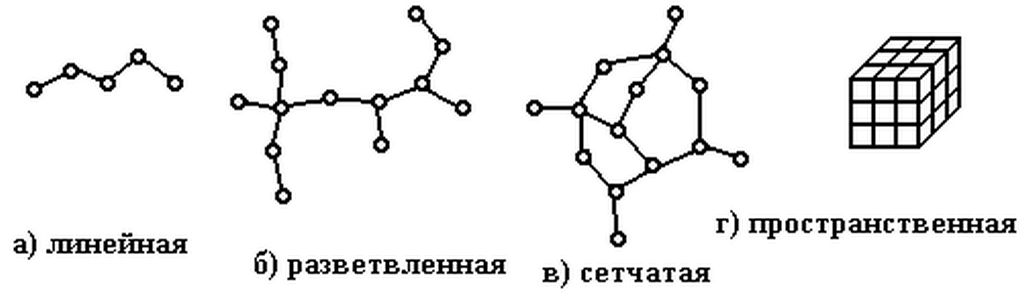
Рис. 1 Структура полимеров
Образование полимеров
В природе биологические полимеры или биополимеры получаются естественным путем в процессе жизнедеятельности растительных и животных организмов. Искусственные же полимеры производят как правило нефтехимические и газохимические предприятия путем двух основных видов химических реакций: полимеризации и поликонденсации
Полимеризация – это процесс синтеза полимера путем присоединения повторяющихся цепочек молекул (звеньев) мономера к активному центру роста макромолекулы высокомолекулярного соединения. В упрощенном виде механизм полимеризации можно расписать по следующим стадиям:
- образование центров полимеризации;
- рост макромолекул полимера при присоединения очередных звеньев;
- возникновение новых центров полимеризации на других молекулы и их интенсивный рост;
- возникновение разветвленных молекул полимеров;
- прекращение роста макромолекул.
Обычно полимеризация не возникает при нормальных условиях. Для начала химического процесса полимеризации на низкомолекулярное сырье оказывают разнообразные методы воздействия в зависимости от каждого конкретного техпроцесса: воздействие светом или другим типом облучением, повышенным давление, высокими температурами. При этом, наиболее эффективно процесс идет в среде катализатора, подбираемого для каждого конкретного процесса получения определенного полимера персонально. При образовании полимеров при помощи полимеризации не выделяется побочных веществ реакции, химический состав веществ остается неизменным, но меняется структура связей в веществе.

Рис. 2 Завод по производству полиэтилена
Поликонденсация – это процесс синтеза полимеров из низкомолекулярных веществ при помощи перегруппировки атомов выделения побочных продуктов поликонденсации. Это могут быть различные низкомолекулярные соединения, например вода. Методом поликонденсации выпускают такие крупнотоннажные полимеры, как полиуретаны, поликарбонаты, фенолоальдегидные смолы.
Основные свойства полимеров
Строение макромолекул в виде цепи, а также различные типы связей между ними, возникшие при образовании молекул, определяют природу специальных физико-химических характеристик полимеров. Среди них важная особенность к пленко- и волокнообразованию, способности полимеров к вытяжке, прочности в определенных направлениях, эластичности и т.п. Такое строение полимерных молекул определяет тот факт, что вязкость растворов полимеров обычно высока. ВМС могут в высокой степени набухать в жидкостях, при этом образуя несколько видов систем, по свойствам находящихся между твердым жидким агрегатным состояниями.
Количество мономерных звеньев в макромолекулах полимеров и природа звена определяют молекулярную массу всего ВМС. Любой полимер всегда состоит из множества макромолекул, каждая из которых индивидуальна и отличается от других в том числе по длине цепи. Из-за этого факта молекулярная масса полимеров – всегда примерная средняя величина. Также из описанного следует, что важной характеристикой является молекулярно-массовое распределение (ММР), которое показывает в каком диапазоне молекулярных масс молекулы представлены в конкретном образце полимера. Чем меньше молекулярно-массовое распределение, тем стабильнее свойства полимеров и тем проще описать методики их переработки.
Полимеры могут находиться в нескольких агрегатных состояниях, которые отличаются от состояний обычных низкомолекулярных веществ, например в состоянии вязкотекучей жидкости, эластичном состоянии, такие как каучук, силикон, другие эластомеры, твердых пластмасс.
Типы переработки полимеров в изделия
Несмотря на то, что в повседневной жизни термин «переработка пластмасс» используется в значении сбора и вторичного производства изделий из уже использованного пластика, на самом деле у термина несколько другой смысл. Переработкой полимеров называют получение готовых изделий из синтезированных ранее полимеров, в том числе первичных.
Переработка полимеров, как правило происходит при высоких температурах от 150 до 500 градусов Цельсия в зависимости от природы конкретного полимера. Исключение составляют некоторые термореактивные пластики, например двухкомпонентные разновидности эпоксидных смол или пенополиуретана, которые реагируют при комнатной температуре. При переработке в полимер могут вводить разные добавки (в случае, например, не применяющегося в качестве чистого вещества ПВХ, добавки практически обязательны) для лучшей перерабатываемости, придания пластмассе нужных свойств или удешевления продукта. Наиболее употребляемыми аддитивами (добавками для полимеров) являются , например, наполнители, красители, стабилизаторы, пластификаторы, модификаторы, нуклеаторы и т.д.
Классификация полимеров по областям применения
Полимеры, главным образом, термопласты подразделяют по степени роста технических и эксплуатационных характеристик. Основной характеристикой полимера при этом является температура долговременной эксплуатации. В данном случае полимеры с известными допущениями и довольно большими разночтениями у разных авторов разделяют на три категории:
- General purpose plastics или полимеры общего (общетехнического) назначения;
- Engineering plastics или конструкционные пластики (полимеры инженерно-технического назначения);
- Super-engineering plastics или суперконструкционные полимеры.
Также всё более важную роль в современной индустрии полимеров играет класс эластомеров или термоэластопластов (TPE, ТПЭ). По своим свойствам и методам переработки в изделия эти материалы аналогичны термопластам, при этом по внешнему виду и эксплуатационным свойствам близки к резине и каучуку. ТПЭ в быту повсеместно путают с резиной из-за способности этих материалов к значительным обратимым деформациям.
Также полимеры и их марки классифицируют по наиболее подходящему способу переработки – литьевые, экструзионные, пресс-порошки и т.п.
Объявления о покупке и продаже оборудования можно посмотреть на
Обсудить достоинства марок полимеров и их свойства можно на
Зарегистрировать свою компанию в Каталоге предприятий
Высокомолекулярные соединения. Реакции полимеризации и поликонденсации
Содержание:
Высокомолекулярные соединения – это полимеры, у которых молекулярная масса больше 10000. Полимер – это соединение, состоящее из большого числа звеньев – мономеров (низкомолекулярных веществ), которые повторяются в полимерной цепи большое количество раз .
Число n показывает, из скольких мономеров состоит полимер, и называется степенью полимеризации. Молекулярная масса иногда достигает нескольких миллионов.
Высокомолекулярные соединения классифицируются по характеру мономеров:
- гомополимеры – вещества, состоящие из одинаковых мономеров. Например, пропилен CH2=CH-CH3 – это мономер полипропилена (-CH(CH3)-CH2-)n;
- гетерополимеры – вещества, состоящие из двух разных мономеров. Например, при взаимодействии 1,3-дивинила и стирола получается стирольный каучук.
Полимеры получают с помощью:
- реакции полимеризации;
- реакции поликонденсации.
Реакции полимеризации
Реакции полимеризации заключаются в объединении большого количества низкомолекулярных соединений, количество которых определяется степенью полимеризации. Общее уравнение реакции:
Самой распространенной реакций полимеризации является реакция получения полиэтилена:
реакции полимеризации вступают непредельные соединения. Это могут быть молекулы одного мономера, либо разных. В первой ситуации реакцию называют гомополимеризацией, во второй – сополимеризацией.
I. Гомополимеризация
К этим реакциям относят получение полиэтилена, полипропилена поливинилхлорида и т.д. Например, получение полипропилена из пропена под действием ультрафиолетовых лучей:
II. Сополимеризация
К этим реакциям относят получение сополимера этилена и пропилена:
Полимеры, которые получают в результате реакций полимеризации
Формула
Название
Дивинил и стирол

Реакции поликонденсации
Реакции поликонденсации заключаются в образовании полимера из мономеров, а также выделении побочного низкомолекулярного вещества. В этих уравнениях исходные реактивы – молекулы мономера с функциональными группами.
I. Гомополиконденсация
К данным реакциям относят получение полимера из одного мономера с выделением конденсата. Например, получение полисахарида из глюкозы – этот процесс происходит в природе.
Синтетическое волокно получают в промышленности из аминоэнантовой кислоты под воздействием температуры, давления и катализатора в виде молекулярного азота.
II. Сополиконденсация
К данным реакциям относят получение полимера из нескольких мономеров с выделением конденсата. Например, получение фенолформальдегидной смолы из фенола и формальдегида в щелочной или подкисленной среде.
С помощью реакций сополиконденсации в промышленности получают полиэфиры, полиамины, полиакрил и т.д.
Характеристика полимеров
Полимеры – это соединения, которые имеют особые свойства и множество классификаций.


По способу получения высокомолекулярные вещества делятся на:
- природные (целлюлоза, крахмал, белки);
- искусственные (эфиры целлюлозы);
- синтетические (капрон, полиэтилен, тефлон).
Также по форме макромолекул:
- линейные (волокна, полиэтилен низкого давления);
- разветвленные (крахмал, полиэтилен высокого давления);
- пространственные (резина, кварц).
А еще по свойствам и применению:
- пластмассы;
- каучуки;
- волокна.
Все полимеры активно используются в отраслях жизнедеятельности человека.
Пластик (пластические массы) – полезные материалы, которые способны под воздействием температур или давления плавиться и при застывании оставлять заданную форму. Этот процесс сопровождается переходом из вязкотекучего в стеклообразное состояние. Главный компонент пластмассы – полимер, а остальные части – это наполнители, пластификаторы, красители и т.д.
Эластомеры – это высокомолекулярные соединения, которые обладают высокоэластичными свойствами. Каучуки используют для изготовления автомобильных шин, промышленных товаров и медицинских препаратов. Натуральный каучук получают из латекса (млечный сок каучуконосных растений). Получают по методу С.В. Лебедева с помощью полимеризации дивинила при действии металлического натрия.
Волокна – это высокомолекулярные соединения, для которых характерна строгая упорядоченность молекул и используется в изготовлении нитей. Существует три типа волокон, которые разделяются еще на несколько подтипов.

- Натуральные.
- Искусственного происхождения.
- Животного происхождения.
- Минерального происхождения.
- Искусственные.
- Ацетатное волокно.
- Вискозное волокно.
- Синтетические.
- Полиамидное волокно.
- Полиэфирное волокно.
Полимеры – это соединения, с помощью которых человечество способно изготавливать высокопрочные материалы и довольствоваться благами технологий.
Серная кислота – формула, свойства, способы получения и применения
Ключевые слова конспекта: соединения серы, серная кислота, участие в кислотно-основных и окислительно-восстановительных взаимодействиях, получение и применение серной кислоты.
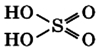
Серная кислота H2SO4 – вещество молекулярного строения. Её графическая формула:
В серной кислоте сера находится в высшей степени окисления +6.
Серная кислота представляет собой бесцветную маслянистую жидкость, хорошо растворимую в воде. Смешивается с водой в неограниченном количестве и очень гигроскопична. При растворении верной кислоты в воде выделяется значительное количество теплоты.
Химические свойства серной кислоты можно рассмотреть с точки зрения кислотно-основных и окислительно-восстановительных взаимодействий.
Участие в кислотно-основных взаимодействиях
- Серная кислота – сильный электролит, в водных растворах диссоциирует практически полностью:

Изменяет окраску индикатора (например, лакмуса с фиолетовой на красную).
Более корректно электролитическая диссоциация H2SO4 описывается уравнениями:

- Серная кислота реагирует с основными и амфотерными оксидами:
H2SO4 + CuO = CuSO4 + H2O
2Н + + CuO = Cu 2+ + H2O
- Серная кислoта реагирует с основаниями и амфотерными гидроксидами:
H2SO4 + Cu(OH)2 = CuSO4 + 2H20
2Н + + Cu(OH)2 = Cu 2+ + 2H2
- Сернaя кислота вытесняет более слабые кислоты из их солей:

- Сeрная кислота вытесняет и сильные, но летучие кислоты из их солей:

Участие в окислительно-восстановительных взаимодействиях
Разбавленные растворы H2SO4 реагируют с металлами, расположенными в электрохимическом ряду напряжений металлов до H2, с образованием сульфатов и выделением водорода:
Чистая H2SO4 и H2SO4 в концентрированных растворах проявляют сильные окислительные свойства за счёт S +6 .
Концентрированная H2SO4 взаимодействует с металлами (в том числе с Cu, Ag, Hg), стоящими после H2 в ряду напряжений металлов, с образованием сульфатов, воды и продуктов восстановления S +6 : H2S, S, SO2. Концентрированная серная кислота не реагирует с благородными металлами вследствие их малой активности, а также с Al, Cr, Fe из-за пассивации. На поверхности этих металлов образуется защитная оксидная плёнка, защищающая их от дальнейшего окисления.
Глубина восстановления зависит от восстановительных свойств металлов.
Активные металлы восстанавливают H2SO4 до H2S:
Металлы с меньшей активностью восстанавливают H2SO4 до SO2:
Концентрированная сeрная кислoта окисляет и некоторые неметаллы. Например:
Важной химической особенностью серной кислоты является её способность выступать в качестве дегидратирующего реагента. Концентрированная серная кислота вступает в реакции дегидратации со многими органическими веществами, отщепляя от них молекулы воды. Например:
Получение и применение серной кислоты
Промышленное получение серной кислоты включает несколько стадий. Сырьём является сера S и сульфидные руды (в основном пирит FeS2).
В ходе получения серной кислоты из пирита осуществляются три химические реакции:
- Обжиг пирита (проводится при температуре около 800 °С):
- Каталитическое окисление оксида серы (IV):

Эта реакция – обратимая, экзотермическая, каталитическая (её проводят в присутствии катализатора V2O5 при температуре около 450 °С).
Оксид серы (VI) (серный ангидрид) SO3 при обычных условиях – летучая жидкость (t°кип. = 44,8 °С), неограниченно растворяется в воде. Оксид серы (VI) SO3 – кислотный оксид, ему соответствует сильная серная кислота.
В промышленности для этой реакции используют концентрированную H2SO4, образуется олеум H2SO4 • SO3, при разбавлении которого получают концентрированную H2SO4.
Серная кислота – один из важнейших продуктов химической промышленности. Важнейшие области её применения: производство минеральных удобрений, других кислот и солей, красителей, пластмасс, волокон, лекарственных веществ, очистка нефтепродуктов, металлургия.
Конспект урока «Соединения серы: серная кислота». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Серная кислота
Серная кислота , H2SO4, сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях – тяжёлая маслянистая жидкость без цвета и запаха. В технике серную кислоту называют её смеси как с водой, так и с серным ангидридом. Если молярное отношение SO3 : Н2О меньше 1, то это водный раствор серной кислоты, если больше 1, – раствор SO3 в серной кислоте.
Природные залежи самородной серы сравнительно невелики. Общее содержание серы в земной коре составляет 0,1%. Сера содержится в нефти, каменном угле, горючих и топочных газах. Чаще сера встречается в природе в виде соединений с цинком, медью и другими металлами. Следует отметить, что доля колчедана и серы в общем балансе сернокислотного сырья постепенно уменьшается, а доля серы, извлекаемой из различных отходов, постепенно возрастает. Возможности получения серной кислоты из отходов весьма значительны. Использование отходящих газов цветной металлургии позволяет получать, без специальных затрат в сернокислотных системах на обжиг серосодержащего сырья.
Физические и химические свойства серной кислоты
Стопроцентная H2SO4 (SO3 х H2O) называется моногидратом. Соединение не дымит, в концентрированном виде не разрушает черные металлы, являясь при этом одной из самых сильных кислот;
- вещество пагубным образом действует на растительные и животные ткани, отнимая и них воду, вследствие чего они обугливаются.
- кристаллизуется при 10,45 “С;
- tkип 296,2 “С;
- плотность 1,9203 г/см3;
- теплоёмкость 1,62 дж/г.
Серная кислота смешивается с Н2О и SO3 в любых соотношениях, образуя соединения:
- H2SO4 х 4 H2O (tпл – 28,36 “С),
- H2SO4 х 3 H2O (tпл – 36,31 “С),
- H2SO4 х 2 H2O (tпл – 39,60 “С),
- H2SO4 х H2O (tпл – 8,48 “С),
- H2SO4 х SO3 (H2S2O7 – двусерная или пиросерная кислота, tпл 35,15 “С) – олеум,
- H2SO х 2 SO3 (H2S3O10 – трисерная кислота, tпл 1,20 “C).
При нагревании и кипении водных растворов серной кислоты, содержащих до 70% H2SO4, в паровую фазу выделяются только пары воды. Над более концентрированными растворами появляются и пары серной кислоты. Раствор 98,3% H2SO4 (азеотропная смесь) при кипении (336,5 “С) перегоняется полностью. Серная кислота, содержащая свыше 98,3% H2SO4, при нагревании выделяет пары SO3.
Концентрированная серная кислота – сильный окислитель. Она окисляет HI и НВг до свободных галогенов. При нагревании окисляет все металлы, кроме Au и платиновых металлов (за исключением Pd). На холоде концентрированная серная кислота пассивирует многие металлы, в том числе РЬ, Cr, Ni, сталь, чугун. Разбавленная серная кислота реагирует со всеми металлами (кроме РЬ), предшествующими водороду в ряду напряжении, например: Zn + H2SO4 = ZnSO4 + Н2.
Как сильная кислота H2SO4 вытесняет более слабые кислоты из их солей, например борную кислоту из буры:
Na2B4O7 + H2SO4 + 5 H2O = Na2SO4 + 4 H2BO3,
а при нагревании вытесняет более летучие кислоты, например:
NaNO3 + H2SO4 = NaHSO4 + HNO3.
Серная кислота отнимает химически связанную воду от органических соединений, содержащих гидроксильные группы – ОН. Дегидратация этилового спирта в присутствии концентрированной серной кислоты приводит к получению этилена или диэтилового эфира. Обугливание сахара, целлюлозы, крахмала и других углеводов при контакте с серной кислотой объясняется также их обезвоживанием. Как двухосновная, серная кислота образует два типа солей: сульфаты и гидросульфаты.
| Температура замерзания серной кислоты: | |
| концентрация, % | темп.замерз., “С |
| 74,7 | -20 |
| 76,4 | -20 |
| 78,1 | -20 |
| 79,5 | -7,5 |
| 80,1 | -8,5 |
| 81,5 | -0,2 |
| 83,5 | 1,6 |
| 84,3 | 8,5 |
| 85,7 | 4,6 |
| 87,9 | -9 |
| 90,4 | -20 |
| 92,1 | -35 |
| 95,6 | -20 |
Сырьё для получения серной кислоты
Сырьём для получения серной кислоты могут служить: сера, серный колчедан FeS2, отходящие газы печей окислительного обжига сульфидных руд Zn, Сu, РЬ и других металлов, содержащие SO2. В России основное количество серной кислоты получают из серного колчедана. Сжигают FeS2 в печах, где он находится в состоянии кипящего слоя. Это достигается быстрым продуванием воздуха через слой тонко измельченного колчедана. Получаемая газовая смесь содержит SO2, O2, N2, примеси SO3, паров Н2О, As2O3, SiO2 и другие, и несёт много огарковой пыли, от которой газы очищаются в электрофильтрах.
Способы получения серной кислоты
Серную кислоту получают из SO2 двумя способами: нитрозным (башенным) и контактным.
Переработка SO2 в серную кислоту по нитрозному способу осуществляется в продукционных башнях – цилиндрических резервуарах (высотой 15 м и более), заполненных насадкой из керамических колец. Сверху, навстречу газовому потоку разбрызгивается “нитроза” – разбавленная серная кислота, содержащая нитрозилсерную кислоту NOOSO3H, получаемую по реакции:
N2O3 + 2 H2SO4 = 2 NOOSO3H + H2O .
Окисление SO2 окислами азота происходит в растворе после его абсорбции нитрозой. Водою нитроза гидролизуется:
NOOSO3H + H2O = H2SO4 + HNO2.
Сернистый газ, поступивший в башни, с водой образует сернистую кислоту:
SO2 + H2O = H2SO3.
Взаимодействие HNO2 и H2SO3 приводит к получению серной кислоты:
2 HNO2 + H2SO3 = H2SO4 + 2 NO + H2O.
Выделяющаяся NO превращается в окислительной башне в N2O3 (точнее в смесь NO + NO2). Оттуда газы поступают в поглотительные башни, где навстречу им сверху подаётся серная кислота. Образуется нитроза, которую перекачивают в продукционные башни. Таким образом осуществляется непрерывность производства и круговорот окислов азота. Неизбежные потери их с выхлопными газами восполняются добавлением HNO3.
Серная кислота, получаемая нитрозным способом, имеет недостаточно высокую концентрацию и содержит вредные примеси (например, As). Её производство сопровождается выбросом в атмосферу окислов азота (“лисий хвост”, названный так по цвету NO2).
Принцип контактного способа производства серной кислоты был открыт в 1831 П. Филипсом (Великобритания). Первым катализатором была платина. В конце 19 – начале 20 вв. было открыто ускорение окисления SO2 в SO3 ванадиевым ангидридом V2O5. Особенно большую роль в изучении действия ванадиевых катализаторов и их подборе сыграли исследования советских учёных А. Е. Ададурова, Г. К. Борескова, Ф. Н. Юшкевича.
Современные сернокислотные заводы строят для работы по контактному методу. В качестве основы катализатора применяются окислы ванадия с добавками SiO2, Al2O3, K2O, CaO, BaO в различных соотношениях. Все ванадиевые контактные массы проявляют свою активность только при температуре не ниже
420 “С. В контактном аппарате газ проходит обычно 4 или 5 слоев контактной массы. В производстве серной кислоты контактным способом обжиговый газ предварительно очищают от примесей, отравляющих катализатор. As, Se и остатки пыли удаляют в промывных башнях, орошаемых серной кислотой. От тумана серную кислоту (образующейся из присутствующих в газовой смеси SO3 и H2O) освобождают в мокрых электрофильтрах. Пары H2O поглощаются концентрированной серной кислотой в сушильных башнях. Затем смесь SO2 с воздухом проходит через катализатор (контактную массу) и окисляется до SO3:
SO2 + 1/2 O2 = SO3.
Серный ангидрид далее поглощается водой, содержащейся в разбавленной H2SO4:
SO3 + H2O = H2SO4.
В зависимости от количества воды, поступившей в процесс, получается раствор серной кислоты в воде или олеум.
Посредством данного метода сейчас вырабатывается порядка 80% H2SO4 в мире.
Применение серной кислоты
Серная кислота может служить для очистки нефтепродуктов от сернистых, непредельных органических соединений.
В металлургии серная кислота применяется для удаления окалины с проволоки, а также листов перед лужением и оцинкованием (разбавленная), для травления разичных металлических поверхностей перед покрытием их хромом, медью, никелем и др. Также с помощью серной кислоты разлагают комплексные руды (в частности, урановые).
В органическом синтезе серная кислота концентрированная является необходимым компонентом нитрующих смесей, а также сульфирующим средством при получении многих красителей и лекарственных веществ.
Широко применяется серная кислота для производства удобрений, этилового спирта, искусственного волокна, капролактама, двуокиси титана, анилиновых красителей и целого ряда других химических соединений.
Серная кислота отработанная (отход) применяется в химической, металлургической, деревообрабатывающей и других отраслях промышленности Серная кислота аккумуляторная применяется в производстве свинцово-кислотных источников тока.
Серная кислота
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
Серная кислота
Серная кислота – сильная двухосновная кислота, при н.у. маслянистая жидкость без цвета и запаха.
Обладает выраженным дегидратационным (водоотнимающим) действием. При попадании на кожу или слизистые оболочки приводит к тяжелым ожогам.
Замечу, что существует олеум – раствор SO3 в безводной серной кислоте, дымящее жидкое или твердое вещество. Олеум применяется при изготовлении красителей, органическом синтезе и в производстве серной кислот.

Получение
Известны несколько способов получения серной кислоты. Применяется промышленный (контактный) способ, основанный на сжигании пирита, окислении образовавшегося SO2 до SO3 и последующим взаимодействием с водой.

Нитрозный способ получения основан на взаимодействии сернистого газа с диоксидом азота IV в присутствии воды. Он состоит из нескольких этапов:
В окислительной башне смешивают оксиды азота (II) и (IV) с воздухом:
Смесь газов подается в башни, орошаемые 75-ной% серной кислотой, здесь смесь оксидов азота поглощается с образованием нитрозилсерной кислоты:
В ходе гидролиза нитрозилсерной кислоты получают азотистую кислоту и серную:
В упрощенном виде нитрозный способ можно записать так:

Химические свойства
- Кислотные свойства
В водном растворе диссоциирует ступенчато.
Сильная кислота. Реагирует с основными оксидами, основаниями, образуя соли – сульфаты.
KOH + H2SO4 = KHSO4 + H2O (гидросульфат калия, соотношение 1:1 – кислая соль)
2KOH + H2SO4 = K2SO4 + 2H2O (сульфат калия, соотношение 2:1 – средняя соль)

С солями реакция идет, если в результате выпадает осадок, образуется газ или слабый электролит (вода). Серная кислота, как и многие другие кислоты, способна растворять осадки.

Серная кислота окисляет неметаллы – серу и углерод – соответственно до угольной кислоты (нестойкой) и сернистого газа.
Реакции с металлами
Реакции разбавленной серной кислоты с металлами не составляют никаких трудностей: она реагирует как самая обычная кислота, например HCl. Все металлы, стоящие до водорода, вытесняют из серной кислоты водород, а стоящие после – не реагируют с ней.
Подчеркну, что реакции разбавленной серной кислоты с железом и хромом не сопровождаются переходом этих элементов в максимальную степень окисления. Они окисляются до +2.
Cu + H2SO4(разб.) ⇸ (реакция не идет, медь не может вытеснить водород из кислоты)

Концентрированная серная кислота ведет себя совершенно по-иному. Водород никогда не выделяется, вместо него с активными металлами выделяется H2S, с металлами средней активности – S, с малоактивными металлами – SO2.


Холодная концентрированная серная кислота пассивирует Al, Cr, Fe, Ni, Be, Co. При нагревании или амальгамировании данных металлов реакция идет.
Обратите особое внимание, что при реакции железа, хрома с концентрированной серной кислотой достигается степень окисления +3. В подобных реакциях с разбавленной серной кислотой (написаны выше) достигается степень окисления +2.

Иногда в тексте задания даны подсказки. Например, если написано, что выделился газ с неприятным запахом тухлых яиц – речь идет об H2S, если же написано, что выделилось простое вещество – речь о сере (S).
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Серная кислота (H2SO4)
Молекула серной кислоты имеет крестовидную форму:
Физические свойства серной кислоты:
- плотная маслянистая жидкость без цвета и запаха;
- плотность 1,83 г/см 3 ;
- температура плавления 10,3°C;
- температура кипения 296,2°C;
- очень гигроскопична, смешивается с водой в любых отношениях;
- при растворении концентрированной серной кислоты в воде происходит выделение большого кол-ва тепла ( ВАЖНО ! Приливают кислоту в воду! Воду в кислоту приливать нельзя. )
Серная кислота бывает двух видов:
- разбавленная H2SO4(разб) – водный раствор кислоты, в котором процентное содержание H2SO4 не превышает 70%;
- концентрированная H2SO4(конц) – водный раствор кислоты, в котором процентное содержание H2SO4 превышает 70%;
Химические свойства H2SO4
Серная кислота полностью диссоциирует в водных растворах в две ступени:
Разбавленная серная кислота проявляет все характерные свойства сильных кислот, вступая в реакции:
- с основными оксидами:
- с основаниями:
- с солями:
В окислительно-восстановительных реакциях серная кислота выступает в роли окислителя, при этом, в разбавленной H2SO4 роль окислителей играют катионы водорода (H + ), а в концентрированной – сульфат-ионы (SO4 2- ) (более сильные окислители, чем катионы водорода).
- разбавленная серная кислота:
H2 +1 S +6 O4 -2
окислитель H + : 2H + +2e – → H2 0 ↑ - концентрированная серная кислота:
H2 +1 S +6 O4 -2
окислитель S +6 :- S +6 +2e – → S +4 (SO2)
- S +6 +6e – → S 0 (S)
- S +6 +8e – → S -2 (H2S)
Разбавленная серная кислота реагирует с металлами, стоящими в электрохимическом ряду напряжений левее водорода (реакция проходит с образованием сульфатов и выделением водорода):

С металлами, стоящими правее водорода (медь, серебро, ртуть, золото), разбавленная серная кислота не реагирует.
Концентрированная серная кислота является более сильным окислителем, особенно это проявляется при нагревании. Концентрированная серная кислота не реагирует только с золотом, с остальными металлами, стоящими правее водорода, кислота взаимодействует с образованием сульфатов и сернистого газа. Более активными металлами (цинк, алюминий, магний) концентрированная серная кислота восстанавливается до свободной серы или сероводорода.
С остальными металлами серная кислота взаимодействует с образованием сернистого газа, серы или сероводорода (конкретный продукт восстановления серной кислоты зависит от ее концентрации):
Концентрированная серная кислота окисляет некоторые неметаллы, восстанавливаясь до сернистого газа:
При низких температурах концентрированная серная кислота пассивирует некоторые металлы (железо, алюминий, никель, хром, титан), что дает возможность ее промышленной перевозки в железных цистернах.
Получение и применение серной кислоты
Серную кислоту в промышленности получают двумя способами: контактным и нитрозным.
Контактный способ получения H2SO4:
- На первом этапе получают сернистый газ путем обжига серного колчедана:
- На втором этапе, сернистый газ окисляют кислородом воздуха до серного ангидрида, реакция идет в присутствии оксида ванадия, играющего роль катализатора:
- На третьем, последнем этапе, получают олеум, для этого серный ангидрид растворяют в концентрированной серной кислоте:
- В дальнейшем олеум транспортируется в железных цистернах, а серная кислота получается из олеума разбавлением водой:
Нитрозный способ получения H2SO4:
- На первом этапе очищенный от пыли сернистый газ обрабатывается серной кислотой, в которой растворена нитроза (оксид азота):
- Выделившийся оксид азота окисляется кислородом и снова поглощается серной кислотой:
Применение серной кислоты:
- для осушки газов;
- в производстве других кислот, солей, щелочей и проч.;
- для получения удобрений, красителей, моющих средств;
- в органическом синтезе;
- в производстве органических веществ.
Соли серной кислоты
Поскольку серная кислота является двухосновной кислотой, она дает два вида солей: средние соли (сульфаты) и кислые соли (гидросульфаты).
Сульфаты хорошо растворяются в воде, исключение составляют CaSO4, PbSO4, BaSO4 – первые два плохо растворяются, а сульфат бария практически нерастворим. Сульфаты, в состав которых входит вода, называются купоросами (медный купорос – CuSO4·5H2O).
Отличительной особенностью солей серной кислоты является их отношение к нагреванию, например, сульфаты натрия, калия, бария устойчивы к нагреванию, не разлагаясь даже при 1000°C, в то же время, сульфаты меди, алюминия, железа разлагаются даже при незначительном нагревании с образованием оксида металла и серного ангидрида: CuSO4 = CuO+SO3.
Горькая (MgSO4·7H2O) и глауберова (Na2SO4·10H2O) соль используются в качестве слабительного средства. Сульфат кальция (CaSO4·2H2O) – при изготовлении гипсовых повязок.
Если вам понравился сайт, будем благодарны за его популяризацию  Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе





