Железо, его соединения
Урок 14. Химия 9 класс ФГОС

В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности



Конспект урока “Железо, его соединения”
Железо, его соединения
Сначала рассмотрим особенностей строение атома железа.
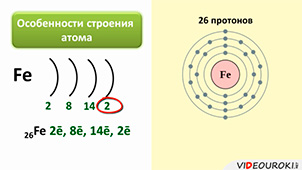
Железо является элементом побочной подгруппы VIII A группы. Поэтому его электронное строение отличается от строения электронных оболочек элементов главных подгрупп. Так как железо расположено в 4 периоде, то атомы его имеют четыре энэргетических уровня, к тому же заполняется у него сначала не внешний, а предвнешний энэргетический уровень. В ядре атома железа содержится 26 протонов. На внешнем энэргетическом уровне у атома железа находится два электрона, а на предвнешнем – 14.
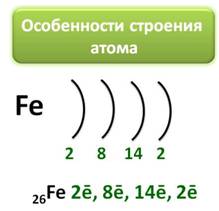
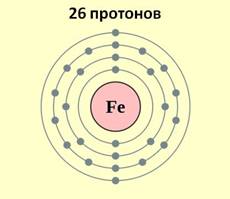
Железо имеет на внешнем энэргетическом уровне два электрона, является металлом, поэтому как и все металлы он отдаёт электроны и проявляет восстановительные свойства. Если атом железа отдаёт два внешних электрона, тогда он приобретает степень окисления +2, к тому же электрон с предвнешнего уровня тоже может оторваться, тогда степень окисления становится +3.

Рассмотрим железо, как простое вещество.
· блестящий серебристо-белый металл
· имеет темературу плавления 1539 0 С
· плотность железа 7,87 г/см 3
· железо пластичное и ковкое, поэтому легко обрабатывается
· обладает способностью намагничиваться и размагничиваться.
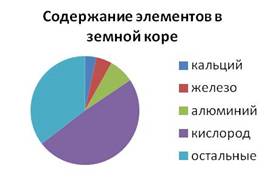
По распространённости в земной коре железо занимает четвёртое место и второе среди металлов (после алюминия). Его массовая доля в земной коре составляет четыре целых шестьдесят пять сотых процента.
Железо образует ряд минералов:
· магнитный железняк, или магнетит Fe3O4
· красный железняк, или гематит Fe2O3
· бурый железняк, или лимонит 2 Fe2O3 ∙ 3 H2O
· большое значение имеет и железный колчедан, или пирит FeS2 который используют при произвостве серной кислоты
· в природных и некоторых минеральных водах встречается гидрокарбонат железа – Fe(HCO3)2
Вообще, различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, содержащую 0,02 – 0,04 % углерода, а также небольшое содержание кислорода, серы, азота и фосфора. Химически чисто железо содержит 0,01 % примесей.
Из технически чистого железа сделаны канцелярские скрепки, кнопки, но оно легко корродирует.


Химически чистое железо, напротив, почти не корродирует. Вот почему железная колонна в Дэли, построенная ещё в пятнадцатом веке не ржавеет, потому что она сделана из чистого железа.

С железом человек знаком очень давно. Считается, что первое железо было метеоритного происхождения. В переводе с древнего шумерского языка «железо» ― это «капнувший с неба, небесный». В настоящее время зафиксировано около пятисот железных метеоритов. Самый крупный железный метеорит массой шестьдесят тонн найден более семидесяти лет назад в Юго-Западной Африке, второй по величине – массой тридцать тонн – столетием раньше в Гренландии.



Алхимики обозначали железо в виде копья и щита, которые символизировали бога войны Марса.

Для современного человека железо играет огромную роль, ведь имеено оно составляет основу техники и машиностроения. Железо как никакой другой металл способен изменять свои технические характеристики в результате легирования и специальной обработки. В настоящее время известно очень много сплавов этого металла, отличающихся разнообразием свойств:
· устойчивые в морской воде
· выдерживающие действие высоких температур и агрессивных сред
· мягкие для производства проволоки
· жёсткие для производства пружин
· магнитные и немагнитные.
Широко используются чугун и сталь. Оксид железа (III) используется как пигмент в производстве красок (охра).
Железо можно получить восстановлением из железных руд углеродом (коксом), оксидом углерода два, водородом, алюминием, то есть пирометаллургическим способом.

Изучая химические свойства железа, следует учитывать, что оно может иметь степень окисления +2 и +3. Это всё зависит от окислительной способности тех веществ, с которыми реагирует железо.
Железо реагирует с простыми и сложными веществами. Однако оно малоактивно при обычных условиях.
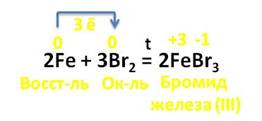
Например, в реакции с галогенами (кроме йода) железо образует галогениды, в которых его степень окисления его +3. В реакции с бромом каждый атом железа отдаёт по 3 электрона молекуле брома. При этом образуется бромид железа (III), где степень окисления железа +3, а брома – -1. В этой реакции железо выступает в роли восстановителя, а бром – в роли окислителя.
В реакции с серой железо образует сульфид железа (II), в котором степень окисления железа +2, а серы – -2. В данной реакции каждый атом железа отдаёт по 2 электрона молекуле серы. Причём, железо является восстановителем, а сера – окислителем.

А вот в реакции железа с кислородом, образуется железная окалина, состоящая из оксидов железа (II) и (III). В этой реакции 3 атома железа отдаёт 8 электронов молекуле кислорода, выступая в роли восстановителя, а кислород – в роли окислителя.
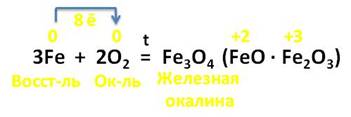
Железо реагирует и со сложными веществами.
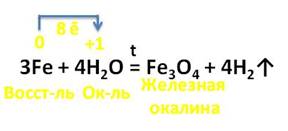
Например, с парами воды железо реагирует при нагревании, при этом образуется опять железная окалина и выделяется водород. Здесь также три атома железа отдают 8 электронов ионам водорода, железо является восстановителем, а ионы водорода – окислителем.
Железо взаимодействует с растворами солей, оно вытесняет металлы, которые стоят правее его в электрохимическом ряду напряжений металлов. Например, в реакции с раствором сульфата меди (II), железо вытесняет медь. В этой реакции железо повышает свою степень окисления с 0 до +2, а медь, наоборот, понижает свою степень окисления с +2 до 0. Каждый атом железа отдаёт по 2 электрона ионам меди. Железо выступает в роли восстановителя, а медь – в роли окислителя.
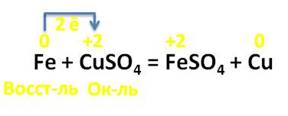
С растворами кислот железо также реагирует. Например, в реакции с разбавленной соляной кислотой железо окисляется до соли железа со степенью окисления железа +2. Эту реакцию можно наблюдать наглядно: для этого следует налить в пробирку раствора соляной кислоты и поместить туда кусочек железа, при этом можно наблюдать выделение пузырьков газа. Это выделяется водород. Причём ещё образуется и соль – хлорид железа (II).
В уравнении реакции каждый атом железа отдаёт по два электрона ионам водорода. Железо изменяет свою степень окисления с 0 до +2, при этом является восстановителем, а водород понижает свою степень окисления с +1 до 0 и ионы водорода являются окислителем.

А концентрированная серная и азотная кислоты не реагируют с железом, потому что они пассивируют его, образуя на поверхности металла прочную оксидную плёнку.

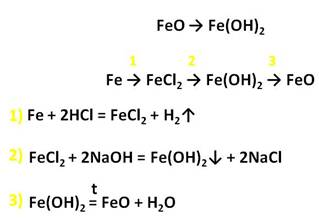
У железа со степенью окисления +2 есть ряд соединений. Например, FeO – оксид железа (II) и гидроксид желза два. Прямой реакцией получить гидроксид железа два из оксида железа два невозможно, нужно сначала получить соль железа, а только потом гидроксид.
Осуществим следующие превращения: получим хлорид железа (II) из железа, затем из хлорида железа (II) получим гидроксид железа (II), а потом и оксид железа (II).
Для того, чтобы получить хлорид железа (II) в первой стадии, необходимо, чтобы железо прореагировало с разбавленной соляной кислотой, затем к хлориду железа (II) следует добавить щёлочь, например, гидроксид натрия. Таким образом, мы получим гидроксид железа (II), а прокаливая нерастворимое в воде основание гидроксид железа (II) мы сможем получить и оксид железа (II).
Оксид и гидроксид железа (II) обладает ярко выраженными основными свойствами и реагируют с кислотами. В резульате данных реакций образуются соли железа, в которых степень окисления железа +2.

Оксид железа (II) представляет собой порошок чёрного цвета. Его получают восстановлением оксида железа (III) оксидом углерода (II).

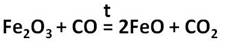
Ионы железа легко окисляются кислородом воздуха или другими окислителями до иона железа +3. Из-за этого окисления зелёный осадок гидроксида железа (II) превращается в гидроксид железа (III) бурого цвета.
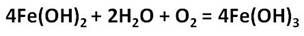
Железо образует и соединения со степенью окисления +3. Это оксид и гидроксид железа (III) , которые получают также косвенным путём. Например, осуществим превращения: получим хлорид железа (III) из железа, затем из хлорида железа (III) следует получить гидроксид железа (III) , а потом оксид железа (III) .
Для получения хлорида железа (III) , нужно, чтобы в реакцию вступило железо с хлором, затем к хлориду железа (III) добавим щёлочь – гидроксид калия и получим гидроксид железа (III) , при нагревании этот гидроксид образует оксид железа (III) и воду.
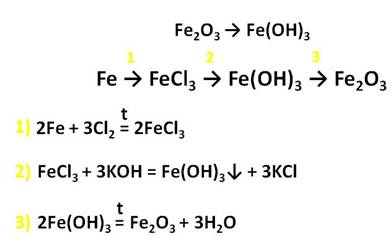
Оксид железа (III) – Fe2O3 – порошок бурого цвета, его получают разложением гидроксида железа (III).

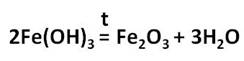
Оксид и гидроксид железа (III) проявляют слабовыраженные амфотэрные свойства и легко реагируют с кислотами, в результате чего образуются соли железа, в которых его степень окисления +3.
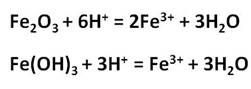
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании с образованием ферритов: в результате взаимодействия оксида железа (III) с гидроксидом натрия, образуется феррит натрия, в результате взаимодействия гидроксида железа (III) с гидроксидом натрия, образуется также феррит натрия.
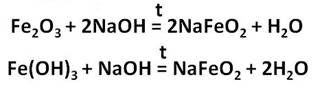
Получим гидроксиды железа (II) и (III) и исследуем их свойства. Для этого, нальём в две пробирки соль железа – хлорида железа (II) и хлорида железа (III). А затем добавим в каждую из них раствора щёлочи, после чего мы можем наблюдать выпадение осадков: в первой пробирке осадок белого цвета, который становится сразу зелёного цвета, а во второй – осадок бурого цвета. Однако со временем, осадок в первой пробирке начинает приобретать бурую окраску за счёт окислительных процессов. Если добавить к этим двум осадкам раствора серной кислоты, то осадок растворяется и в первой и во второй пробирке.
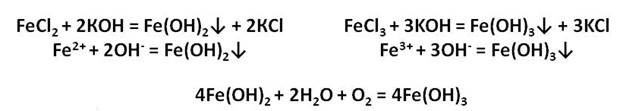
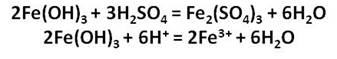
Соли железа имеют большое значение. Так кристаллогидрат сульфата железа (II) FeSO4 ∙ 7H2O, или железный купорос используется для борьбы с вредителями растений и при приготовлении минеральных красок, а также для обработки древесины.



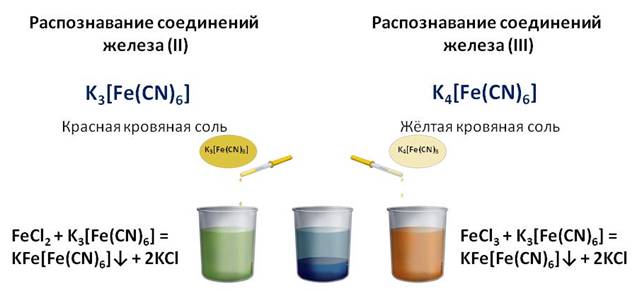
Для распознавания соединений железа (II) и (III) проводят качественные реакции на эти ионы. Так, качественной реакцией на ион железа (II) служит реакция с красной кровяной солью, а реактивом на ион железа (III) является жёлтая кровяная соль. Если к соединениям железа (II) и (III) добавить соответственно красной и жёлтой кровяной соли, то в обоих случаях образуется синий осадок.
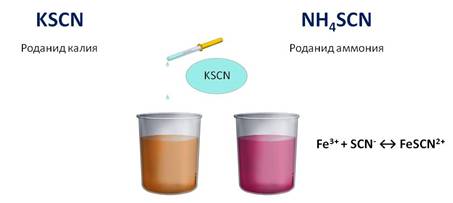
Для обнаружения ионов железа (III) можно использовать и роданид калия или аммония. При этом образуется раствор кроваво-красного цвета.
Роль железа в жизнедеятельности очень велика. Массовая доля железа в животных организмах составляет около одной сотой процента. В организме человека содержится около пяти г железа, главным образом в составе гемоглобина, фермента каталазы. Соединения железа применяют при лечении малокровия, истощении, упадке сил. Суточная потребность человека в железе составляет около пятнадцать тысячных грамма. Железо содержится в шпинате, салате, капусте, чёрной смородине, мясе, сливовом соке, кураге, изюме, семечках тыквы и подсолнуха, чёрном хлебе и других продуктах.
Железо и его соединения
Цели. Познакомить с положением железа в периодической системе химических элементов Д.И.Менделеева, строением атома, природными месторождениями, соединениями, современными методами получения, свойствами и применением железа. Способствовать выработке у школьников навыков коллективного труда и товарищеской взаимопомощи.
Оборудование и реактивы. Пробирки, таблицы по доменному производству; растворы HCl и H2SO4, порошки Fe(OH)2 и Fe(OH)3, железные опилки, растворы желтой кровяной соли K4[Fe(CN)6] и красной кровяной соли K3[Fe(CN)6].
Тип урока. Элементы лекции, рассказ, беседа.
ХОД УРОКА
Учитель. Сегодня мы продолжим речь о металлах, вы узнаете о положении железа в периодической системе химических элементов, о строении его атома, о химических свойствах металла железа, его соединениях, получении и применении, роли железа в развитии человеческого общества. Какова роль железа в человеческом обществе?
Ученик. Железо сыграло большую роль в развитии человеческого общества и не потеряло своего значения в настоящее время. Из всех металлов оно наиболее широко используется в современной промышленности.
Первобытный человек начал использовать железные орудия труда за несколько тысячелетий до нашей эры. В те годы единственным источником этого металла были упавшие на землю метеориты, которые содержат довольно чистое железо. В середине 2-го тысячелетия до
н. э. в Египте была освоена металлургия железа – получение его из железных руд. Это событие стало началом железного века в истории человечества, который пришел на смену каменному и бронзовому векам. На территории России начало железного века относится к рубежу 2–1-го тысячелетий до н. э.
Учитель. Каково распространение железа в природе?
Ученик. Железо – один из самых распространенных элементов в природе. В земной коре его массовая доля составляет 5,1%, по этому показателю оно уступает только кислороду, кремнию и алюминию. Много железа находится и в небесных телах, что установлено по данным спектрального анализа. В образцах лунного грунта, которые доставила советская автоматическая станция «Луна», обнаружено железо в неокисленном состоянии.
Учитель. В виде каких соединений железо встречается в природе?
Ученик. Железо входит в состав большинства горных пород. Для получения железа используют железные руды с содержанием железа 30–70% и более. (Пользуясь физической картой России, ученик показывает и называет месторождения соединений железа.)
Основными железными рудами являются:
Магнетит
– магнетит Fe3O4 – содержит 72% железа, месторождения магнетита встречаются на Южном Урале, Курской магнитной аномалии;
Гематит
– гематит Fe2O3 – содержит до 65% железа, такие месторождения железа встречаются в Криворожском районе;
– лимонит Fe2O3•nH2O – содержит до 60% железа, месторождения лимонита встречаются в Крыму, например керченское месторождение;
– пирит FeS2 – содержит примерно 47% железа, месторождения пирита встречаются на Урале.
Учитель. Как получают железо в промышленности?
Ученик. В настоящее время основным промышленным способом переработки железных руд является производство чугуна доменным процессом. Чугун – это сплав железа, содержащий
2,2–4% углерода, а также кремний, марганец, фосфор, серу. В дальнейшем большая часть чугуна подвергается переделу в сталь. Сталь отличается от чугуна главным образом меньшим содержанием углерода (до 2%), фосфора и серы.
Учитель. Большое внимание уделяется разработке методов прямого получения железа из руд без осуществления доменного процесса. В чем преимущество прямого получения железа? Главное состоит в том, что восстановление оксидов железа можно проводить без участия металлургического кокса. Его заменяют более дешевым и распространенным топливом – бурым углем, природным газом. При прямом получении железа можно использовать и бедные железные руды, шлаки других производств, содержащие железо.
Прямое восстановление железа проводят в слегка наклоненных вращающихся печах, похожих на печи, в которых получают цемент. В печь непрерывно загружают руду и уголь, которые постепенно перемещаются к выходу, противотоком идет нагретый воздух, создается температура ниже точки плавления железа.
Чтобы получить технически чистое железо прямым восстановлением, руду подвергают обогащению. При этом удается повысить массовую долю железа, отделить пустую породу (куски железа легко отделяются от шлака) и снизить содержание вредных примесей (серы и фосфора). В процессе обогащения руду измельчают в дробильных установках и подают в магнитный сепаратор. Последний представляет собой барабан с электромагнитами, в который при помощи транспортера подается измельченная руда. Пустая порода свободно проходит через магнитное поле и падает. Зерна руды, содержащие магнитные минералы железа, намагничиваются и отделяются от барабана позднее пустой породы. Такую магнитную сепарацию можно проводить несколько раз.
Затем руду обогащают методом флотации. Для этого руду помещают в емкость с водой, где растворяют флотационные поверхностно-активные вещества, которые избирательно абсорбируются на поверхности полезного минерала. В результате абсорбции флотореагента частицы минерала не смачиваются водой и в ней не тонут. Через раствор пропускают воздух, пузырьки которого прикрепляются к кусочкам минерала и поднимают их на поверхность. Частицы пустой породы хорошо смачиваются водой и оседают на дне емкости. Обогащенную руду собирают с поверхности раствора вместе с пеной. В результате содержание железа в руде может быть повышено до 70–72%.
Рассмотрим схему одного из способов прямого получения железа. Процесс проводят в вертикальной печи, в которую сверху подают обогащенную руду, а снизу – газ, служащий восстановителем. Этот газ получают сжиганием природного в недостатке кислорода. Восстановительный газ содержит 30% СО, 55% Н2, 13% Н2О и 2% СО2. Следовательно, восстановителями служат оксид углерода(II) СО и водород:
Восстановление ведут при температуре 850–900 °С, что ниже температуры плавления железа (1539 °С).
Для многих современных отраслей техники требуется железо очень высокой степени чистоты. Тогда очистку технического железа проводят карбонильным методом. Карбонилы – это соединения металлов с оксидом углерода(II) СО. Железо взаимодействует с СО при повышенном давлении и температуре 100–200 °С, образуя пентакарбонил железа:
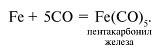
Пентакарбонил железа – жидкость, которую легко можно отделить от примесей перегонкой. При температуре около 250 °С карбонил легко разлагается, образуя порошок железа:
Fe(CO)5 = Fe + 5CO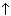 .
.
Если полученный порошок подвергнуть спеканию в вакууме, то получится металл, содержащий 99,98–99,999% железа. Зачем нужно получать металл такой степени чистоты?
Ученик. Железо высокой степени чистоты нужно прежде всего для изучения его свойств, т.е. для научных целей. Если бы не удалось получить чистое железо, то не узнали бы, что это – мягкий, легко обрабатывающийся металл. Химически чистое железо намного более инертно, чем железо техническое. Важной отраслью использования чистого железа является производство специальных ферросплавов, свойства которых ухудшаются от присутствия примесей.
Учитель. Каковы же химические свойства железа?
Ученик. Химические свойства железа обусловлены строением электронных оболочек его атомов. Железо – элемент побочной подгруппы VIII группы 4-го большого периода. Железо относится к d-элементам, электронная формула атома имеет окончание …3d 6 4s 2 . Железо в соединениях проявляет степени окисления +2 и +3. Максимальная степень окисления железа +6. Она проявляется в ферратах – солях несуществующей железной кислоты. Например, Na2FeО4 – феррат натрия.
Учитель. Как реагирует железо с кислородом?
Ученик. В электрохимическом ряду напряжений железо стоит левее водорода, т. е. имеет более отрицательный стандартный электродный потенциал. Поэтому железо легко растворяется в соляной и разбавленной серной кислотах с выделением водорода:
Fe + 2HCl = FeCl2 + H2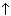 ,
,
Fe + H2SO4 (разб.) = FeSO4 + H2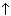 .
.
Более концентрированную серную кислоту (40–60%) железо восстанавливает до
оксида серы(IV):
Fe + 2H2SO4 = FeSO4 + SO2 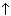 + 2H2O.
+ 2H2O.
В серной кислоте еще более высокой концентрации (от 80 до 100%) железопассивируется – покрывается тонкой и прочной оксидной пленкой, которая предохраняет металл от растворения. Такое же явление пассивации наблюдается и в сильно концентрированной азотной кислоте, поэтому концентрированные серную и азотную кислоты можно перевозить в железной таре.
С разбавленной азотной кислотой железо может реагировать с образованием соли железа(II), а с более концентрированным раствором кислоты – соли железа(III) и различных продуктов восстановления кислоты, например:
3Fe + 8HNO3 = 3Fe(NO3)2 +2NO 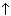 + 4H2O,
+ 4H2O,
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 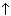 + 3H2O.
+ 3H2O.
Учитель. Вспомните, что называется коррозией. Каковы ее последствия?
Ученик. Коррозия – это разрушение металла под действием окружающей среды. Образование ржавчины можно представить в следующем виде:
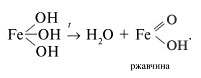
Ржавчина отслаивается от поверхности металла, имеет много пор, поэтому не предохраняет металл от дальнейшей коррозии. Из-за коррозии гибнет огромное количество железа и его сплавов. В XIX в., когда не существовало надежных методов борьбы с коррозией, от нее гибла половина выплавляемого металла. В современных условиях от коррозии гибнет 1/6 часть выплавляемого чугуна. Поэтому борьба с коррозией – одна из важнейших задач человечества.
Учитель. Обладают ли амфотерностью соединения железа?
(На поставленный вопрос может ответить сам учитель или заранее подготовленный, интересующийся химией ученик.)
Гидроксид железа(III) амфотерен, т. е. проявляет свойства основания в реакции с кислотами:
и кислотные свойства в реакциях с концентрированными растворами щелочей:
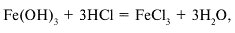
Амфотерный характер имеет и оксид железа(III), который реагирует и с кислотами, и с основными оксидами:
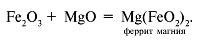
Учитель заостряет внимание учащихся на том, что существуют характерные реакции на соединения двухвалентного и трехвалентного железа, сопровождая свой рассказ проведением опытов.
Учитель. Для обнаружения ионов железа(III) удобно применять комплексное соединение железа, называемое желтой кровяной солью или гексацианоферратом(II) калия K4[Fe(CN)6]. При взаимодействии ионов (Fe(CN)6) 4– с ионами Fe 3+ образуется темно-синий осадок – берлинская лазурь:
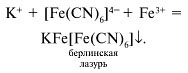
Другое соединение железа – красная кровяная соль или гексацианоферрат(III) калия K3[Fe(CN)6] является реактивом на ионы Fe 2+ .
При взаимодействии ионов (Fe(CN)6) 3– с ионами Fe 2+ также образуется темно-синий осадок – турнбулева синь:
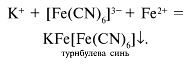
Перечислите основные области применения железа. Какое природное значение имеет железо?
(Учащиеся отвечают на поставленные вопросы, учитель поясняет их ответы.)
Первый ученик. Ферраты различных металлов используют в современных отраслях радиоэлектроники и автоматики.
Второй ученик. Необычные соединения образует железо с водородом, азотом и углеродом. Атомы этих неметаллов имеют размеры меньше атомов железа и легко внедряются между узлов кристаллической решетки металла, образуя твердые растворы внедрения.
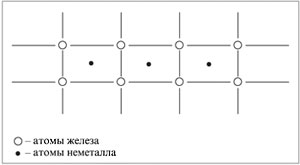
Твердые растворы внедрения внешне похожи на металл, но их свойства сильно отличаются от свойств железа. Большей частью это очень твердые и хрупкие вещества. С водородом железо образует гидриды FeH и FeH2, с азотом – нитриды Fe4N и Fe2N, с углеродом – карбид Fe3С – цементит, содержащийся в чугуне и стали.
Третий ученик. Железо – это металл, использование которого в промышленности и быту не имеет пределов. Широко распространена сталь в современной технике. Оксиды и соли железа применяют в производстве красок, магнитных материалов, катализаторов, лекарственных препаратов, удобрений.
Четвертый ученик. Без железа не может функционировать организм человека, в нем содержится около 3–4 г железа, из них в крови – 2 г. Железо входит в состав гемоглобина. Недостаточное содержание железа в организме человека приводит к головной боли, быстрой утомляемости и другим заболеваниям. Железо также необходимо для роста растений. В целом по значимости железо в настоящее время является главным металлом.
Для закрепления изученного материала учащимся предлагаются следующие вопросы.
1. Каково положение железа в периодической системе химических элементов ?
2. Какие степени окисления проявляет железо в соединениях?
3. Какие соединения железа обладают амфотерными свойствами?
4. Как реагирует железо с азотной и серной кислотами различной концентрации?
5. Как отличить соединения двух- и трехвалентного железа?
6. Каково применение и значение соединений железа на современном этапе развития человечества?
Если позволяет время, то можно закрепить рассмотренный материал по производству железа, используя следующие вопросы.
1. В чем преимущество прямого метода получения железа?
2. Для чего применяют обогащение руды?
3. Как обогащают руду методом флотации?
4. В чем основной смысл очистки технического железа карбонильным методом?
ЛИТЕРАТУРА
Книга для чтения по неорганической химии. Сост. В.А.Крицман, М.: Просвещение, 1984;
Фельдман Ф.Г., Рудзитис Г.Е. Химия. Учебник для 9 класса общеобразовательных учебных учреждений. М.: Просвещение, 1999;
Хомченко Г.П. Химия для поступающих в вузы. М.: Высшая школа, 1993.
Физические и химические свойства альдегидов
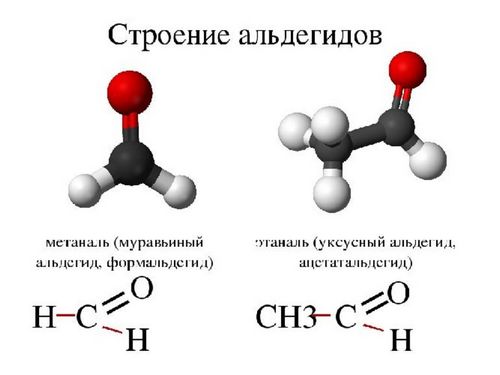
Общая формула предельных альдегидов и кетонов CnH2nO. В названии альдегидов присутствует суффикс –аль.
Простейшие представители альдегидов – формальдегид (муравьиный альдегид) –СН2 = О, ацетальдегид (уксусный альдегид) – СН3-СН = О. Существуют циклические альдегиды, например, циклогексан-карбальдегид; ароматические альдегиды имеют тривиальные названия – бензальдегид, ванилин.
Атом углерода в карбонильной группе находится в состоянии sp 2 -гибридизации и образует 3σ-связи (две связи С-Н и одну связь С-О). π-связь образована р-электронами атомов углерода и кислорода. Двойная связь С = О является сочетанием σ- и π-связей. Электронная плотность смещена в сторону атома кислорода.
Для альдегидов характерна изомерия углеродного скелета, а также межклассовая изомерия с кетонами:
Химические свойства альдегидов
В молекулах альдегидов имеется несколько реакционных центров: электрофильный центр (карбонильный атом углерода), участвующий в реакциях нуклеофильного присоединения; основный центр – атом кислорода с неподеленными электронными парами; α-СН кислотный центр, отвечающий за реакции конденсации; связь С-Н, разрывающаяся в реакциях окисления.
1. Реакции присоединения:
— воды с образованием гем-диолов
— спиртов с образованием полуацеталей
— тиолов с образованием дитиоацеталей (в кислой среде)
— гидросульфита натрия с образованием α-гидроксисульфонатов натрия
— аминов с образованием N-замещенных иминов (основания Шиффа)
— гидразинов с образованием гидразонов
— циановодородной кислоты с образованием нитрилов
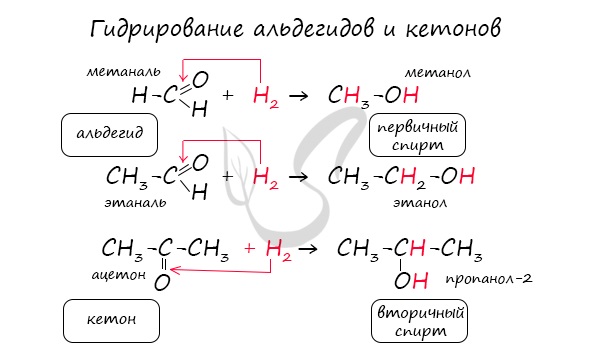
— восстановление. При взаимодействии альдегидов с водородом получаются первичные спирты:
— реакция «серебряного зеркала» — окисление альдегидов аммиачным раствором оксида серебра
R-CH = O + Ag2O → R-CO-OH + 2Ag↓;
— окисление альдегидов гидроксидом меди (II), в результате которого выпадает осадок оксида меди (I) красного цвета
Эти реакции являются качественными реакциями на альдегиды.
Физические свойства альдегидов
Первый представитель гомологического ряда альдегидов – формальдегид (муравьиный альдегид) – газообразное вещество (н.у.), альдегиды неразветвленного строения и состава С2-С12 – жидкости, С13 и длиннее – твердые вещества. Чем больше атомов углерода входит в состав неразветвленного альдегида, тем выше его температура кипения. С увеличением молекулярной массы альдегидов увеличиваются значения величин их вязкости, плотности и показателя преломления. Формальдегид и ацетальдегид способны смешиваться с водой в неограниченных количествах, однако, с ростом углеводородной цепи эта способность альдегидов снижается. Низшие альдегиды обладают резким запахом.
Получение альдегидов
Основные способы получения альдегидов:
— гидроформилирование алкенов. Эта реакция заключается в присоединении СО и водорода к алкену в присутствии карбонилов некоторых металлов VIII группы, например, октакарбонилдикобальта (Cо2(СО)8) Реакция проводится при нагревании до 130 С и давлении 300 атм
С и давлении 300 атм
— гидратация алкинов. Взаимодействие алкинов с водой происходит в присутствии солей ртути (II) и в кислой среде:
— окисление первичных спиртов (реакция протекает при нагревании)
Применение альдегидов
Альдегиды нашли широкое применение в качестве сырья для синтеза различных продуктов. Так, из формальдегида (крупнотоннажное производство) получают различные смолы (фенол-формальдегидные и т.д.), лекарственные препараты (уротропин); ацетальдегид — сырье для синтеза уксусной кислоты, этанола, различных производных пиридина и т.д. Многие альдегиды (масляный, коричный и др.) используют в качестве ингредиентов в парфюмерии.
Примеры решения задач
| Задание | Бромированием СnH2n+2получили 9,5 г монобромида, который при обработке разбавленным раствором NaOH превратился в кислородсодержащее соединение. Пары его с воздухом пропущены над раскаленной медной сеткой. При обработке образовавшегося при этом нового газообразного вещества избытком аммиачного раствора Ag2O выделилось 43,2 г осадка. Какой углеводород был взят и в каком количестве, если выход на стадии бромирования 50%, остальные реакции протекают количественно. |
| Решение | Запишем уравнения всех протекающих реакций: |
R-CH = O + Ag2O → R-CO-OH + 2Ag↓.
Осадок выделившийся в последней реакции – это серебро, следовательно, можно найти количество вещества выделившегося серебра:
v(Ag) = m/M = 43,2/108 = 0,4 моль.
По условию задачи, после пропускания вещества полученного в реакции 2 над раскаленной металлической сеткой образовался газ, а единственный газ –альдегид – это метаналь, следовательно, исходное вещество – это метан.
Количество вещества бромметана:
v(CH3Br) = m/M = 9,5/95 = 0,1 моль.
Тогда, количество вещества метана, необходимое для 50% выхода бромметана – 0,2 моль. М(CH4) = 16 г/моль. Следовательно масса и объем метана:
| Задание | Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бутен-1 → 1-бромбутан + NaOH → А – Н2 → В + [Ag(NH3)2]OH → С + HCl → D. |
| Решение | Для получения 1-бромбутана из бутена-1 необходимо провести реакцию гидробромирования в присутствии пероксидных соединений R2O2 (реакция протекает против правила Марковникова): |
При взаимодействии с водным раствором щелочи 1-бромбутан подвергается гидролизу с образованием бутанола-1 (А):
Бутанол-1 при дегидрировании образует альдегид – бутаналь (В):
Аммиачный раствор оксида серебра окисляет бутаналь до аммонийной соли – бутирата аммония (С):
Бутират аммония при взаимодействии с соляной кислотой образует масляную (бутановую) кислоту (D):
Урок 23. Альдегиды

Определение. Гомологический ряд, номенклатура, изомерия
Альдегиды — это производные углеводородов, которые содержат альдегидную группу:
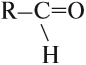
Альдегидная группа состоит из карбонильной группы С=О, соединённой с атомом водорода. Карбонильная группа в молекулах альдегидов всегда находится на конце углеродной цепи.
Предельные альдегиды образуют гомологический ряд с общей формулой:
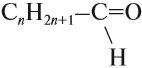
Если использовать эту общую формулу, то следует помнить, что минимальное значение n (числа атомов углерода) равно нулю.
Если n = 0 получаем
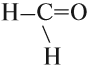
метанАЛЬ, муравьиный альдегид, формальдегид;
Если n = 1 получаем
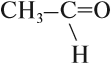
этанАЛЬ, уксусный альдегид, ацетальдегид.
Вопрос. Какой суффикс обозначает наличие в молекуле альдегидной группы?
Названия альдегидов составляют, добавляя суффикс АЛЬ к названию соответствующего углеводорода. При этом учитываются все атомы углерода. Кроме того, используются тривиальные названия, которые совпадают с названиями соответствующих кислот (см. урок 24.1). И, наконец, для некоторых альдегидов используют названия, имеющие латинский корень, например формальдегид — от лат. formika — «муравей».
Задание 23.1. Составьте формулу и название альдегида с n = 3. Имеет ли он изомеры?
Начиная с n = 3 у альдегидов появляются изомеры положения карбонильной группы:

Задание 23.2. Допишите атомы водорода к этим цепочкам и убедитесь, что это — изомеры. Является ли вещество (2) альдегидом?
Но при перемещении карбонильной группы в середину молекулы исчезает альдегидная группа: вещество (2) не альдегид, это — кетон:
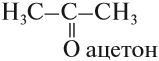
По номенклатуре ИЮПАК кетоны называют, добавляя суффикс ОН к названию соответствующего углеводорода.
Задание 23.3. Составьте формулы и названия альдегидов с n = 4. Дайте им названия.
Изомерия альдегидов связана со строением углеводородного радикала:
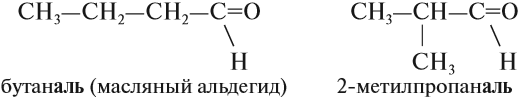

Строение молекул
Отличительным признаком альдегидов является наличие в их молекуле альдегидной группы. В её состав входят атомы углерода и кислорода, связанные двойной связью.
Вопрос. Какой тип реакций характерен для соединений с двойной связью?
Поэтому альдегиды легко вступают в реакции присоединения по месту разрыва π-связи карбонильной группы.
Кроме того, в состав альдегидной группы входит атом водорода, соединённый с карбонильной группой.
Вопрос. Является ли эта связь полярной?
За счёт разрыва полярной С–Н связи альдегидной группы альдегиды очень легко окисляются. Атом кислорода альдегидной группы делает эту группу в целом сильно полярной. Поэтому альдегидная группа влияет на углеводородный радикал, и в радикале возможны реакции замещения.

Свойства альдегидов
Физические свойства
В альдегидах отсутствует гидроксогруппа, за счёт которой между молекулами спиртов возникали водородные связи.
Вопрос. Какие соединения (спирты или альдегиды) имеют бОльшую температуру кипения?
Поэтому альдегиды, в отличие от спиртов, легче испаряются, имеют меньшие температуры кипения. Например, формальдегид — газ с резким запахом, а метанол — жидкость. Низшие альдегиды могут растворяться в воде. Раствор формальдегида в воде (формалин) применяется в медицине, кожевенной промышленности. Его применение основано на том, что формальдегид активно реагирует с белками, вызывая в них необратимые изменения (денатурацию). Следовательно, формальдегид сильно ядовит.
Химические свойства
При рассмотрении строения молекулы альдегидов были сделаны выводы, что для них должны быть характерны реакции присоединения, замещения (в углеводородном радикале), и окисления.
Примером реакции присоединения к карбонильной группе может служить реакция гидрирования, т. е. присоединения водорода:
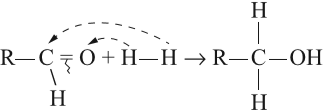
Вопрос. К какому классу относится полученное соединение? Назовите его.
При окислении альдегидов образуются кислоты:
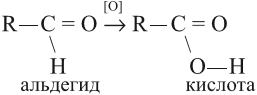
Окисление альдегидов происходит даже при их хранении, т. е. в обычных условиях. Реакции окисления альдегидов используют для того, чтобы обнаружить их в растворах. Например, если к раствору альдегида добавить аммиачный раствор оксида серебра и нагреть, то на стенках сосуда появится зеркало. Это выделилось чистое серебро, которое блестящим тонким слоем покрыло стекло:
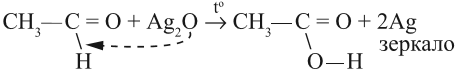
Эта реакция получила название «реакция серебряного зеркала».
Альдегид можно превратить в кислоту (окислить) и при помощи гидроксида меди (II). Если к осадку Сu(ОН)2 добавить раствор альдегида и нагреть, то образуется жёлтый осадок СuОН, переходящий в красный оксид меди (I). В результате образуется оранжевый осадок:
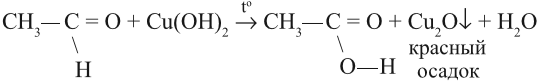
Если эту же смесь долго греть, то на стенках пробирки выделится в виде блестящего слоя чистая медь «медное зеркало». Поэтому эту реакцию часто называют реакцией «медного зеркала».
Запомните: реакции «серебряного зеркала» и «медного зеркала» — качественные реакции на альдегидную группу.
Задание 23.4. Составьте уравнения качественных реакций для формальдегида.
Вопрос. Можно ли при помощи гидроксида меди (II) различить растворы глицерина и уксусного альдегида? Укажите условия и эффекты обеих реакций.

Получение и применение альдегидов на примере уксусного альдегида
Уксусный альдегид получают в больших количествах при помощи реакции Кучерова*:
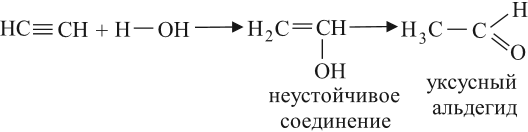
* Кучеров Михаил Григорьевич (3.06.1850–26.06.1911) — русский химик-органик, открыл (1881) реакцию каталитической гидратации ацетиленовых углеводородов с образованием карбонилсодержащих соединений.
В небольших количествах этот альдегид можно получить окислением этанола:
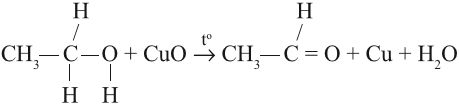
Задание 23.5. В уроках 20.3 и 22.4 посмотрите на соответствующие уравнения реакций; обратите внимание, за счёт каких атомов они происходят, и попробуйте составить аналогичные уравнения реакций:
- пропин + вода →
- пропанол-1 + СuО →
- пропанол-2 + СuО →
Сделайте вывод: всегда ли в этих реакциях получаются альдегиды?
Если Вы всё сделали правильно, в реакциях 1 и 3 получается ацетон (кетон), а в реакции 2 — пропаналь.
Уксусный альдегид применяют для получения уксусной кислоты, этилового спирта, лекарств и других веществ.

Выводы
Альдегиды — это производные углеводородов, содержащие альдегидную группу. Для них должны быть характерны реакции
- присоединения (за счёт карбонильной группы);
- замещения (в углеводородном радикале);
- окисления.
Альдегиды
Альдегиды – летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
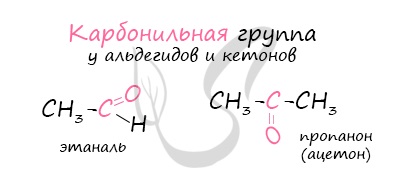
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса “аль” к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот – HO. Например: метаналь – HCHO, этаналь – CH3CHO, пропаналь – C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь – формальдегид, этаналь – ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
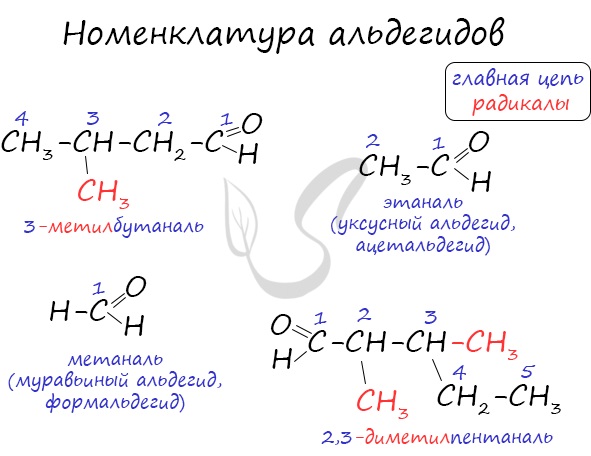
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов – кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
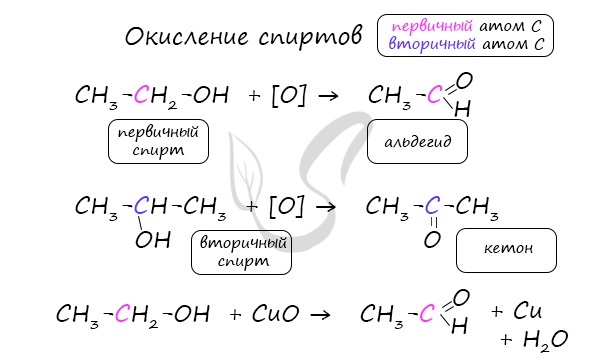
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.

В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
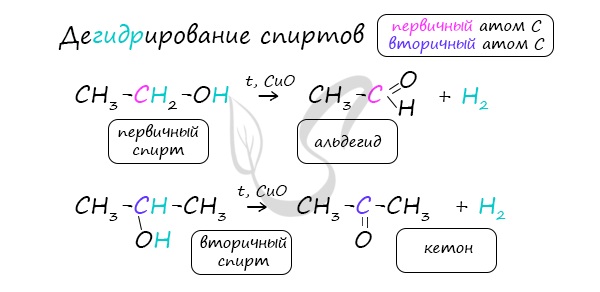
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.

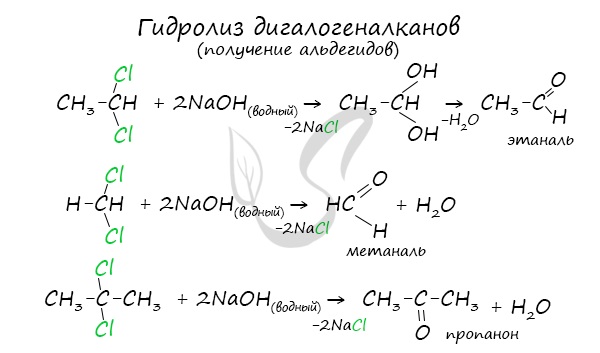
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов – у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.

В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.

Химические свойства альдегидов и кетонов
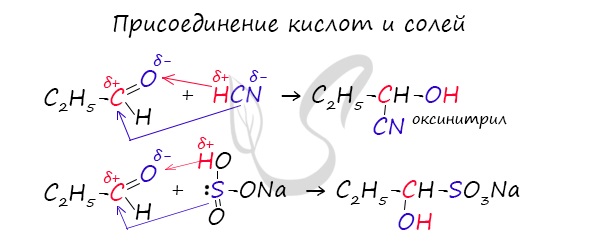
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов – вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом – наличием альдегидной группы у муравьиной кислоты.

Окисление также возможно другим реагентом – гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Альдегиды: их строение, физические и химические свойства
Содержание:
Альдегиды представляют собой органические соединения, в которых углерод имеет двойную связь с кислородом и одинарную с водородом либо атомом, который имеет обозначение R в структурных схемах. Многие из альдегидов обладают приятным запахом, вследствие чего находят активное применение в разных промышленных целях. Получают альдегиды из спиртов путем их дегидрирования. Об их физических и химических свойствах, применении и получении наша сегодняшняя статья.
Химические свойства
Практически все альдегиды способны вступать в разнообразные химические реакции, включая полимеризацию. Сочетание их с другими видами молекул ведет к созданию так званных конденсационных полимеров, которые активно используются, например, при производстве пластмассы, в качестве растворителей и парфюмерных ингредиентов.
А некоторые альдегиды даже принимают активное участие в физиологических процессах, так они являются частью:
- витамина А, очень важного для зрения,
- пиридоксальфосфата – одной из форм витамина В6,
- глюкозы и прочих редуцированных сахаров,
- некоторых природных и синтетических гормонов.
Важным отличием альдегидов от тех же углеродов является наличие у них карбонильной группы. Карбонильная группа эта изначально полярна, то есть электроны образующие связь С=О притягиваются больше к кислороду, нежели к углероду. Благодаря этому первый из электронов получает отрицательный заряд, а второй положительный.
Также стоит заметить, что альдегиды имеют более высокий дипольный момент по сравнению с остальными углеводородными соединениями.
Физические свойства
Температура кипения альдегидов и их плавления гораздо выше у карбонилсодержащих соединений, нежели у просто состоящих из углерода и водорода. К примеру, бутан и ацетон имея одинаковую молекулярную массу, закипают очень по разному: бутан закипает уже при 0 С, в то время как ацетону для кипения необходимо уже +56 С.
В отличие от углеводородов альдегиды способны растворятся в воде, но не все, а только имеющие менее пяти атомов углерода в молекуле. Но если углеводородная часть их молекул выше этого числа, это делает их нерастворимыми в воде.
Структура
Формальгид – простейший альдегид, имеет молекулу, связанную с двумя атомами водорода. У всех других альдегидов молекулы связаны лишь с одним атомом водорода.
Углерод, связанный с карбонильной группой может быть частью алкильных либо неалкильных групп, они в свою очередь могут быть ациклическими, ароматическими или гетероциклическими кольцами. Органические соединения, обладающие двумя альдегидными группами называются диальдегидами.
Номенклатура
Есть два способа наименования альдегидов. Один из них основан на системе, разработанной Международным союзом теоретической и прикладной химии, его еще называют систематической номенклатурой. Он предполагает использовать в качестве исходного алкана самую длинную цепь атомов углерода, содержащую карбонильную группу в качестве исходного алкана. Числовое определение исходной карбонильной группы при этом использовать не принято, так как она всегда находится в конце родительской цепи. Например, название может быть 2-метилбутаналь, или изомасляный альдегид будет указан как 2-метилпропаналь.
Другой метод представляет собой общую номенклатуру. Принцип общей номенклатуры заключается в том, чтобы называть соединения по общему наименованию соответствующей карбоновой кислоты. Иными словами структура та же, что и у альдегида, только вместо CHO появляется COOH, как у уксусной кислоты — CH3COOH или C2H4O2.
Производство
Так как альдегиды одни из ключевых строительных блоков органической химии, то не удивительно, что для их получения и производства существует множество разных методов:
- Окисление. Представляет собой один из основных методов для получения альдегидов. Обычно спирты могут быть окислены до состояния альдегидов. Для этого первичный спирт пропускается через горячий катализатор (гидроксид меди) или через аммиачный раствор оксида серебра (так званая реакция серебряного зеркала). Увы, но этот способ не подходит для маленьких лабораторий.
- Гидроформилирование – еще один способ для получения альдегидов, когда алкены обрабатываются монооксидом углерода, водородом и катализатором на основе переходного металла.
- Один из альдегидов (ацетальдегид) может быть получены путем взаимодействия ацетилена с водой.
Для коммерческого получения альдегидов чаще всего применяют гидроформилирование.

Практическое применение
Альдегиды находят многообразное применение в разных сферах человеческой жизни. Сотни их соединений используются химиками для синтеза других веществ. Например, благодаря формальдегиду мы получаем формалин, который в свою очередь активно применяется для дубления, консервации и бальзамирования, а также в качестве фунгицидного и бактериального средства для обработки растений.
Альдегиды, имеющие высокую молекулярную массу (к примеру, бензальдегид и фенилацетальдегид) обладают приятным запахом и поэтому используются в парфюмерии при производстве духов.
Видео
И в завершении образовательное видео по теме нашей статьи.
Альдегиды и кетоны — номенклатура, получение, химические свойства

Строение альдегидов и кетонов
 Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O , соединенную с атомом водорода и углеводородным радикалом.
Альдегиды – органические вещества, молекулы которых содержат карбонильную группу С=O , соединенную с атомом водорода и углеводородным радикалом.
Общая формула альдегидов имеет вид:

В простейшем альдегиде – формальдегиде роль углеводородного радикала играет другой атом водорода:

Карбонильную группу, связанную с атомом водорода, часто называют альдегидной:

Кетоны – органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Очевидно, общая формула кетонов имеет вид:

Карбонильную группу кетонов называют кетогруппой.
В простейшем кетоне – ацетоне – карбонильная группа связана с двумя метильными радикалами:

Номенклатура и изомерия альдегидов и кетонов
В зависимости от строения углеводородного радикала, связного с альдегидной группой, различают предельные, непредельные, ароматические, гетероциклические и другие альдегиды:

В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются от названия алкана с тем же числом атомов углерода в молекуле с помощью суффикса -аль. Например:

Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Поэтому альдегидная группа всегда располагается при первом атоме углерода, и указывать ее положение нет необходимости.
Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам.
Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи). Например:

Для альдегидов характерен только один вид структурной изомерии — изомерия углеродного скелета, которая возможна с бутаналя, а для кетонов также и изомерия положения карбонильной группы. Кроме этого, для них характерна и межклассовая изомерия (пропаналь и пропанон).

Физические свойства альдегидов
В молекуле альдегида или кетона вследствие большей электороотрицательности атома кислорода по сравнению с углеродным атомом связь С=O сильно поляризована за счет смещения электронной плотности π-связи к кислороду:

Альдегиды и кетоны — полярные вещества с избыточной электронной плотностью на атоме кислорода. Низшие члены ряда альдегидов и кетонов (формальдегид, уксусный альдегид, ацетон) растворимы в воде неограниченно. Их температуры кипения ниже, чем у соответствующих спиртов. Это связано с тем, что в молекулах альдегидов и кетонов в отличие от спиртов нет подвижных атомов водорода и они не образуют ассоциатов за счет водородных связей. Низшие альдегиды имеют резкий запах; у альдегидов, содержащих от четырех до шести атомов углерода в цепи, неприятный запах; высшие альдегиды и кетоны обладают цветочными запахами и применяются в парфюмерии.

Химические свойства альдегидов и кетонов
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов.
1. Реакции восстановления.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе. Продуктом гидрирования альдегидов являются первичные спирты, кетонов — вторичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, при гидрировании ацетона — пропанол-2.

Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
2. Реакции окисления. Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты.
Окисление кислородом воздуха. Например, из пропионового альдегида (пропаналя) образуется пропионовая кислота:

Окисление слабыми окислителями (аммиачный раствор оксида серебра).

Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
3. Реакция полимеризации:
Получение альдегидов и кетонов

Применение альдегидов и кетонов
Формальдегид (метаналь, муравьиный альдегид) H2C=O:
а) для получение фенолформальдегидных смол;
б) получение мочевино-формальдегидных (карбамидных) смол;
в) полиоксиметиленовые полимеры;
г) синтез лекарственных средств (уротропин);
д) дезинфицирующее средство;
е) консервант биологических препаратов (благодаря способности свертывать белок).
Уксусный альдегид (этаналь, ацетальдегид) СН3СН=О:
а) производство уксусной кислоты;
б) органический синтез.
Ацетон СН3-СО-СН3:
а) растворитель лаков, красок, ацетатов целлюлозы;
б) сырье для синтеза различных органических веществ.





