§ 7. Изомерия и ее виды
Учёные считают, что явление изомерии было открыто в 1823 г., причём на примере двух неорганических соединений. Ф. Вёлер и Ю. Либих обнаружили два вещества одинакового состава, существенно отличающиеся по свойствам, — циановокислое серебро и гремучее серебро. Первому из них приписывают формулу AgNCO, а второму — AgONC. Немного позже подобное явление было обнаружено и среди органических соединений. Термин «изомерия» ввёл в 1830 г. Й. Я. Берцелиус, который объяснял различие свойств изомеров «различным распределением атомов в молекуле вещества».
Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры — расположением атомов в пространстве при одинаковом порядке связей между ними.
Структурная изомерия
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле С 4 Н 10 соответствуют два углеводорода: н -бутан и изобутан. Для углеводорода С 5 Н 12 возможны три изомера: н -пентан, изопентан и неопентан.

С увеличением числа атомов углерода в молекуле число изомеров быстро растёт. Для углеводорода С10Н22 их уже 75, а для углеводорода С20Н42 — 366 319.
Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы.

Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих разным классам. Так, молекулярной формуле С6Н12 соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан.

Изомерами являются углеводород, относящийся к алкинам, — бутин-1 и углеводород с двумя двойными связями в цепи — бутадиен-1,3.

Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу С4Н10О.

Структурными изомерами являются аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле C2H5NO2.

Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
Теория строения органических соединений: гомология и изомерия
Теория А.М. Бутлерова
1. Атомы в молекулах соединены между собой в определенной последовательности химическими связями в соответствии с их валентностью. Порядок связи атомов называется их химическим строением. Углерод во всех органических соединениях четырехвалентен.
2. Свойства веществ определяются не только качественным и количественным составом молекул, но и их строением.
3. Атомы или группы атомов взаимно влияют друг на друга, от чего зависит реакционная способность молекулы.
4. Строение молекул может быть установлено на основании изучения их химических свойств.
Органические соединения обладают рядом характерных особенностей, которые отличают их от неорганических. Почти все они (за редким исключением) горючи; большинство органических соединений не диссоциирует на ионы, что обусловлено природой ковалентной связи в органических веществах. Ионный тип связи реализуется только в солях органических кислот, например, CH3COONa.
Гомологический ряд – это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2– групп (гомологическая разность).




Различают 2 вида изомерии: структурную изомерию и пространственную изомерию.
Структурная изомерия
Структурные изомеры – соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.

Пространственная изомерия
Цис-транс-изомерия

В молекуле бутена-2 СН3–СН=СН–СН3 группы СН3 могут находиться либо по одну сторону от двойной связи — в цис-изомере, либо по разные стороны — в транс-изомере.
Оптическая изомерия
Появляется тогда, когда углерод имеет четыре разных заместителя.
Если поменять местами любые два из них, получается другой пространственный изомер того же состава. Физико-химические свойства таких изомеров существенно различаются. Соединения такого типа отличаются способностью вращать плоскость пропускаемого через раствор таких соединений поляризованного света на определенную величину. При этом один изомер вращает плоскость поляризованного света в одном направлении, а его изомер – в противоположном. Вследствие таких оптических эффектов этот вид изомерии называют оптической изомерией.
Урок 24. Карбоновые кислоты

Определение
Карбоновые кислоты — это производные углеводородов, в молекулах которых содержится одна или несколько карбоксильных групп:

Карбоксильная группа имеет сложный состав. Она состоит из карбонильной и гидроксильной (гидроксо) групп:
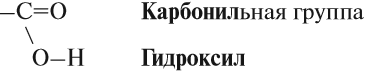
Карбоновые кислоты часто встречаются в природе, придавая ягодам и фруктам, а также некоторым другим продуктам питания кислый вкус. Их делят на различные группы (классы) по некоторым признакам:
- По строению (составу) углеводородного радикала кислоты делят на:
в углеводородном радикале только простые связи;
– Непредельные (в углеводородном радикале есть кратная связь);
в углеводородном радикале есть кратная связь;
имеется бензольное кольцо.
Задание 24.1. Определите состав этих кислот.
Для того чтобы различить по составу предельные и непредельные кислоты, нужно умножить на два число атомов углерода в углеводородном радикале и сравнить полученную величину (С) с числом атомов водорода (В) в углеводородном радикале:
- у предельных кислот В > C, например для С3Н7СООН: В = 7, а С = 3 · 2 = 6;
- у непредельных кислот B Гомологический ряд, номенклатура, изомерия
Предельные одноосновные карбоновые кислоты образуют гомологический ряд с общей формулой:
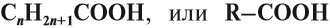
- n = 0, то Н–СООНметановая кислота (муравьиная)
- n = 1, то СН3–СООНэтановая кислота (уксусная).
Вопрос. По какому принципу составляются названия кислот?
Для того чтобы составить название кислоты, нужно:
- подсчитать все атомы углерода (считая и атом углерода карбоксильной группы);
- назвать алкан, который имеет такое же число атомов углерода и то же строение;
- дописать к этому названию «овая» и слово «кислота».
Кроме того, для кислот чаще всего используют тривиальные названия (муравьиная, уксусная), которые указывают на происхождение кислоты или её отличительные признаки. Например, название муравьиная указывает, что эта кислота входит в состав жгучего сока муравьёв. А слово «уксусная» происходит от греческого слова «оксос», что означает «кислый». Запомните некоторые из этих названий:
- n = 2 CH3–СН2–СOОH С2Н5СООНпропионовая кислота,
- n = 3 СН3–СН2–CH2–СООН С3Н7СООНмасляная кислота,
- ………….
- n = 17C17H35COOHстеариновая кислота.
Задание 24.3. Назовите по ИЮПАК пропионовую и масляную кислоты.
Если вы выполнили вышеизложенные правила, у вас получилось: пропановая кислота, бутановая кислота.
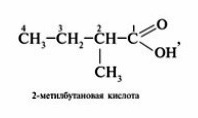
Начиная с n = 3, у кислот появляются изомеры. Изомерия предельных кислот связана со строением углеводородного радикала:
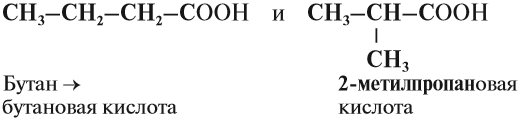
Задание 24.4. Составьте молекулярные формулы этих кислот и убедитесь, что это изомеры.

Строение молекул
В состав карбоксильной группы входит гидроксогруппа ОН.
Вопрос. В каких соединениях встречается функциональная группа ОН?
Такая же группа входит в состав молекул спиртов. Спирты проявляют очень слабые кислотные свойства, могут вступать в реакции только с очень активными, щелочными металлами, не изменяют окраску индикатора, не реагируют с растворами щелочей.
Если в раствор карбоновой кислоты добавить индикатор (лакмус), то раствор окрасится в красный цвет. Это означает, что кислоты проявляют более кислые свойства, чем спирты. Почему? Потому что карбонильная группа, которая расположена рядом с гидроксогруппой, влияет на неё.
Карбонильная группа, которая входит в состав карбоксильной группы, имеет (+) на атоме углерода. За счёт этого небольшого положительного заряда происходит смещение общих электронных пар связей «С–О» и «О–Н», поэтому эти связи становятся более полярными:
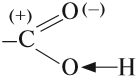
Таким образом, карбонильная группа увеличивает полярность связи О–Н, делая её более полярной. Поэтому атом водорода карбоксильной группы становится очень подвижным. Он легко замещается на атом металла, способен отщепляться в растворах: кислоты диссоциируют:
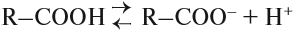
Гидроксогруппа тоже влияет на карбонильную группу, делая ее неактивной, поэтому кислоты не участвуют в реакциях с разрывом π-связи карбонильной группы.
Карбоксильная группа влияет на углеводородный радикал, делая некоторые связи С–Н в нём более полярными, и кислоты могут участвовать в реакциях замещения атомов водорода радикала.

Свойства кислот
Физические свойства
Кислоты с небольшим числом атомов углерода (1–10) — жидкости с резким запахом. Вкус у них разный — уксусная кислота — кислая, а масляная — горькая. Низшие кислоты растворимы в воде, причём с увеличением длины радикала их растворимость ухудшается.
Например, уксусная кислота — бесцветная жидкость с резким запахом. Смешивается с водой в любых соотношениях. 60…90 %-ные растворы уксусной кислоты (уксусная эссенция) опасны для жизни, в то время как 6…8 %-ные растворы столового уксуса широко применяются при приготовлении пищи.
Высшие кислоты, например стеариновая кислота, твёрдые, нерастворимые в воде вещества, лишённые запаха. Смесь таких кислот называется «стеарин». Из стеарина делают свечи.
Химические свойства
Кислоты проявляют все свойства неорганических кислот.
Вопрос. Какие свойства кислот вам известны?
Кислоты реагируют с металлами, которые стоят в ряду напряжений до водорода:
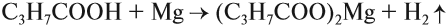
При составлении таких реакций следует помнить, что
- кислотный остаток — это часть молекулы кислоты без подвижного атома водорода; в данном случае это: С3Н7СОО;
- валентность кислотного остатка равна числу замещённых атомов водорода, в данном случае замещается один атом водорода и валентность равна I;
- исходя из этого, нужно переписать после реакции кислотный остаток, взять его в скобки и за скобками поставить цифру, равную валентности металла, а затем записать символ самого металла.
В результате такой реакции образуется соль и выделяется водород.
Кислоты реагируют с основными и амфотерными оксидами:
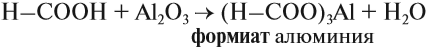
В этом случае образуется соль и вода. Такие же продукты реакции образуются при взаимодействии кислоты и основания:
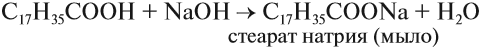
Большинство карбоновых кислот — слабые кислоты. Тем не менее они могут вытеснять более слабые кислоты из их солей:
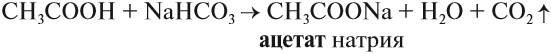
Итак, во всех этих реакциях образуются соли. Названия солей происходят от латинских названий кислот. Запомните эти названия!
Задание 24.5. Составьте для известных Вам карбоновых кислот таблицу по схеме:
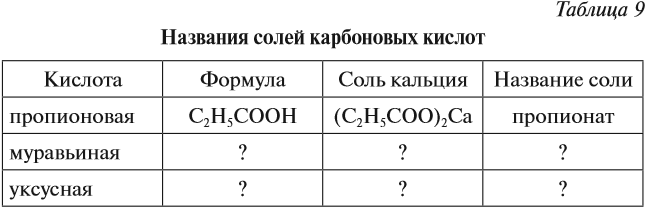
Названия солей см. выше (в уравнениях химических реакций).
Кислоты могут реагировать со спиртами, в результате получаются сложные эфиры:
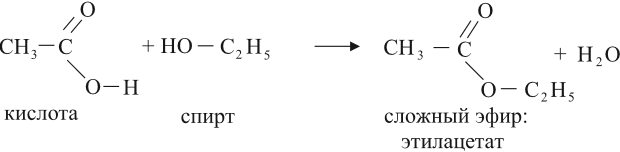
Это реакция этерификации. Она происходит в присутствии концентрированной серной кислоты. (Подробнее о названиях и свойствах сложных эфиров см. урок 25.)
Кислоты могут реагировать с галогенами за счёт углеводородного радикала, при этом на атом галогена замещается атом водорода у ближайшего к карбоксильной группе атома углерода (это α-углеродный атом):
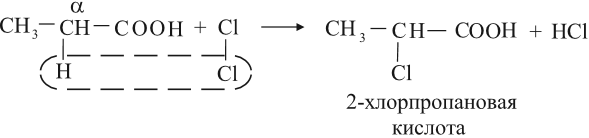
Получение и применение кислот
Кислоты можно получить при помощи окисления соответствующего альдегида:
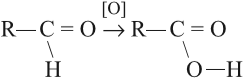
Задание 24.6. Какой альдегид нужно взять для получения уксусной кислоты? 2-метилпропановой кислоты? Составьте уравнения реакций.
Вопрос. В каких условиях происходят процессы окисления альдегидов? Являются ли эти реакции качественными на альдегидную группу?
Кислоты применяются для получения душистых веществ, растворителей, входят в состав лекарств. Наибольшее применение получила ледяная (безводная) уксусная кислота, которая используется в технических целях (для получения лекарств, ацетатного шёлка, растворителей). В магазине можно купить и пищевую уксусную кислоту (70 %-ный раствор), и уксус (6 %-ный раствор). Концентрированная уксусная кислота — яд! Она вызывает тяжёлые ожоги внутренних органов, разрушает кровь. Её следует разбавлять водой до безопасных 5–7 % (примерно 1:10). Столовый уксус используют при приготовлении пищи. Его получают из глюкозы по схеме:
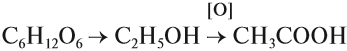
Некоторые (жирные) кислоты входят в состав жиров (см. урок 25).

Выводы
Кислоты — это производные углеводородов, содержащие карбоксильную группу. Для них характерны реакции:
- замещения атома Н карбоксильной группы (с металлами);
- обмена (с оксидами, гидроксидами, солями);
- этерификации (со спиртами);
- замещения атома Н радикала (с галогенами).
Кислоты входят в состав различных овощей, фруктов и других пищевых продуктов. Используются при приготовлении пищи, например уксус.
Карбоновые кислоты
Карбоновые кислоты – класс органических соединений, молекулы которых содержат одну или несколько карбоксильных групп COOH.
Имеют разнообразное промышленное применение и большое биологическое значение. Общая формула одноосновных карбоновых кислот CnH2nO2 .

Классификация карбоновых кислот
По количеству карбоксильных групп в молекуле карбоновые кислоты подразделяются на:
- Одноосновные – 1 карбоксильная группа
- Двухосновные – 2 карбоксильных группы
- Трехосновные – 3 карбоксильных группы

Высшие карбоновые кислоты называют жирными кислотами. Более подробно мы изучим их теме, посвященной жирам, в состав которых они входят.
Номенклатура и изомерия карбоновых кислот
Названия карбоновых кислот формируются путем добавления суффикса “овая” к названию алкана с соответствующим числом атомов углерода и слова кислота: метановая кислота, этановая кислота, пропановая кислота, и т.д.
Многие карбоновые кислоты имеют тривиальные названия. Наиболее известные:
- Метановая – HCOOH – муравьиная кислота
- Этановая – CH3-COOH – уксусная кислота
- Пропановая – C2H5-COOH – пропионовая кислота
- Бутановая – C3H7-COOH – масляная кислота
- Пентановая – C4H9-COOH – валериановая кислота

Для предельных карбоновых кислот характерна структурная изомерия: углеродного скелета, межклассовая изомерия со сложными эфирами.

Получение карбоновых кислот
- Окисление алканов
При повышенной температуре и в присутствии катализатора становится возможным неполное окисление алканов, в результате которого образуются кислоты.

При реакции спиртов с сильными окислителями, такими как подкисленный раствор перманганата калия, спирты окисляются до соответствующих кислот.

При окислении альдегиды образуют соответствующие карбоновые кислоты. Окисление можно проводить качественной реакцией на альдегиды – реакцией серебряного зеркала.

Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли.

Окисление альдегидов также может быть успешно осуществлено другим реагентом – свежеосажденным гидроксидом меди II. В результате такой реакции образуется осадок кирпично-красного цвета оксида меди I.

Существует специфический способ получения муравьиной кислоты, который заключается в реакции твердого гидроксида щелочного металла с угарным газом под давлением и температуре 200°С – образуется формиат (соль муравьиной кислоты).
При дальнейшей обработке формиата серной кислотой образуется муравьиная кислота.

Специфичность синтеза уксусной кислоты заключается в реакции угарного газа с метанолом, в результате которой она образуется.
Также уксусную кислоту можно получить другим путем: сначала провести реакцию Кучерова, в ходе которой образуется уксусный альдегид. Окислить его до уксусной кислоты можно аммиачным раствором оксида серебра или гидроксидом меди II.

Химические свойства карбоновых кислот
Для карбоновых кислот не характерны реакции присоединения. Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты.
Карбоновые кислоты вступают в реакции с металлами, которые способны вытеснить водород (стоят левее водорода в ряду напряжений металлов) из кислоты. Реагируют также с основаниями, с солями более слабых кислот, например, угольной кислоты.

Галогенирование происходит по типу замещения в радикале, который соединен с карбоксильной группой. Напомню, что наиболее легко замещается водород у третичного, чуть сложнее – у вторичного, и значительно сложнее – у первичного атома углерода.

Сила карбоновых кислот тем выше, чем меньше электронной плотности сосредоточено на атоме углерода в карбоксильной группе. Поэтому самая слабая из трех кислот – уксусная, чуть сильнее – хлоруксусная, за ней – дихлоруксусная и самая сильная – трихлоруксусная.
Перераспределение электронной плотности в молекулах этих кислот для лучшего запоминания лучше увидеть наглядно. Это перераспределение обусловлено большей электроотрицательностью хлора, который притягивает электронную плотность.

Муравьиная кислота отличается от своих гомологов. За счет наличия у нее альдегидной группы, она, единственная из карбоновых кислот, способна вступать в реакцию серебряного зеркала.
В такой реакции идет ее окисление до нестойкой угольной кислоты, которая распадается на углекислый газ и воду.

При нагревании и в присутствии серной кислоты (водоотнимающего компонента) муравьиная кислота распадается на воду и угарный газ.
Сложные эфиры
Получение сложных эфиров происходит в реакции этерификации (лат. aether – эфир), заключающейся во взаимодействии карбоновой кислоты и спирта.
Названия сложных эфиров формируются в зависимости от того, какой кислотой и каким спиртом эфир образован. Примеры:
- Метановая кислота + метанол = метиловый эфир метановой кислоты (метилформиат)
- Этановая кислота + этанол = этиловый эфир уксусной кислоты (этилацетат)
- Метановая кислота + этанол = этиловый эфир метановой кислоты (этилформиат)
- Пропановая кислота + бутанол = бутиловый эфир пропионовой кислоты (бутилпропионат)

Для сложных эфиров характерной реакцией является гидролиз – их разложение. Возможен щелочной гидролиз, при котором образуется соль кислоты и спирт, и кислотный гидролиз, при котором образуются исходные спирт и кислота.
Кислотный гидролиз протекает обратимо, щелочной – необратимо. Реакция щелочного гидролиза по-другому называется реакция омыления, и напомнит о себе, когда мы дойдем до темы жиров.

Ангидриды
Ангидриды – химические соединения, производные неорганических и органических кислот, образующиеся при их дегидратации.

Хлорангидриды карбоновых кислот образуются в реакции карбоновых кислот с хлоридом фосфора V.

Следующая реакция не имеет отношения к ангидридам, однако (из-за их схожести) вы увидите ее здесь для наилучшего запоминания. Это реакция галогенирования гидроксикислот, в результате которой гидроксогруппа в радикале меняется на атом галогена.

Непредельные карбоновые кислоты
Распределение электронной плотности в молекулах творит чудеса: иногда реакции идут против правила Марковникова. Так происходит в непредельной акриловой кислоте.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Карбоновые кислоты — номенклатура, получение, химические свойства

Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп –СООН, связанных с углеводородным радикалом.
связанных с углеводородным радикалом.
Классификация карбоновых кислот
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) СН3СООН (уксусная),
многоосновные (дикарбоновые, трикарбоновые и т.д.) НООССН2СООН (малоновая).
По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CH-COOH);
ароматические (C6H5COOH).
Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса —овая и слова кислота: HCOOH — метановая (муравьиная) кислота, CH3COOH – этановая (уксусная) кислота.

Изомерия карбоновых кислот
Для карбоновых кислот характерная структурная изомерия:
а) изомерия скелета в углеводородном радикале (начиная с C4);
б) межклассовая изомерия, начиная с C2.
Возможна цис-транс изомерия в случае непредельных карбоновых кислот.
Строение карбоксильной группы:

Электронная плотность π-связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.
В водном растворе карбоновые кислоты диссоциируют на ионы.
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
С увеличением молекулярной массы растворимость кислот в воде уменьшается.
Способы получения карбоновых кислот

Химические свойства карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, галогенангидриды.
Влияние заместителей на силу карбоновых кислот
- Донорные группы увеличивают прочность связи кислород-водород или дестабилизируют карбоксилат анион, подавая ещё больше электронной плотности, это приводит к уменьшению силы кислот.
- Акцепторные группы уменьшают электронную плотность связи кислород-водород или стабилизируют карбоксилат анион, это приводит к увеличению силы кислот (значение рКа уменьшается).
Карбоновые кислоты
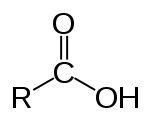

Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10 −5 . Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Содержание
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание “овая” и слово “кислота“. При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН – пропановая кислота, СН3-С(СН3)2-СООН – 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание “карбоновая” и слово “кислота“, не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН – циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН – трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
| Формула | Название по ИЮПАК | Тривиальное название |
|---|---|---|
| НСООН | метановая кислота | муравьиная кислота |
| СН3-СООН | этановая кислота | уксусная кислота |
| СН3-СН2-СООН | пропановая кислота | пропионовая кислота |
| СН3-(СН2)2-СООН | бутановая кислота | масляная кислота |
| СН3-(СН2)3-СООН | пентановая кислота | валериановая кислота |
| СН3-(СН2)4-СООН | гексановая кислота | капроновая кислота |
| СН3-(СН2)5-СООН | гептановая кислота | энантовая кислота |
| СН3-(СН2)6-СООН | октановая кислота | каприловая кислота |
| СН3-(СН2)7-СООН | нонановая кислота | пеларгоновая кислота |
| СН3-(СН2)8-СООН | декановая кислота | каприновая кислота |
| СН3-(СН2)9-СООН | ундекановая кислота | ундециловая кислота |
| СН3-(СН2)10-СООН | додекановая кислота | лауриновая кислота |
| СН3-(СН2)11-СООН | тридекановая кислота | тридециловая кислота |
| СН3-(СН2)12-СООН | тетрадекановая кислота | миристиновая кислота |
| СН3-(СН2)13-СООН | пентадекановая кислота | пентадециловая кислота |
| СН3-(СН2)14-СООН | гексадекановая кислота | пальмитиновая кислота |
| СН3-(СН2)15-СООН | гептадекановая кислота | маргариновая кислота |
| СН3-(СН2)16-СООН | октадекановая кислота | стеариновая кислота |
| СН3-(СН2)17-СООН | нонадекановая кислота | стеариновая кислота |
| С6Н5-СООН | бензолкарбоновая кислота | бензойная кислота |
| СН2=СН-СООН | пропеновая кислота | акриловая кислота |
| СН≡С-СООН | пропиновая кислота | пропиоловая кислота |
| СН3-С(СН3)2-СООН | 2,2-диметилпропановая | пивалиновая кислота |
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические алифатические (в том числе предельные и непредельные) алициклические гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
Применение
Карбоновые кислоты – исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов – сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот – пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы – компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
- Окисление спиртов

- Окисление альдегидов

- Гидролиз тригалогеналканов

- Карбоксилирование металлорганических соединений


- Гидролиз сложных эфиров

- Гидролиз нитрилов


Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
- Реакция Арндта-Эйстерта


Используется для получения высших гомологов кислот из низших.
Физические свойства
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу  Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:



2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:


3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):

4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:

5. Под действием  карбоновые кислоты превращаются в соответствующие хлорангидриды:
карбоновые кислоты превращаются в соответствующие хлорангидриды:

Литература
- Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
- Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
- Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
- Дж. Роберт, М.Касерио “Основы органической химии” т. 1 Издание 2-е, дополненное. 1978
Ссылки
- Карбоновые кислоты (рус.) на сайте XuMuK
См. также
 |
Портал «Наука» |
|---|---|
| Карбоновые кислоты в Викисловаре ? | |
| Карбоновые кислоты на Викискладе ? | |
 |
Проект «Химия» |
- карбоксильная группа
- оксикислоты
- кетокислоты
- аминокислоты
- сложные эфиры
- хлорангидриды карбоновых кислот
- ангидриды карбоновых кислот
- амины
- нитрилы

- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Исправить статью согласно стилистическим правилам Википедии.
- Добавить иллюстрации.
Wikimedia Foundation . 2010 .
- Хофман, Дастин Ли
- Альмодовар, Педро
Смотреть что такое “Карбоновые кислоты” в других словарях:
КАРБОНОВЫЕ КИСЛОТЫ — органические соединения, содержащие одну или несколько карбоксильных групп СООН. Известны одноосновные карбоновые кислоты RCOOH (уксусная, бензойная), двухосновные R(COOH)2 (щавелевая, фталевая) и многоосновные (лимонная) (R органический радикал) … Большой Энциклопедический словарь
КАРБОНОВЫЕ КИСЛОТЫ — КАРБОНОВЫЕ КИСЛОТЫ, органические соединения, содержащие одну или несколько карбоксильных групп COOH. По числу таких групп различают одноосновные карбоновые кислоты (например, уксусная), двухосновные (например, щавелевая) и многоосновные (например … Современная энциклопедия
Карбоновые кислоты — КАРБОНОВЫЕ КИСЛОТЫ, органические соединения, содержащие одну или несколько карбоксильных групп COOH. По числу таких групп различают одноосновные карбоновые кислоты (например, уксусная), двухосновные (например, щавелевая) и многоосновные (например … Иллюстрированный энциклопедический словарь
КАРБОНОВЫЕ КИСЛОТЫ — КАРБОНОВЫЕ КИСЛОТЫ, класс органических химических соединений, содержащих группу СООН. Наиболее распространенным из них является УКСУСНАЯ КИСЛОТА, СН3СООН, входящая в состав уксуса. Эти кислоты слабые, они образуют соли с основаниями и эфиры со… … Научно-технический энциклопедический словарь
КАРБОНОВЫЕ КИСЛОТЫ — органические соединения, содержащие карбоксильную (см.) СООН. По числу этих групп определяют одно (моно), двух (ди) и многоосновные кислоты. К. к. обычно значительно слабее минеральных. Образуют соли, а с замещением группы ОН различные… … Большая политехническая энциклопедия
КАРБОНОВЫЕ КИСЛОТЫ — органические соединения, содержащие одну или неск. карбоксильных групп. В организмах обнаружены К. к. алифатического (жирные кислоты), ароматического (бензойная, коричная, салициловая), алициклического (камфорная, хаульмугровая, хинная,… … Биологический энциклопедический словарь
Карбоновые кислоты — органические соединения, содержащие карбоксильную группу COOH. По числу карбоксильных групп К. к. могут быть одно , двух и многоосновными. В зависимости от радикала, связанного с карбоксилом, различают алифатические (предельные и непредельные),… … Российская энциклопедия по охране труда
карбоновые кислоты — органические соединения, содержащие одну или несколько карбоксильных групп СООН. Различают карбоновые кислоты одноосновные RCOOH (уксусная, бензойная), двухосновные R(COOH)2 (щавелевая, фталевая) и многоосновные (лимонная) (R органический… … Энциклопедический словарь
карбоновые кислоты — Органические кислоты, органические соединения, содержащие одну или несколько карбоксильных групп ( СООH). По числу этих групп подразделяются на моно , ди , три и поликарбоновые (соответственно одно , двух , трех и многоосновные кислоты).… … Текстильный глоссарий
карбоновые кислоты — (см. карбо. ) класс органических соединений, содержащих карбоксильную группу соон; карбоновые кислоты находят самое разнообразное практическое применение. Новый словарь иностранных слов. by EdwART, , 2009 … Словарь иностранных слов русского языка
Карбоновые кислоты
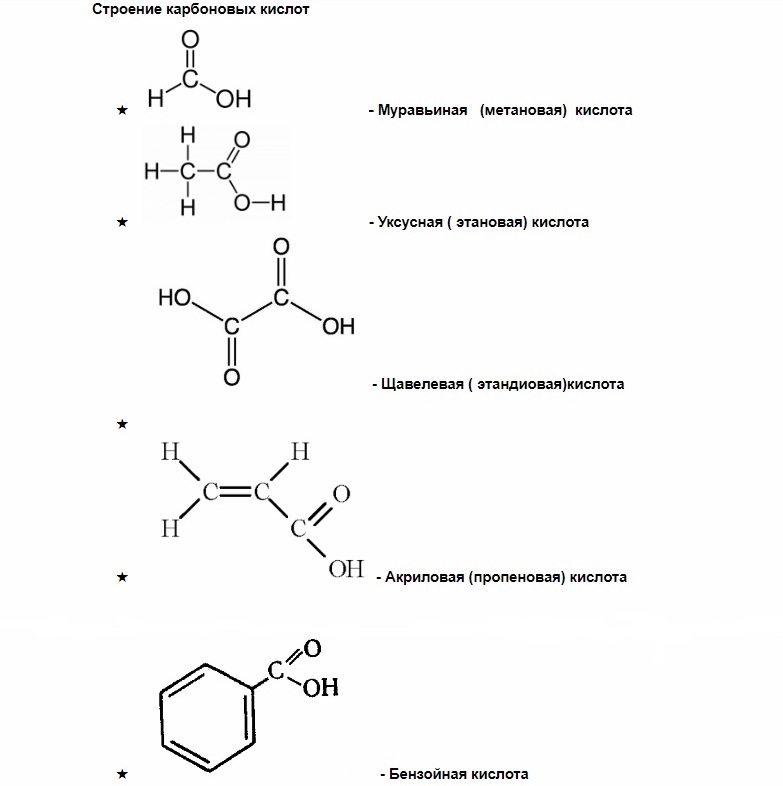
Если внимательно посмотреть на представленные химические формулы, во всех можно заметить общую часть  , при записи химических формул используется буквенное обозначение СООН .
, при записи химических формул используется буквенное обозначение СООН .
Эта часть называется карбоксильной группой , именно она определяет общие свойства, характерные для всей группы карбоновых кислот.
Карбоксильная группа, в свою очередь, делится на карбонильную группу С=О и гидроксильную группу О-Н.
Карбоновые кислоты — группа органических веществ, в состав которых входят одна или несколько карбоксильных групп и углеводородный радикал (алкил).
Как вы можете заметить, у муравьиной кислоты одна группа СООН, у щавелевой две, а у лимонной – целых три.
По количеству карбоксильных групп карбоновые кислоты делятся на
В зависимости от структуры углеводородного радикала карбоновые кислоты делятся на
насыщенные — (муравьиная, щавелевая) — все связи углерода одинарные.
ненасыщенные (олеиновая, линолевая) — в составе радикала, между атомами углерода есть двойные связи.
ароматические (бензойная) — в составе радикала есть бензольное кольцо. Хотя имеют специфический запах все карбоновые кислоты, эта группа особенно ароматна.
В группу карбоновых кислот входят вещества с различными углеводородными радикалами. Если количество атомов углерода в составе радикала больше шести — карбоновую кислоту называют жирной .

Номенклатура карбоновых кислот.
Некоторые карбоновые кислоты имеют свои народные или тривиальные названия: муравьиная, уксусная, лимонная и т.д.
Также есть официальное название кислоты в зависимости от углеводородного радикала.
Для того, чтобы правильно назвать карбоновую кислоту, нужно:
1.Определить и пронумеровать самую длинную (главную) углеродную цепочку, считая от атома карбоксильной группы.
2. Назвать согласно номенклатуре углеводород (как это сделать, можно посмотреть в учебнике Химия.10 класс под редакцией Габриеляна на портале LECTA)
3. Добавить -овая кислота.
Получение карбоновых кислот
Первой открыли и начали использовать уксусную кислоту. Как и большинство открытий, произошло это случайно. Содержимое одной из винных бутылок, простояв дольше нужного времени, превратилось из вина в уксус.
На языке науки эта несложная реакция называется окислением спиртов.
Поскольку большинство из карбоновых кислот входят в состав природных продуктов, до сих пор около 30% получают из биологических объектов.
Однако карбоновые кислоты активно используются в фармацевтической, кожевенной, металлообрабатывающей промышленности и получать их химическим путем быстрее и дешевле. Одно дело год ждать превращения уксуса в вино, и совсем другое — окислить подходящий углеводород, добытый на месторождении полезных ископаемых.
Муравьиная кислота — в ряду карбоновых кислот эта самая скромная кислота с единственным атомом углерода в структуре обладает уникальными свойствами за счет одновременного присутствия в структуре карбонильной и карбоксильной групп.
При реакции муравьиной кислоты с аммиачным раствором оксида серебра образуется блестящий осадок — реакция серебряного зеркала.
HCOOH + Ag2O (аммиачный раствор)  CO2 + H2O + 2Ag
CO2 + H2O + 2Ag
Больше интересных материалов:
Способы получения карбоновых кислот в химической промышленности
1. При помощи различных катализаторов (оксид серебра, перманганат калия) окислить подходящий альдегид
2 RCHO + O2  2 RCOOH
2 RCOOH
2. При помощи катализатора провести реакцию окисления спиртов
RCH2OH + O2  RCOOH + H2O
RCOOH + H2O
3. При помощи окисления различных углеводородов (алкинов, алкенов, алкилбензолов) можно получить соответствующие карбоновые кислоты.
2 C4H10 + 5O2 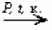 4 CH3COOH + 2 H2O
4 CH3COOH + 2 H2O
Физические свойства карбоновых кислот
Поскольку, карбоновые кислоты довольно разнородная группа веществ, говорить об общих физических свойствах, характерных для всех представителей группы неправомерно.
По количеству атомов углерода, входящих в состав вещества, карбоновые кислоты делятся на:
низшие — количество атомов от 1 до 3 — (муравьиная кислота) прозрачные жидкости с характерным запахом, отлично растворяются в воде
средние — количество атомов от 4 до 9 — ( валериановая кислота) жидкости с резким, неприятным запахом. маслянистые на ощупь.
высшие — количество атомов превышает 9 — (олеиновая кислота) — твердые вещества, нерастворяются в воде.
Молекулярная масса кислоты влияет на температуры плавления и кипения.
Плотность карбоновых кислот (за исключением муравьиной и уксусной кислот) меньше единицы.
Химические свойства карбоновых кислот.
1. Карбоновые кислоты обратимо диссоциируют. Проверить это можно с помощью лакмусовой бумажки. Она покраснеет, как в растворе любой кислоты.
HCOOH  HCOO – + H +
HCOO – + H +
Чем длиннее радикал, тем меньше степень диссоциации, и тем меньше проявляются кислотные свойства.
2. Карбоновые кислоты по своей природе являются слабыми кислотами, и участвуют во всех реакциях, характерных для неорганических кислот. Реагируют с солями, металлами, оксидами и гидроксидами металлов. В результате образуются соли карбоновых соединений и вода.





