Необычные свойства натурального каучука. Синтетический каучук «От жевательной резинки до БелАЗа»
Сок вечнозеленого дерева Гевеи, семейства молочаев, растущего в жарком экваториальном климате, стал ценным сырьем для производства натурального каучука. «Слезы дерева» собранные методом «надсечки» затвердевают на воздухе, принимая нужную форму.
Природа и наука
Индейцы Майя изготавливали таким образом некое подобие мячика. Однако, каучук в чистом виде имеет несколько физических свойств, которые надолго отложили его массовое использование по миру.
От высоких температур каучук становится липким, может растекаться, издавая довольно неприятный запах. При низких температурах промерзает, дает трещины.

Но наука шла вперед, ученый химик Чарльз Нельсон Гудьира провел опыт для улучшения физических свойств каучука. Взаимодействие с химическим элементом серой привело полученный полимер к повышенной прочности, эластичности, свойствами звукоизоляции, водонепроницаемости, непроводимости электричества и тепла. Этот эксперимент открыл латексу дверь в мировые отрасли.
Натуральный каучук
«Золотое дерево» имеет статус народного достояния. Оно находится под охраной закона. Вывоз семян строго пресекается. Так было и в самом начале пути к славе. Вывоз семян с Бразилии, которая в те времена была единственным поставщиком ценного сырья, каралось смертной казнью.

Однако, были мореплаватели, рискующие своей головой, которые пробовали это сделать. Одним из них был британский шпион. Именно, ему улыбнулось счастье, и он переправил в своем трюме около семидесяти семян гевеи. Вся партия была продана в Ботанический сад Кью.
Даже при соблюдении правил выращивания, создании климатических условий взросло всего лишь две тысячи всходов. Остальные погибли. Эти саженцы были разосланы во все британские колонии для закладки плантаций каучуконосных деревьев.
Далее, все больше распространяясь по свету, сырье стало получать отрасли применения.
Природный каучук
Гевея одаривает человечество своим ценным соком. Его применение постоянно модифицировалось.
Свойства материала
Многие ученые старательно пытались найти пути решения. Например, химик Макинтош, шотландского происхождения, предложил прокладывать между тканями силиконовую прослойку.
Это было настолько необычно, настолько удобно в использовании, что начался настоящий каучуковый бум. Плащи получили название по фамилии химика. Непромокающая верхняя одежда снискала любовь многих людей. Чуть позже был придуман способ надевать неуклюжие бесформенные «галоши» на обувь.

Особым свойством, притягивающим человека к каучуку, является его эластичность. Но мы уже сказали, что при определенных условиях это свойство пропадает.
Эластичность — удивительное свойство материала, при внешней деформации возвращаться в изначальную форму.
Химическое строение, формула, состав
Полимер, насыщенный С, при огромном числе двойных связей и есть природный каучук. Химики записывают его следующим образом: (С5Н8) n. Степень полимеризации (n) колеблется в диапазоне одна тысяча-три тысячи единиц. Называется изопреном.
Химическим путем можно сказать, что каучук относят к углеводородам (благодаря составу молекулы: С, Н).
Тип углеводородных связей объясняет, что в момент растягивания молекула имеет завидную длину, причем выглядит, как зигзаг. Сравнимы с пружинками.
Категории натурального каучука
Выделяют основные категории природного каучука:
- Смокед-шит— особо ценный тип латекса. В переводе он звучит «закопченный лист». Представляет собой пластинки янтарного цвета, прозрачен, имеет рифленую поверхность.
- Светлый креп— непрозрачный однотонный кремовый окрас. Имеет в своем составе добавки в виде бисульфата Na. Получают путем желирования.
- Пара-каучук — кустарный способ выделки из дикорастущих видов деревьев.
Всего на натуральный каучук приходится восемь типов, которые образуют при помощи технологий и добавок тридцать пять сортов.
Синтетический каучук
Распространившись по всему миру, каучук нашел не только поклонников, но и исследователей. Страны, находящиеся в зависимости от импортного товара, были заинтересованы в получении своего сырья.
История создания
В конце девятнадцатого века французский ученый Бушарда синтезировал нечто похожее на силикон.
На рубеже девятнадцатого-двадцатого веков российский химик И. Кондаков смог получить эластановый полимер. На его основе в Германии появились первые выпуски синтетического сырья. Они использовались на подводных лодках. Однако в массовое производство он не пошел.
Особый вклад в получение синтетического латекса внес российский ученый С. Лебедев. Почти всю свою научную жизнь он посвятил получению каучука. Его исследования были отмечены специальной премией РАН.

После объявления правительством Советского Союза о конкурсе разработки широкого производства латекса для всей страны и за рубеж, Лебедев с командой единомышленников успешно нашел решение.
Так был получен дешевый способ синтезирования. В 1932 году впервые во всем мире Советский Союз наладил получение каучука в промышленном размахе. За ней, через четыре года аналогичное производство получила Германия.
Применение синтетических каучуков
В наши дни синтетическое сырье имеет внушительный ассортимент. Разделяется по составу, свойствам, применению. Классификация идет по названию мономера, группе атомов.
Основной прием синтезирования — это полимеризация диенов, алкенов. Мономеры: стирол, этилен, изобутен и т. д.

Сфера применения очень велика: резина, обувная промышленность, различные шланги, изоляционные материалы, герметики, клеевая основа, красочный арсенал.
Вулканизация каучука
- Получение заготовок: взвешивание каучука и компонентов, резиновая пластификация, прорезинка ткани, резка для сборки, транспортировки.
- Вулканизация. Получение готового изделия. Вулканизация — технологический процесс, при котором в процессе нагревания молекулы серы присоединяются к молекулам каучука. В результате получается огромная молекула, имеющая три измерения.
Нефтехимия вокруг
По статистике в современной жизни человечество использует в повседневной жизни около сорока тысяч изделий из каучука, его производных. Как бы мы жили без автомобилей, автобусов, велосипедов.

Трудно представить себе агротехнику без комбайнов и тракторов. Везде в них используются каучуковые покрышки.
Пищевая промышленность представляет любимое лакомство для взрослых и детей — жевательную резинку, на четверть состоящую из латекса.
Авиастроение, ракетостроение, бытовая промышленность, медицинское оборудование, электроприборы и другие отрасли народного хозяйства.
Натуральный каучук — основные свойства, производство, применение

КАУЧУК натуральный (НК) – природный полимер 1,4-цис-полиизопрен, получаемый из натурального латекса коагуляцией (осаждением) кислотами. Синтетические каучуки (СК) – большая группа полимерных материалов разнообразного строения и назначения. Каучуки относятся к эластомерам – высокомолекулярным соединениям, обладающим в определенном температурном интервале способностью к большим обратимым деформациям.
Необычные свойства натурального каучука
Натуральный каучук – это углеводород, который содержится в соке Гевеи (его также называют латексом) и некоторых других растениях — каучуконосах. Натуральный каучук в чистом виде в холод трескается, а в жару растекается и, к тому же, имеет неприятный запах. Именно поэтому до открытия вулканизации изделия из каучука не имели большого успеха.
Стараниями ученого Чарльза Гудьира стало известно, что при взаимодействии натурального каучука и серы свойства данного полимера заметно улучшаются. Вулканизированный каучук обладает повышенной прочностью, эластичностью, высокими электро-, тепло-, звукоизоляционными и водонепроницаемыми свойствами. Именно благодаря этим свойствам сферы и области применения натурального каучука весьма обширны.
Синтетические каучуки
Разработка синтетических каучуков впервые началась в России в 1900 году учениками Бутлерова — Кондаковым, Фаворским, Лебедевым, Бызовым. В 1900 году И. Л. Кондаков впервые получил синтетическим путём изопрен, изучением полимеризации которого занялся А. Е. Фаворский. В 1903—1910 годах параллельно группами учёных под руководством Сергея Васильевича Лебедева и Бориса Васильевича Бызова велись работы по получению синтетического каучука на основе 1,3-бутадиена методом гидролиза нефтяного сырья. Одновременно и независимо подобные работы велись в Англии. Впервые технология производства бутадиенового синтетического каучука разработана в лаборатории завода «Треугольник» Б. В. Бызовым, получившим за это изобретение в 1911 году премию имени Бутлерова. Однако патент на это изобретение был оформлен только в 1913 году. Во время Первой мировой войны на заводе «Треугольник» был освоен выпуск противогазов из синтетического каучука Бызова.
Первый патент на процесс получения бутадиенового синтетического каучука с использованием натрия в качестве катализатора полимеризации был выдан в Англии в 1910 году. Первое маломасштабное производство синтетического каучука по технологии, сходной с описанной, в английском патенте имело место в Германии во время Первой мировой войны. Производство бутадиена в России началось в 1915 году по технологии, разработанной И. И. Остромысленским, позднее эмигрировавшим в США. В СССР работы по получению синтетического каучука были продолжены Б. В. Бызовым и С. В. Лебедевым, в 1928 году разработавшим советскую промышленную технологию получения бутадиена. Коммерческое производство синтетического каучука началось в 1919 году в США (Thiokol), и к 1940 году в мире производилось более 10 его марок. Основными производителями были США, Германия и СССР. В СССР производство синтетического каучука было начато на заводе СК-1 в 1932 году по методу С. В. Лебедева (получение из этилового спирта бутадиена с последующей анионной полимеризацией жидкого бутадиена в присутствии натрия). Прочность на разрыв советского синтетического каучука составляла около 2000 psi (для натурального каучука этот показатель составляет 4500 psi, для Неопрена, производство которого было начато компанией Du Pont (США) в 1931 году — 4000 psi). В 1941 году в рамках поставок по программе ленд-лиза СССР получил более совершенную технологию получения синтетического каучука.
В Германии бутадиен-натриевый каучук нашёл довольно широкое применение под названием «Буна».
Синтез каучуков стал значительно дешевле с изобретением катализаторов Циглера — Натта.
Изопреновые каучуки — синтетические каучуки, получаемые полимеризацией изопрена в присутствии катализаторов — металлического лития, перекисных соединений. В отличие от других синтетических каучуков изопреновые каучуки, подобно натуральному каучуку, обладают высокой клейкостью и незначительно уступают ему в эластичности.
В настоящее время большая часть производимых каучуков является бутадиен-стирольными или бутадиен-стирол-акрилонитрильными сополимерами.
Каучуки с гетероатомами в качестве заместителей или имеющими их в своём составе часто характеризуются высокой стойкостью к действию растворителей, топлив и масел, устойчивостью к действию солнечного света, но обладают худшими механическими свойствами. Наиболее массовыми в производстве и применении каучуками с гетерозаместителями являются хлоропреновые каучуки (неопрен) — полимеры 2-хлорбутадиена.
В ограниченном масштабе производятся и используются тиоколы — полисульфидные каучуки, получаемые поликонденсацией дигалогеналканов (1,2-дихлорэтана, 1,2-дихлорпропана) и полисульфидов щелочных металлов.
Основные типы синтетических каучуков:
Состав резины
- Каучук натуральный или синтетический
- Вулканизирующий агент – сера, тиурам , селен, перекиси, ионизирующая радиация.
- Ускорители вулканизации — полисульфиды, оксиды свинца, магния
- Антиоксиданты (вещества замедляющие скорость старения резины) — альдоль, неозон Д, парафин, воск)
- Пластификаторы (вещества, улучшающие эластичность резины) — парафин, вазелин, стеариновую кислоту, битумы, дибутилфталат, растительные масла. Их массовая доля составляет 8—30 % от массы каучука.
- Наполнители активные и неактивные. Активные наполнители — кремнекислота, оксид цинка; неактивные наполнители — мел, тальк, барит
- Регенерат (продукт переработки старых резиновых изделий и отходов резинового производства).
- Красители — минеральные или органические красящие вещества.
Назначение будущего изделия, условий его эксплуатации, технических требований к нему и т.д. определяет выбор каучука и состава резиновой смеси.
Производство изделий из резины включает этапы смешения каучука с ингредиентами в смесителях, изготовления полуфабрикатов и их раскроя, сборки заготовок изделия при помощи сборочного оборудования и вулканизацию изделий в прессах, котлах, автоклавах и др.
Каучук, свойства и характеристики, получение и применение




Каучук – это природный или синтетический продукт полимеризации некоторых диеновых углеводородов с сопряженными связями.
Каучук – что это?
Натуральный каучук, характеристики и свойства
Где содержится? Получение натурального каучука
Химическое строение натурального каучука и его состав
Типы и виды натурального каучука
Синтетический каучук, виды, его свойства, получение
Применение натурального и синтетического каучука
Применение натурального каучука в других отраслях
Помимо шин и резины натуральный каучук используют для производства других различных изделий, таких как лакокрасочные изделия, клеи, наклейки, покрытия для пола, шланги, транспортеры, приводные ремни, амортизаторы, электроизоляционные материалы. Также натуральный каучук пригодился и в строительной сфере для модификации бетона и других строительных смесей.
Многие изделия, которые повседневно применяются в домашнем хозяйстве, изготовлены из данного вида каучука. К таким изделиям можно отнести канцелярские принадлежности, игрушки, некоторую мебель, контрацептивы, обувь, ткань и одежду. Так как каучук не растворяется в воде, слабых кислотах и щелочах, он активно используется для изготовления перчаток. Выпускают латексные перчатки для различных целей – бытовых, строительных и медицинских.
Натуральный каучук – очень ценное вещество. Потребовалось немало времени и усилий, чтобы понять, как применить его наиболее выгодно и максимально полезно. Но эти усилия не потрачены зря, о чем говорят многочисленные сферы и области применения натурального каучука.
Где содержится? Получение натурального каучука:
Для природных каучуков сырьевым источником служит млечный сок некоторых растений, выделяющих латекс (белая жидкость с особыми свойствами). Сам латекс является довольно распространенным компонентом растений и встречается у представителей каучуконосных растений разных ботанических групп.
Находится он в разных частях растений. Поэтому их (т.е. растения) классифицируют следующим образом:
1. латексные, когда вещество накапливается в млечном соке,
2. хлоренхимные – вещество накапливается в молодых зеленых побегах и листьях,
3. паренхимные – вещество накапливается в корнях и стеблях,
4. травянистые латексные растения семейства сложноцветных – это кок-сагыз, крым-сагыз и другие, где каучук в небольшом количестве накапливается в подземных органах. Эти растения не используются в промышленном производстве каучука.
Каучуконосные деревья растут в основном в зоне экватора, не удаляясь от него больше, чем 10° на север и юг, т. е. это пояс шириной 1300 км и его так и называют: «каучуковый пояс». Именно здесь выращивают каучуконосные деревья для промышленного применения в мировом масштабе. В основном натуральный каучук получают из латекса тропического дерева гевеи бразильской. Для этого на коре дерева, достигшего 5-летнего возраста, делают V-образные надрезы. С одного дерева гевеи получают в среднем 2-3 кг каучука.
Чтобы получился каучук, добытый из гевеи бразильской, млечный сок (латекс) подвергают процессу свертывания или желатинирования, добавляя в него уксусную или муравьиную кислоту, после промывают водой, прокатывают в листы и коптят.
История создания
Важное практическое значение имеет вулканизированный продукт – резина. Вулканизация каучука представляет собой специально обработанную смесь каучука и серы при воздействии температуры. Линейные молекулы каучука в местах двойных связей сшиваются атомами серы, образуя дисульфидные мостики.. Такой продукт имеет трехмерную структуру и обладает повышенной прочностью, эластичностью, изностойкостью и другими полезными свойствами. При массовой доле серы 1-5 % — продукт эластичный, мягкий; 30% — жесткий, твердый (эбонит).
Химическое строение натурального каучука и его состав. Формула каучука:
Натуральный каучук является полимерным ненасыщенный углеводородом, имеющим большое количество двойных связей. Его универсальная химическая формула выглядит так: (C5H8)n, где степень полимеризации (n) составляет 1000-3000 единиц. Мономер натурального каучука называется изопреном.
При химическом анализе природного каучука видно, что он состоит только из углерода и водорода. Это позволяет отнести его к углеводородам. Подтверждением этому есть первичная формула каучука. Молекулярная масса отдельных единиц может превышать полумиллион грамм на моль. Таким образом, натуральный каучук является природным полимером изопрена, а точнее цис-1,4-полиизопрена.
Если представить молекулу каучука не атомарно тонкой, ее можно было бы разглядеть в микроскоп, вследствие того, что она очень длинная. А если ее еще и максимально растянуть, то получится большая зигзагоподобная линия. Это обусловлено типом углеродных связей.
По причине того, что в изопрене чередуются одинарные и двойные связи, части молекулы могут вращаться только вокруг одинарных связей. И в результате подобных колебаний молекула постоянно изгибается, и даже в состоянии покоя у нее сближены концы.
Молекулы натурального каучука похожи на почти круглые пружины, что позволяет им легко и сильно растягиваться и увеличиваться в размерах при разведении концов.
Типы и виды натурального каучука:
Натуральный каучук делят на 8 типов, образующих 35 сортов.
Самым распространенным и ценным типом натурального каучука считается «смокед-шит», что означает копченый лист. Он изготавливается в виде достаточно прозрачных листов цвета янтаря с рифленой поверхностью.
Меньше распространен тип называемый «светлый креп». Для его получения к латексу перед желатинированием добавляют для отбеливания бисульфит натрия. Листы этого типа каучука имеют кремовый оттенок, они непрозрачны.
Меньше всего ценится тип, который называют «пара-каучук». Его добывают из дикорастущей гевеи кустарным способом.
Примеры некоторых синтетических каучуков
Среди каучуков общего назначения по-прежнему широко распространены бутадиеновые СКД. (стереорегулярный 1,4-цис-полибутадиен)
и изопреновые (1,4-цис-полиизопрен) каучуки.
Они обладают высокой прочностью, эластичностью, износостойкостью и невысокой стоимостью, что обуславливает их широкое применение в производстве разнообразных резиновых изделий. Для модификации потребительских свойств каучуков широко используют сополимеризацию – диен полимеризуют с добавлением какого-либо алкена. Такой полимер состоит из элементарных звеньев двух различных типов. Таким сополимером является еще один распространенный СК – бутадиенстирольный каучук (СКС),
который применяется не только при производстве резиновых изделий, но также является основой строительного латекса и латексно-эмульсионных красок.
Бутилкаучук (БК) – сополимер 2-метилпропена с небольшим количеством изопрена –
относится уже к каучукам специального назначения, т.к. обладает высокой стойкостью к различным воздействиям, поэтому его используют для электроизоляции, антикоррозионных и теплостойких покрытий.
Полихлоропреновые каучуки (наирит, неопрен) –
один из наиболее давно известных видов синтетических каучуков – разработаны компанией «Дюпон» в 1930-х. Обладают высокой масло-, бензо-, озоностойкостью. С высокой масло-, бензо- и теплостойкостью связано также и применение бутадиенакрилонитрильного (СКН) каучука.
Высокая прочность при растяжении и стойкость к различным воздействиям полиуретанов обуславливает их разнообразное применение – от искусственной кожи для производства обуви до изготовления износостойких покрытий, клеев и герметиков.
В экстремальных условиях «работают» фторкаучуки – сополимеры фторированных или частично фторированных алкенов. Высокая теплостойкость, инертность к воздействиям агрессивных сред – растворителей, кислот, сильных окислителей, негорючесть, стойкость к УФ-облучению позволяет использовать эти уникальные вещества для работы в условиях высоких температур, в агрессивных средах для изоляции проводов и антикоррозионной защиты аппаратуры.
А вот кремнийорганические каучуки – полиорганосилоксаны –
помимо тепло- и морозостойкости и высоких электроизоляционных свойств обладают еще и физиологической инертностью, что обуславливает их применение в изделиях пищевого и медицинского назначения.
Екатерина Менделеева
Синтетический каучук, виды, его свойства, получение, производство и синтез:
В XX веке с появлением автомобильной промышленности стал расти спрос на резину, значит и на каучук. Поэтому на каучук, получаемый из сока гевеи, появился дефицит. Встал вопрос получения синтетического каучука. В 1927 году советский ученый С.В. Лебедев получил первый синтетический дивиниловый каучук с помощью реакции полимеризации 1,3-бутадиена при помощи натриевого катализатора. Теперь он стал настолько популярным, что почти вытеснил собой натуральный каучук. Синтетический каучук разделяют на более чем 30 типов, которые образуют свыше 220 марок.
В настоящее время в России выпускается синтетический каучук специального и общего назначения. Кроме того, синтетический каучук подразделяют на стереорегулярный и нестереорегулярный. Стереорегулярный, более прочный и износостойкий, чем натуральный каучук. Он применяется, например, как исходный материал для автомобильных покрышек. Нестереорегулярный – используют в производстве эбонита и резины, более стойкой к воздействию агрессивных сред.
Синтетическими каучуками общего назначения считаются:
- 1. бутадиеновый каучук,
- 2. изопреновый каучук,
- 3. бутадиен-стирольный каучук,
- 4. бутил-каучук,
- 5. этилен-пропиленовый каучук,
- 6. хлоропреновый (наирит)каучук и пр.
Синтетическими каучукам специального назначения являются:
- 1. бутадиен-нитрильный каучук,
- 2. кремнийорганический каучук,
- 3. уретановый СКУ,
- 4. полисульфидный каучук,
- 5. фторосодержащий каучук,
- 6. метилвинилпиридиновый каучук,
- 7. силоксановыйкаучук и т.д.
Ученые постоянно занимаются синтезом искусственных каучуков, которые по своим качествам представляют собой более совершенный материал, чем природные. Например, по своим свойствам замечательными веществами являются сополимеры стирола, бутадиена и акрилонитрила. Во время процесса полимеризации их цепочка строится чередованием бутадиена с соответствующим другим мономером. Это позволяет достигать отличных свойств, которых нет у классических каучуков.
В России сейчас изготавливают классический синтетический каучук, свойства которого схожи со свойствами натурального вещества. При вулканизации такого каучука получается резина, прочность, эластичность и пластичность которой практически не отличается от подобных, свойственных природному материалу.
Химические связи
Химическая связь – связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.

Ковалентная связь ( лат. со – совместно + valens – имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной связью. В таких молекулах нет “полюса” – электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2, N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной. В таких молекулах имеется “полюс” – электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3, H2O.

Ковалентная связь может быть образована по обменному механизму – обобществлению электронной пары. В таком случае каждый атом “одинаково” вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4 + – в ионе аммония
- NH4 + Cl, NH4 + Br – внутри иона аммония во всех его солях
- NO3 – – в нитрат ионе
- KNO3, LiNO3 – внутри нитрат иона во всех нитратах
- O3 – озон
- H3O + – ион гидроксония
- CO – угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] – во всех комплексных солях есть хотя бы одна ковалентная связь, возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь – один из видов химической связи, в основе которого лежит электростатическое взаимодействие между противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.

Металлическая связь
Металлическая связь – вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является наличие высокой концентрации в металлах электронов проводимости – “электронного газа”. По природе металлическая связь близка к ковалентной.
“Облако” электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.

Водородная связь
Водородная связь – вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых ошибок считать, что в самом газе, водороде, имеются водородные связи – это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH

Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Типы химических связей, схема образования и свойства
Ключевые слова конспекта. Химическая связь: ковалентная (полярная и неполярная), ионная, металлическая.
Силы, которые удерживают атомы в молекулах, называются химическими связями.
Образование химической связи происходит в том случае, если этот процесс сопровождается выигрышем энергии. Эта энергия возникает, если каждый атом, образующий химическую связь, получает устойчивую электронную конфигурацию.
По способу образования и существования химическая связь может быть ковалентной (полярной, неполярной), ионной, металлической.
Ковалентная химическая связь
■ Ковалентная химическая связь — это связь, возникающая между атомами путем образования общих электронных пар за счет неспаренных электронов.
Внешние уровни большинства элементов периодической системы (кроме благородных газов) содержат неспаренные электроны, то есть являются незавершенными. В процессе химического взаимодействия атомы стремятся завершить свой внешний электронный уровень.
Например, электронная формула атома водорода: 1s 1 . Ее графический вариант: 
Таким образом, атом водорода в химических реакциях стремится завершить свой внешний 1 s-уровень одним s-электроном. При сближении двух атомов водорода происходит усиление притяжения электронов одного атома к ядру другого атома. Под действием этой силы расстояния между ядрами атомов сокращаются и в результате их электронные орбитали перекрывают друг друга, создавая общую электронную орбиталь — молекулярную. Электроны каждого из атомов водорода через область перекрывания орбиталей мигрируют от одного атома к другому, то есть образуют общую электронную пару. Ядра будут сближаться до тех пор, пока нарастающие силы отталкивания одноименных зарядов не уравновесят силы притяжения.
Переход электронов с атомной орбитали на молекулярную сопровождается снижением энергии системы (более выгодное энергетическое состояние) и образованием химической связи:

Подобным образом образуются общие электронные пары при взаимодействии атомов р-элементов. Так образуются все двухатомные молекулы простых веществ. При образовании F2 и Cl2 перекрываются по одной р-орбитали от каждого из атомов (образуется одинарная связь), а при взаимодействии атомов азота перекрываются по три р-орбитали от каждого и в молекуле азота N2 образуется тройная связь.
Электронная формула атома хлора: 1s 2 2s 2 2p 6 3s 2 3p 5 . Графическая формула: 
Таким образом, на внешней орбитали атом хлора содержит один неспаренный р-электрон. Взаимодействие двух атомов хлора будет происходить по следующей схеме: 
Электронная формула атома азота: 1s 2 2s 2 2p 3 . Графическая формула:

На внешней орбитали атома азота находятся 3 неспаренных р-электрона. Взаимодействие двух атомов азота будет происходить по следующей схеме: 
Прочность связей в молекуле определяется количеством общих электронных пар у ее атомов. Двойная связь прочнее одинарной, тройная — прочнее двойной.
С увеличением количества связей между атомами сокращается расстояние между ядрами атомов, которое называют длиной связи, и увеличивается количество энергии, необходимое для разрыва связи, которое называется энергией связи. Например, в молекуле фтора связь одинарная, ее длина составляет 1,42 нм (1 нм = 10 –9 м), а в молекуле азота связь тройная, ее длина — 0,11 нм. Энергия связи в молекуле азота в 7 раз превышает энергию связи в молекуле фтора.
При взаимодействии атома водорода с атомом хлора оба атома будут стремиться завершить свои внешние энергетические уровни: водород — 1 s-уровень и хлор — 3р-уровень. В результате их сближения происходит перекрывание 1 s-орбитали атома водорода и 3р-орбитали атома хлора, а из соответствующих неспаренных электронов формируется общая электронная пара:
В молекулах Н2 и HCl область перекрывания орбиталей атомов водорода расположена в одной плоскости — на прямой, соединяющей центры атомных ядер. Такая связь называется σ-связью (сигма-связью):
Однако если в молекуле формируется двойная связь (с участием двух электронных орбиталей), то одна связь будет σ-связью, а вторая будет образована между орбиталями, расположенными параллельно друг другу. Параллельные орбитали перекроются с образованием двух общих участков, расположенных сверху и снизу от линии, соединяющей центры атомов.
Химическая связь, образующаяся в результате бокового перекрывания орбиталей — в двух местах, называется π-связью (пи-связью):
При образовании ковалентной связи меду атомами с одинаковой электроотрицательностью (Н2, F2, O2, N2) общая электронная пара будет располагаться на одинаковом расстоянии от атомных ядер. При этом общие электронные пары принадлежат в равной степени обоим атомам одновременно, и ни на одном из атомов не будет избыточного отрицательного заряда, который несут на себе электроны. Такой вид ковалентной связи называется неполярной.
■ Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):
В результате на атомах соединения образуются частичные заряды Н +0,18 и Cl –0,18 ; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
■ Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается незначительно.
Образовавшийся частичный заряд на атомах в молекуле обозначают греческой буквой 8 (дельта), а направление смещения электронной пары — стрелкой:
Ионная химическая связь
В случае химического взаимодействия между атомами, электроотрицательность которых резко отличается (например, между металлами и неметаллами), происходит почти полное смещение электронных облаков к атому с большей электроотрицательностью. При этом, поскольку заряд ядра атома имеет положительное значение, атом, который почти полностью отдал свои валентные электроны, превращается в положительно заряженную частицу — положительный ион, или катион. Атом, получивший электроны, превращается в отрицательно заряженную частицу — отрицательный ион, или анион: 
Ион — это одноатомная или многоатомная отрицательно либо положительно заряженная частица, в которую превращается атом в результате потери или присоединения электронов.
Между разноименно заряженными ионами при их сближении возникают силы электростатического притяжения — положительно и отрицательно заряженные ионы сближаются, образуя молекулу вещества.
■ Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения.
Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl – , Н + , Na + , так и сложными (многоатомными): NH4 – . Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь
Между атомами металлов возникает особый вид химической связи, которая называется металлической. Образование этой связи обусловлено тремя особенностями строения атомов металлов:
- на внешнем энергетическом уровне присутствуют 1—3 электрона (исключения: атомы олова и свинца (4 электрона), атомы сурьмы и висмута (5 электронов), атом полония (6 электронов));
- атом имеет сравнительно большой радиус;
- атом имеет большое количество свободных орбиталей (например, у Na один валентный электрон располагается на 3-м энергетическом уровне, который имеет десять орбиталей (одну s-, три р- и пять d-орбиталей).
При сближении атомов металлов происходит перекрытие их свободных орбиталей, и валентные электроны получают возможность перемещаться на близкие по значениям энергии орбитали соседних атомов. Атом, теряющий электрон, превращается в ион. Таким образом, в металле формируется совокупность электронов, свободно перемещающихся между ионами. Притягиваясь к положительным ионам металла, электроны восстанавливают их, а затем снова отрываются, переходя к другим ионам. Такой процесс превращения атомов в ионы и обратно происходит в металлах непрерывно. Частицы, из которых состоят металлы, называют атом-ионами.
■ Металлическая связь — это связь, образующаяся между атом-ионами в металлах и сплавах посредством постоянного перемещения между ними валентных электронов:

Конспект урока «Химическая связь: ковалентная, ионная, металлическая».
Химическая связь: определение, типы, свойства
Содержание:
Химическая связь, ее типы, свойства, наряду с химическими реакциями является одним из краеугольных камней интересной науки под названием химия. В этой статье мы разберем все аспекты химических связей, их значение в науке, приведем примеры и многое другое.
Определение
Под химической связью в химии понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений, в этом заключается природа химической связи.
Типы связей
Механизм образования химической связи сильно зависит от ее типа или вида, в целом различаются такие основные виды химической связи:
- Ковалентная химическая связь (которая в свою очередь может быть полярной и неполярной)
- Ионная связь
- Водородная связь
- Химическая связь металлов
Что касается ковалентной химической связи, то на нашем сайте ей посвящена отдельная статья, и более детально вы можете почитать по ссылке. Далее же мы разберем более детально все другие основные типы химических связей.
Ионная связь
Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.
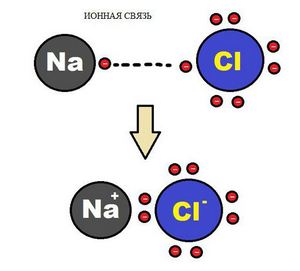
Схема ионной химической связи.
Характерной особенностью ионного типа химичечкой связи является отсутствие у нее насыщенности, и как результат, к иону или даже целой группе ионов может присоединиться самое разное количество противоположно заряженных ионов. Примером ионной химической связи может служить соединение фторида цезия CsF, в котором уровень «ионости» составляет практически 97%.
Водородная связь
Еще задолго до появления современной теории химических связей в ее современном виде учеными химиками было замечено, что соединения водорода с неметаллами обладают различными удивительными свойствами. Скажем, температура кипения воды и вместе со фтороводородом гораздо выше, чем это могло бы быть, вот вам готовый пример водородной химической связи.
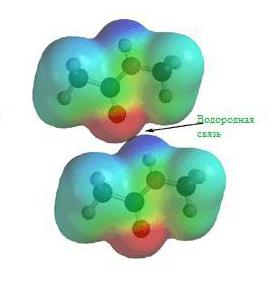
На картинке схема образования водородной химической связи.
Природа и свойства водородной химической связи обусловлены способностью атома водорода H образовывать еще одну химическую связь, отсюда собственно и название этой связи. Причиной образования такой связи являются свойства электростатических сил. Например, общее электронное облако в молекуле фтороводорода настолько смещено в сторону фтора, что пространство вокруг атома этого вещества насыщено отрицательным электрическим полем. Вокруг атома водорода, тем более лишенного своего единственного электрона, все с точностью до наоборот, его электронное поле значительно слабее и как следствие имеет положительный заряд. А положительные и отрицательные заряды, как известно, притягиваются, таким нехитрым образом и возникает водородная связь.
Связь металлов
Какая химическая связь характерна для металлов? У этих веществ есть свой собственный тип химической связи – атомы всех металлов расположены не абы как, а определенным образом, порядок их расположения называется кристаллической решеткой. Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.
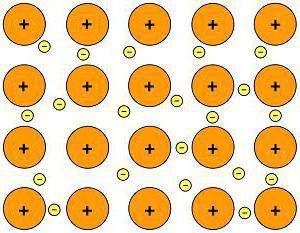
Так выглядит металлическая химическая связь.
В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.
Как определить вид связи
В зависимости от веществ, принимающих в ней участие, если метал и неметалл, то связь ионная, если два метала, то металлическая, если два неметалла то ковалентная.
Свойства связей
Чтобы провести сравнение разных химических реакций используются разные количественные характеристики, такие как:
- длина,
- энергия,
- полярность,
- порядок связей.
Разберем их подробнее.
Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью. Обычно измеряется экспериментально.
Энергия химической связи определяет ее прочность. В данном случае под энергией подразумевается усилие, необходимое, для того, чтобы разорвать химическую связь и разъединить атомы.
Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов. Способность атомов смещать к себе электронную плотность или говоря простым языком «тянуть одеяло на себя» в химии называют электроотрицательностью.
Порядок химической связи (другими словами кратность химической связи) – это число электронных пар, вступающих в химическую связь. Порядок может быть, как целым, так и дробным, чем он выше, тем большее число электронов осуществляют химическую связь и тем труднее ее разорвать.
Видео
И в завершение познавательное видео об разных видах химической связи.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту pavelchaika1983@gmail.com или в Фейсбук, с уважением автор.
Похожие посты:
- Ковалентная связь: полярная, неполярная, механизмы ее появления
- Цепные молекулы
- Кристаллические решетки в химии
- С радиолокатором внутрь клетки
- Пептидная связь: образование, строение, свойства
Один комментарий
1. ионость-это степень ионНости связи?
2. Под энергией связи подразумевается не усилие, а по определению называют количество энергии, необходимое для разрыва связи. На всякий случай -сила и энергия это величины, имеющие разную размерность.
3. Вы пишете: “Электроны различных атомов образуют общее электронное облако, при этом они слабо взаимодействуют друг с другом.” Вы наверное имели в виду ВАЛЕНТНЫЕ электроны? Кто слабо взаимодействует друг с другом? Что-то в вашей металлической кристаллической решетке “выключает” кулоновское взаимодействие между электронами, образующих т.н. электронный газ?
4. Вы пишете: “Длина связи – равновесное расстояние между ядрами атомов, которые соединены химической связью.” Какое равновесие вы имеете в виду? А если двухатомная молекула колеблется? Это расстояние постоянно меняется? Лучше уж скажите “среднее”. Интуитивно понятно о чем речь, но чувствуется какая-то нестрогость в изложении и поэтому так и хочется придраться.
5. Вы пишете: “Полярность химической связи показывает, насколько электронная плотность смещена к одному из атомов.” Наверное вы имеете в виду смещение электронной плотности ОБЩЕЙ электронной пары?
6. Вы пишете: “Образование ионной химической связи возникает при взаимном электрическом притяжении двух ионов, имеющих разные заряды. Ионы обычно при таких химических связях простые, состоящие из одного атома вещества.” Вы легким движением вычеркиваете все кислородсодержащие соли (сульфаты, хлораты и перхлораты и многие другие).
7. Вы пишете: “В качестве примера металлической химической связи могут выступать любые металлы: натрий, железо, цинк и так далее.” Выражайтесь точнее. Металлы могут выступать в роли примера веществ, а пример металлической связи это уже то, что происходит между атомами в кристаллической решетке.
Для такой коротенькой статьи многовато мелких неточностей. Если трудно пересказать всего лишь школьный учебник, то хотя бы перепишите его один в один. Но тогда в чем ваша роль как популяризатора науки на сайте? В разделе математика у вас значительно выше процентное содержание интересных и более качественных статей. За что вы так невзлюбили химию?
Типы химических связей
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами. Причина образования химических связей ― выигрыш в энергии системы связанных атомов по сравнению с изолированными атомами.
- Типы химических связей
- Ковалентная связь
- Ковалентная неполярная связь
- Ковалентная полярная связь
- Ионная связь
- Металлическая связь
- Водородная связь
- Примеры решения задач по химии в ЕГЭ на типы химических связей
Типы химических связей
Выделяют 4 разновидности химической связи ― ковалентная, которая в свою очередь делится на полярную и неполярную, ионная, металлическая и водородная.
Полярность связи зависит от электроотрицательности элементов.
Ковалентная связь
Ковалентная неполярная связь
Образуется между одинаковыми неметаллами, то есть эти элементы имеют одинаковую ЭО.
Рассмотри образование ковалентной неполярной связи, на примере водорода:
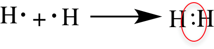
Ковалентная полярная связь
Образуется между разными неметаллами, то есть между этими элементами есть небольшая разница в ЭО.
Рассмотрим образование ковалентной полярной связи, на примере сероводорода:
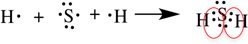
Ионная связь
Образуется между металлом и неметаллом, то есть между веществами большая разница ЭО. Один из элементов отдает свои электроны и он заряжается положительно. Элемент, который принимает электроны заряжается отрицательно.
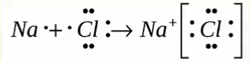
Металлическая связь
Металлическая связь ― обобществление валентных электронов «электронный газ» осуществляется в простых веществах металлах и их сплавах (Na, Fe, Сг, Al и т. д.).
Водородная связь
Водородная связь ― связь между электроотрицательным атомом (F, O, N) и атомом водорода, который ковалентно связан с другим электроотрицательным атомом (F, O, N).
Водородные связи влияют на физические (температуру кипения, температуру плавления) и химические (кислотно-основные) свойства соединений.
Межмолекулярные водородные связи обусловливают ассоциацию молекул, что приводит к повышению температур кипения и плавления вещества. Например, этиловый спирт C2H5OH, способный к ассоциации, кипит при +78,3°С, а диметиловый эфир СН3ОСН3, не образующий водородных связей, лишь при –24°С (молекулярная формула обоих веществ С2Н6О).
Примеры решения задач по химии в ЕГЭ на типы химических связей
Задача 1. Из предложенного перечня выберите два соединения, в которых присутствует ионная химическая связь.
Решение: Ионная химическая связь характерна для оксидов, гидроксидов и солей металлов (+соли аммония и гидроксид аммония). Соли —это вариант 1 и 3.
Задача 2. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная химическая связь.
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная связь характерна для простых веществ-неметаллов и соединений типа неметалл-неметалл. Это простое вещество хлор и сульфид углерода. Таким образом ответ будет 1 и 2.
Задача 3. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная полярная химическая связь.
- NH4OH
- He
- HCl
- P2O5
- PbO
Решение: Ковалентная полярная связь образуется между двумя разными неметаллами. Ответ 34.
Задача 4. Из предложенного перечня выберите два соединения, в которых присутствует водородная химическая связь.
Решение: Водородная химическая связь возникает между молекулами воды и одноатомных спиртов. Ответ 14.
Задача 5. Из предложенного перечня выберите два соединения, в которых ковалентная связь образована по донорно-акцепторному механизму.
- Карбид кальция
- Сульфат аммония
- Оксид фосфора (V)
- Криптон
- Угарный газ
Решение: Донорно-акцепторный механизм образования связи характерен для иона аммония и угарного газа в связи с наличием неподеленной электронной пары на азоте и углероде соответственно. Ответ: 25.
Задача 6. Из предложенного перечня выберите два соединения, в которых присутствует ковалентная неполярная химическая связь.
Запишите в поле ответа номера выбранных соединений.
Решение: ковалентная неполярная связь образуется между одинаковыми атомами. Это фтор и кислород.
Ответ 35.
Задача 7. Из предложенного перечня выберите два вещества, с каждым из которых сера образует ионные связи.
- Фтор
- Натрий
- Кислород
- Кальций
- Углерод
Запишите в поле ответа номера выбранных соединений.
Решение: Ионные связи образуются между металлом и неметаллом. Сера-неметалл, значит, нужно выбрать металлы. Это натрий и кальций.
Ответ: 24.
Задача 8. Из предложенного перечня выберите два вещества, в молекулах которых имеются как полярные, так и неполярные ковалентные связи.
Решение: В молекуле под номером 1 есть 4 связи C-Cl, все они полярные, но в задании нужно найти молекулу как с полярными, так и с неполярными связями.
В молекуле бензола (под номером 2) содержится 2 вида связей: C-C неполярная и C-H полярная.
В молекуле HNO3 хоть и 3 кислорода, но между собой они не связаны, поэтому наблюдается 2 вида только полярных связей H-N, N-O.
В молекуле N2O4 2 типа связей: N-N неполярная и N-O полярная.
В молекуле углекислого газа оба кислорода связаны только с углеродом, образуя только полярные связи.
Ответ 24.
Задача 9. Из предложенного перечня выберите два вещества, в которых присутствует металлическая связь.
- Na2O
- Cu(OH)2
- Fe
- B
- Zn
Решение: металлическая связь характерная для металлов и сплавов. Металлы здесь — железо и цинк. Ответ 35.
Задача 10. Из предложенного перечня выберите два вещества, с которыми соединения хлора имеют ковалентную полярную связь.
- Водород
- Калий
- Магний
- Натрий
- Фосфор
Запишите в поле ответа номера выбранных соединений.
Решение: Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому ковалентную полярную связь имеет соединение хлора с водородом и фосфором. С остальными — связь ионная.
Ответ: 15.
Задача 11. Из предложенного перечня выберите два соединения, в которых имеются только ионные связи.
Решение: Ковалентная не полярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. Поэтому только ионные связи присутствуют в KI и BaCl2.
Ответ: 12.
Задача 12. Из предложенного перечня выберите два соединения, между молекулами которых образуются водородные связи.
- Фтороводород
- Бутанол
- Хлорметан
- Диметиловый эфир
- Этилен
Решение: Межмолекулярная водородная связь образуется между атомом водорода, ковалентно связанным с атомом с высокой электроотрицательностью (F, O и N), одной молекулы и атомом элемента с высокой электроотрицательностью (F, O, N, Cl) другой молекулы.
Среди предложенных веществ водородная связь образуется между молекулами фторводорода и бутанола.
Ответ: 12.
Задача 13. Из предложенного перечня выберите два соединения, образованные как ковалентной, так и ионной связью.
Решение: В этиловом спирте связи ковалентные, в хлориде натрия — ионные, в бензоле — ковалентные. В нитрате аммония и сульфате кальция связи в ионе аммония и нитратном и сульфатном анионах ковалентные, а между ионом аммония и нитратным анионом, а также ионом кальция и сульфат анионом — ионная.
Ответ: 13
Задача 14. Из предложенного перечня выберите два соединения, где кислород образует ковалентную полярную связь.
- NO2
- O2
- CO
- CaO
- Al2O3
Решение: Ковалентная полярная связь осуществляется между разными неметаллами.
Ответ: 13
Задача 15. Из предложенного перечня выберите два типа химических связей, которые реализуются в сульфате калия.
- ковалентная неполярная
- ковалентная полярная
- ионная
- металлическая
- водородная
Решение: Ковалентная неполярная связь образуется в молекулах между атомами одного элемента-неметалла. Ковалентная полярная связь образуется в молекулах между атомами разных неметаллов, ионная — между атомами металлов и неметаллов. В сульфате калия между ионами калия и сульфат-ионами связь ионная, а между кислородом и серой в сульфат-ионе — ковалентная полярная.
Ответ: 23.
Химия
План урока:
Словно компоненты конструктора, атомы соединяются между собой. И как бы, Вы не старались, но с единичным блоком можно соединить, только один блок. Деталь на 4 ячейки, может удержать не больше четырёх. Этот принцип сохраняется и в химии. За количество свободных ячеек отвечает валентность атомов элементов.
Результатом взаимодействия атомов является получение веществ. Виды химической связи атомов зависят от природы составляющих элементов.
Металлы отличаются малым количеством электронов на внешнем уровне сравнительно с неметаллами более низким значением электроотрицательности. Теперь наша задача вспомнить, как происходит изменение ЭО в таблице Менделеева или воспользоваться таблицей «Относительная электроотрицательность». Чем активнее неметалл, тем она выше и это говорит о том, что этот элемент, при образовании связи, будет забирать электроны.
Веществ насчитывается миллионы. Это могут быть простые вещества: металлы железо Fe, золото Au, ртуть Hg; неметаллы сера S, фосфор Р, азот N2. Так и сложные вещества: H2S, Ca3(PO4)2, (C6H10O5)n, молекулы белков и т.д.Комбинация элементов, входящих в состав веществ, определяет какие типы связей будут существовать между ними.
Ковалентная связь
Неметаллы из числа всех элементов находятся в меньшинстве. Но имея некоторые особенности в строении и способности иметь переменную валентность, число соединений, построенных этими элементами внушительное.
Чтобы иметь представление, по которому атомы соединяются, начнём с молекулы водорода Н2.
Давайте дадим волю фантазии, представим то, что нельзя увидеть. Допустим, что мы взяли в руки две одинаковые детали, имеющие такой вид:
Существует одна только комбинация их соединения, и между ними будет одно общее звено. Переместимся с нашего воображения к молекулам. Представим, что перед нами, два атома водорода и наша задача их соединить в молекулу. Покрутите мысленно детали, чтобы они объединились, необходимо их поставить друг на друга, связав их в определённом месте. Точки рядом означают, сколько электронов, располагающихся на наружном слое.
Атомы водорода, как детали, соединились одной связью, поэтому валентность в данном случае каждого из них будет равна I. Но степень окисления будет равна 0, так как вещество образовано элементом с одинаковым значением электроотрицательности.
Рассмотрим, как образуется молекула самого распространённого газа на нашей планете – азота N2.
Азот, имеет 3 неспаренных электрона. Это как взять две детали вида и соединить их.
Таким образом, азот трёхвалентен, а степень
окисления по-прежнему остаётся равна 0. За счёт общей электронной пары азот завершает внешний слой 2s 2 2p 6 .
Ковалентная связь в молекуле, состоящей из одного типа атомов, а именно неметаллов, носит название неполярная.
Во время построения молекулы, количество электронов стремится к завершению. Рассмотрим как образуется молекула О2. Каждому атому не хватает 2 электронов и они эту недостачу компенсируют общей электронной парой.
Также обращаем внимание, что степень окисления 0, ибо атомы равноправные партнёры, и их валентность равна II.
Ковалентная химическая связь образованная разными неметаллами называется полярная.
Возьмём два неметаллических элемента Водород и Хлор. Укажем электронные формулы внешнего слоя.
Проанализировав значения, Э(Н) + Cl − .
Такой вид образования соединений происходит по обменному механизму. Это значит, чтобы получить завершённую конфигурацию более электроотрицательные принимают электроны, менее – отдают, но при этом существует общая электронная пара.
Неметаллы образуют не только бинарные соединения, а возможно в состав будет входить три и более элемента. К примеру, молекула угольной кислоты H2СO3 состоит с 3 элементов. Как они между собой соединяться. Электроотрицательность возрастает в ряду ЭО (Н) + 2С +4 О −2 3. Это означает, что кислород будет притягивать на себя электроны углерода и водорода. Схематически это можно записать в следующем виде.
Чтобы построить структурную формулу, в центре записываем углерод. У него неспаренных 4 электрона. Поскольку атомов кислорода в количестве 3, каждый из них может принять 2 электрона. То путём не хитрых вычислений, видим что 4 электрона придёт от С и по одному от каждого Н. проверяем наш расчёт, учитывая нейтральность молекулы, считаем положительные и отрицательные заряды.
Н2 + С +4 О3 −2 (+1 ∙ 2) + (+4 ∙ 1) + (-2 ∙ 3) = 0
Существует ещё один механизм ковалентной связи, под названием донорно-акцепторный.
Чтобы понять этот принцип, опишем образование молекулы, имеющей не совсем приятный резкий, удушающий запах, аммиак NH3.
Из 5 электронов, находящиеся в распоряжении атома N, связываются только 3. Валентность атома N приобретает значение III. При этом степень окисления N −3 (оттянув на себя 3 электрона от каждого атома Н, становится отрицательным), водород, наоборот совершив «благородный поступок», отдав электрон, приобретает положительный заряд Н + . Два электрона никак не задействованы, они выделены красным цветом. Они способны поселиться в свободной ячейке иона Н + . Это место займут электроны азота, которые обозначены красным цветом. Образуется катион аммония по донорно-акцепторному механизму.
Незадействованные до этого «красные» электроны N «заселяются» в пустой s-орбитали, принадлежащей катиону водорода. Ион аммония имеет 3 связи, которые происходят по обменному механизму, а также одну, по донорно-акцепторному. Именно поэтому NH3 легко взаимодействует с кислотами и водой.
Ионная связь
Ионная химическая связь является пограничной ковалентной полярной. Отличаются тем, что для веществ, в которых локализуется ковалентная связь, характерно существование совместной электронной пары, тогда как для ионной связи свойственна полная отдача электронов. Следствием отдачи является образование заряженных частиц – ионов.
Определить тип связи помогут вычисления. Если разность значений электроотрицательностей больше 1,7, то для вещества характерна ионная связь. Если значение меньше 1,7, то свойственная полярная связь. Рассмотрим два вещества NaCl и СаС2. Оба они образованы металлом (Na и Са) и неметаллом (Clи С). Однако в одном случае связь будет ионная, во втором – ковалентная полярная.
Постулат физики гласит, что противоположности притягиваются. Т.е. положительные ионы притягивают отрицательные и наоборот.
Допустим, что необходимо получить вещество с атомов калия и фтора. Каждый атом стремится заполучить конфигурацию благородного газа. Достигнуть этого возможно двумя способами отдав или приняв электроны, образуя при этом ионы с желаемой конфигурацией.
Атому калия гораздо проще отдать 1 электрон, чем забрать у фтора 7. Принимая 1 электрон, F имеет завершённый уровень.
Аналогично калий, который с лёгкостью отдал свой электрон, его катион принял электронную формулу аргона.
Кальций двухвалентный металл, то для взаимодействия необходимо два атома фтора, поскольку он способен принять только один электрон. Схема образования ионной связи имеет вид.
Данный вид связи локализуется во всех солях, между металлом и кислотным остатком. В выше приведённом примере для угольной кислоты, кислотным остатком будет СО3 2− , если вместо водорода поставить атомы натрия, то схема образования связи имеет вид.
Следует отметить, что ионная связь будет существовать между Naи О, а между С и О ковалентная полярная.
Металлическая связь
Металлы существуют в разных цветах: чёрные (железо), красные (медь), жёлтые (золото), серые (серебро), плавятся при разных температурах. Однако их всех объединяет наличие блеска, твёрдости, электропроводимости.
Металлическая связь имеет черты сходства с ковалентной неполярной. Металлы бедны электронами на внешнем уровне, поэтому при образовании связи, они не способны притягивать на себя их, для них свойственна отдача. Так как атомный радиус в металлах большой, это даёт возможность легко оторваться электронам, образовав катионы.
Электроны постоянно перемещаются от атома к иону и наоборот. Сами катионы можно сравнить с айсбергами, окружёнными отрицательными частицами.
Схема металлической связи
Водородная связь
Элементы-неметаллы II периода (N, O, F) обладают высоким значением электроотрицательности. Это влияет на способность образования водородной связи между поляризованным Н + одной молекулы и анионом N 3- , O -2 , F – . Водородная связь способна объединить две разные молекулы. К примеру, если взять две молекулы воды, то они соединяются между собой за счёт атомов Н и О.
Водородная химическая связь изображена …… пунктиром. Соединяясь между собою молекулы, играют и находят важную роль в живых организмах. С помощью водородной связи строится вторичная структура молекулы ДНК.
Типы кристаллических решёток
Чтобы получить вещество, а не просто набор молекул, необходимо частицы «запаковать» в своеобразный каркас – кристаллическую решётку.
Представьте перед собой геометрическую фигуру – куб, в вершинах будут находиться частицы, условно соединённые между собою.
Существует прямая зависимость между строением атома и типом кристаллической решётки.
Обратите внимание, что соединения с ковалентной неполярной связью образованные частицами-молекулами, которые запакованы в молекулярную кристаллическую решётку. Чаще всего это будут соединения по температурному режиму низкокипящие и летучие. Это известные вам вещества как кислород О2, хлор Cl2, бром Br2.
Ковалентная полярная химическая связь также характерна для молекулярных соединений. Сюда входят как органические: сахароза, спирты, метан так и неорганические соединения: кислоты, аммиак, оксиды неметаллов. Существование их бывает как в жидком (Н2О), твёрдом (сера) так и газообразном виде (СО2).
В узлах атомной кристаллической решётки находятся отдельные атомы, между которыми существует ковалентная неполярная связь. Атомная кристаллическая решётка свойственна алмазу. На данный момент это самое твёрдое вещество. Данный тип связи характерен для вещества, покрывающего значительную часть нашей планеты, это –SiO2 (песок) и карборунд SiC, имеющий похожие свойства с алмазом.
Ионная связь между атомами образует кристаллическую решётку, в узлах которой будут находиться катионы и анионы. Это строение объединяет между собой целый класс неорганических соединений солей, состоящих с катионов металлов и анионов кислотного остатка. Характерными особенностями этих веществ будут высокие температуры, при которых они плавятся и кипят.
Металлическая связь имеет металлическую кристаллическую решётку. В её строении можно провести параллель с ионной решёткой. В узлах будут размещаться атомы и ионы, а между ними электронный газ, состоящий из мигрирующих электронов от атома к электрону.
Обобщая данные сведения, можем сделать вывод, зная состав и строение, можем прогнозировать свойства и наоборот.




