Строение и свойства неметаллов
Положение неметаллических элементов в периодической системе химических элементов. Нахождение простых неметаллов в природе, их строение, общие химические и физические свойства. Кислородные и водородные соединения неметаллов, их свойства и характеристика.
| Рубрика | Химия |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 10.05.2015 |
| Размер файла | 20,5 K |
- посмотреть текст работы
- скачать работу можно здесь
- полная информация о работе
- весь список подобных работ

Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Содержание
1. Положение неметаллических элементов в периодической системе химических элементов. Нахождение в природе. Общие химический и физические свойства
2. Общие химические свойства неметаллов
3. Строение и свойства простых веществ – неметаллов
4. Кислородные и водородные соединения неметаллов. Краткая характеристика их свойств
Все многообразие окружающей нас природы состоит из сочетаний сравнительно небольшого числа химических элементов.
В различные исторические эпохи в понятие «элемент» вкладывался различный смысл. Древнегреческие философы в качестве «элементов» рассматривали четыре «стихии» – тепло, холод, сухость и влажность. Сочетаясь попарно, они образовывали четыре «начала» всех вещей – огонь, воздух, воду и землю. В средние века к этим началам добавились соль, сера и ртуть. В XVII веке Р. Бойль указал на то, что все элементы носят материальный характер и их число может быть достаточно велико.
В 1787 году французский химик А. Лавуазье создал «Таблицу простых тел». В нее вошли все известные к тому времени элементы. Под последними понимались простые тела, которые не удавалось разложить химическими методами на еще более простые. Впоследствии выяснилось, что в таблицу вошли и некоторые сложные вещества.
В настоящее время понятие «химический элемент» установлено точно.
Химический элемент – вил атомов с одинаковым положительным зарядом ядра. (Последний равен порядковому номеру элемента в таблице Менделеева.)
В настоящее время известно 107 элементов. Около 90 из них существуют в природе. Остальные получены искусственно с помощью ядерных реакций. 104-107 элементы были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми элементами.
Все элементы делятся на металлы и неметаллы. Из 107 элементов 85 относятся к металлам. К неметаллам относят следующие элементы: гелий, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кислород, сера, селен, теллур, азот, фосфор, мышьяк, углерод, кремний, бор, водород. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства.
1. Положение неметаллических элементов в периодической системе химических элементов. Нахождение в природе. Общие химический и физические свойства
Неметаллических элементов по сравнению к металлическими элементами относительно немного. Их размещение в периодической системе химических элементов Д.И. Менделеева отражено в таблице №1.
Размещение неметаллических элементов в периодической системе по группам
VIII (благородные газы)
Как видно из таблицы №1 неметаллические элементы в основном расположены в правой верхней части периодической системы. Так как в периодах слева направо у атомов элементов увеличивается заряды ядер и уменьшаются атомные радиусы, а в группах сверху вниз атомные радиусы также возрастают, то понятно, почему атому неметаллов сильнее, чем атомы металлов, притягивают наружные электроны. В связи с этим у неметаллов преобладают окислительные свойства. Особенно сильные окислительные свойства, т.е. способность присоединять электроны, проявляют неметаллы, находящиеся во 2-ом и 3-м периодах VI-VII групп. Самым сильным окислителем является фтор. В соответствии с численными значениями относительных электроотрицательностей окислительные способности неметаллов увеличивается в следующем порядке: Si, B, H, P, C, S, I, N, Cl, O, F. Следовательно, энергичнее всего взаимодействует с водородом и металлами фтор:
Менее энергично реагирует кислород:
Фтор – самый типичный неметалл, которому нехарактерны восстановительные свойства, т.е. способность отдавать электроны в химических реакциях.
Кислород же, судя по его соединениям с фтором, может проявлять и положительную степень окисления, т.е. являться восстановителем.
Все остальные неметаллы проявляют восстановительные свойства. Причем эти свойства постепенно возрастают от кислорода к кремнию: O, Cl, N, I, S, C, P, H, B, Si. Так, например, хлор непосредственно с кислородом не соединяется, но косвенным путем можно получить его оксиды (Cl2 O, ClO2 , Cl2O2 ), в которых хлор проявляет положительную степень окисления. Азот при высокой температуре непосредственно соединяется с кислородом и, следовательно, проявляет восстановительные свойства. Еще легче с кислородом реагирует сера: она проявляет и окислительные свойства.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это H2, F2, Cl2, Br2, I2 (элементы VII группы Периодической системы ), а также кислород O2 и азот N2. Из трехатомных молекул состоит газ озон (O3).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов – C, Si, S и т.д.
Такие простые вещества, как озон и кислород, имеющие одинаковый качественный состав (оба состоят из одного и того же элемента – кислорода), но различающиеся по числу атомов в молекуле, имеют различные свойства. Так, кислород запаха не имеет, в то время как озон обладает резким запахом, который мы ощущаем во время грозы. Свойства твердых неметаллов, графита и алмаза, имеющих также одинаковый качественный состав, но разное строение, резко отличаются (графит хрупкий, алмаз твердый). Таким образом, свойства вещества определяются не только его качественным составом, но и тем, сколько атомов содержится в молекуле вещества и как они связаны между собой.
Неметаллы в виде простых тел находятся в твердом или газообразном состоянии (исключая бром – жидкость). Они не имеют физических свойств, присущих металлам. Твердые неметаллы не обладают характерным для металлов блеском, они обычно хрупки, плохо проводят электрический ток и тепло (за исключением графита).
2. Общие химические свойства неметаллов
химический неметалл кислородный водородный
Оксиды неметаллов относят к кислотным оксидам, которым соответствуют кислоты. С водородом неметаллы образуют газообразные соединения (например HCl, H2S, NH3). Водные растворы некоторых из них (например, галогеноводородов) – сильные кислоты. С металлами типичные неметаллы дают соединения с ионной связью (например, NaCl). Неметаллы могут при определенных условиях между собой реагировать, образуя соединения с ковалентной полярной (H2O, HCl) и неполярной связями (CO2).
С водородом неметаллы образуют летучие соединения, как, например, фтороводород HF, сероводород H2S, аммиак NH3, метан CH4. При растворении в воде водородные соединения галогенов, серы, селена и теллура образуют кислоты той же формулы, что и сами водородные соединения:
HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
При растворении в воде аммиака образуются аммиачная вода, обычно обозначаемая формулой NH4OH и называемая гидроксидом аммония. Ее также обозначают формулой NH3 * H2O и называют гидратом аммиака.
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислотаH2SO4 сильнее сернистой H2SO3.
3. Строение и свойства простых веществ – неметаллов
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств. Наглядно это отражено в схеме №2.
С немолекулярным строением
С молекулярным строением
F2, O2, Cl2, Br2, N2, I2, S8
У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления.
У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. При обычных условиях это газы, жидкости или твердые вещества с низкими температурами плавления.
Кристаллический бор В (как и кристаллический кремний) обладает очень высокой температурой плавления (2075°С) и большой твердостью. Электрическая проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Бориды (соединения бора с некоторыми металлами, например с титаном: TiB, TiB2) необходимы при изготовлении деталей реактивных двигателей, лопаток газовых турбин.
Как видно из схемы №2, углерод С, кремний Si, бор В имеют сходное строение и обладают некоторыми общими свойствами. Как простые вещества они встречаются в двух видоизменениях – в кристаллическом и аморфном. Кристаллические видоизменения этих элементов очень твердые, с высокими температурами плавления. Кристаллический кремний обладает полупроводниковыми свойствами.
Все эти элементы образуют соединения с металлами – карбиды, силициды и бориды (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Некоторые из них обладают большей твердостью, например Fe3C,TiB. Карбид кальция используется для получения ацетилена.
Если сравнить расположение электронов по орбиталям ф атомах фтора, хлора и других галогенов, то можно судить и об их отличительных свойствах. У атома фтора свободных орбиталей нет. Поэтому атомы фтора могут проявить только валентность I и степень окисления – 1. В атомах других галогенов, например в атоме хлора, на том же энергетическом уровне имеются свободные d-орбитали. Благодаря этому распаривание электронов может произойти тремя разными путями.
В первом случае хлор может проявить степень окисления +3 и образовать хлористую кислоту HClO2, которой соответствуют соли – хлориты, например хлорит калия KClO2.
Во втором случае хлор может образовать соединения, в которых степень окисления хлора +5. К таким соединениям относятся хлороноватая кислота HClO3 и ее соли – хлораты, например хлорат калия КClO3 (бертолетова соль).
В третьем случае хлор проявляет степень окисления +7, например в хлорной кислоте HClO4 и в ее солях – перхлоратах, например в перхлорате калия КClO4.
4. Кислородные и водородные соединения неметаллов. Краткая характеристика их свойств
С кислородом неметаллы образуют кислотные оксиды. В одних оксидах они проявляют максимальную степень окисления, равную номеру группы (например, SO2, N2O5), а других – более низкую (например, SO2, N2O3). Кислотным оксидам соответствуют кислоты, причем из двух кислородных кислот одного неметалла сильнее та, в которой он проявляет более высокую степень окисления. Например, азотная кислота HNO3 сильнее азотистой HNO2, а серная кислота H2SO4 сильнее сернистой H2SO3.
Характеристики кислородных соединений неметалов:
Свойства высших оксидов (т.е. оксидов, в состав которых входит элемент данной группы с высшей степенью окисления) в периодах слева направо постепенно изменяются от основных к кислотным.
В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают. Об этом можно судить по свойствам кислот, соответствующих этим оксидам.
Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
В главных подгруппах периодической системы химических элементов в направлении сверху вниз кислотные свойства высших оксидов неметаллов уменьшаются.
Общие формулы водородных соединений по группам периодической системы химических элементов приведены в таблице №3.
Неметаллы – определение, особенности строения, свойства, получение
Вы, очевидно, помните, что самой первой научной классификацией химических элементов было деление их на металлы и неметаллы. Эта классификация не потеряла своей значимости и в настоящее время.
Неметаллы – это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
Это определение оставляет в стороне элементы VIII группы главной подгруппы — инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
Из определения неметаллов следует, что для их атомов характерны высокие значения электроотрнцательности. Оиа изменяется в пределах от 2 до 4. Неметаллы – это элементы главных подгрупп, преимущественно р элементы, исключение составляет водород – s-элемент.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор.
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах — соединениях с металлами, подобных соединениям металлов с галогенами — галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 — газ. Его молекула, подобно галогенам, двухатомна.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах (рис. 47).
Фтор – самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
Конфигурация внешнего электронного слоя

Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Химических элементов-неметаллов всего 161 Совсем немного, если учесть, что известно 114 элементов. Два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере всодержнтся 0,03% от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. Шесть неметаллов — С, Н, О, N, Р и S — биогенные элементы, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элемента ми-неметаллами (кислород О2, азот, углекислый газ СО2, водяные пары Н2О и др.).
Водород — главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88%. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 — атомы водорода.
Простые вещества-неметаллы. Строение. Физические свойства
В простых веществах атомы неметаллов связаны кова-лентнон неполярной связью. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Ки, Вг2), двойные (например, в молекулах серы тронные (например, в молекулах азота ковалентные связи.
Как вам уже известно, простые вещества-неметаллы могут иметь:
1. Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы или твердые вещества и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
2. Атомное строение. Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ко-валентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала. (На рисунке 47 подчеркнуты символы тех элементов-неметаллов, которые образуют только атомные кристаллические решетки.)
Многие элементы-неметаллы образуют несколько простых веществ — аллотропных модификаций. Как вы помните, это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул, и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен (рис. 48).
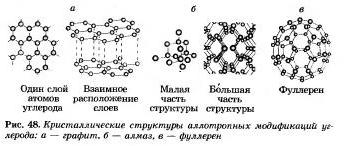
Элементы-неметаллы, обладающие свойством аллотропии, обозначены на рисунке 47 звездочкой. Так что простых веществ-неметаллов гораздо больше, чем химических элементов- неметаллов.
Вы знаете, что дли большинства металлов, за редким исключением (золото, медь и некоторые другие), характерна серебристо-белая окраска. А вот у простых веществ-неметаллов гамма цветов значительно разнообразнее.
Несмотря на большие различия в физических свойствах неметаллов, все-таки нужно отметить и некоторые их общие черты. Все газообразные вещества, жидкий бром, а также типичные ковалентные кристаллы – диэлектрики, так как все внешние электроны их атомов использованы для образования химических связей. Кристаллы непластичны, и любая дефор-мация вызывает разрушение ковалентных связей. Большинство неметаллов не имеют металлического блеска.
Химические свойства
Как мы уже отмечали, для атомов неметаллов, а следовательно, и для образованных ими простых веществ характерны как окислительные, так и восстановительные свойства.
Окислительные свойства простых веществ неметаллов
1. Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами (как вы знаете, металлы всегда восстановители):

Окислительные свойства хлора Сl2 выражены сильнее, чем у серы, поэтому и металл Ре, который имеет в соединениях устойчивые степени окислеиия +2 b +3. окисляется им до более высокой степени окисления.
2. Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения.
3. Любой неметалл выступает в роли окислителя в реакциях с теми неметаллами, которые имеют более низкое значение элек-троотрицател ьности:
Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства.
Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Фтор самый сильный окислитель из неметаллов, проявляет в реакциях только окислительные свойства.
4. Окислительные свойства неметаллы проявляют и в реакциях с некоторыми сложными веществами. Не только кислород, но и другие неметаллы также могут быть окислителями в реакциях со сложными веществами -неорганическими и органическими.
Сильный окислитель хлор Сl2 окисляет хлорид железа(II) в хлорид железа(III).
Вы помните, конечно, качественную реакцию на непредельные соединении — обесцвечивание бромной воды.
Восстановительные свойства простых веществ — неметаллов
При рассмотрении реакции неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности одни из них проявляет свойства окислителя, а другой — свойства восстановителя.
1. По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства.
2. Разумеется, неметаллы, кроме фтора, служит восстановителями при взаимодействии с кислородом:

8 Многие неметеллы могут выступать в роли восстановителя в реакциях со сложными веществами окислителями:
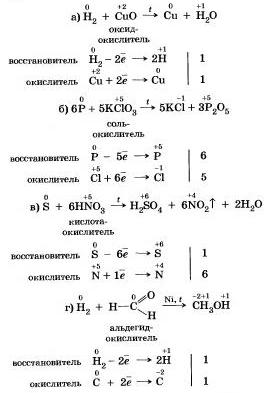
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, в восстановителем, это реакции самоокисления-самовосстановления.
Итак, подведем итоги! Большинство неметаллов могут выступал в химических реакциях как в роли окислителя, так и в роли восстановителя (восстановительные свойства не присущи одному только фтору).
Водородные соединения неметаллов
Общим свойством всех неметаллов является образование летучих водородных соединений, в большинстве которых неметалл имеет низшую степень окисления.
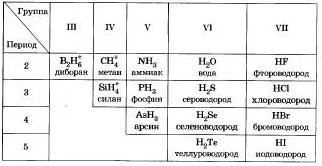
Известно, что наиболее просто эти соединения можно получить непосредственно взаимодействием неметаллв е водородом, то есть синтезом.
Вм водородные соединении неметаллов обдоэоьаны коналентны-ми полярными свялямн, имеют молекулярное строение и при обычных условиях является газами, кроме воды (жидкость). Лла водородных соединений неметаллов характерно рвалнчное отношение к воде. Метай и енлан в ней практмческя нерастворимы. Аммиак при расстворении в воде образует слябое основание — гидрат аммиака.
Кроме рассмотренных свойств, водородные соединения неметаллов в окислительно-восстановительных реакциях всегда проявляют свойства восстановителен, ведь в них неметалл имеет низшую степень окисления.
Оксиды неметаллов и соответствующие им гидроксиды
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные, жидкие (летучие), твердые (летучие).
Оксиды неметаллов делят на две группы: несолеобразующие и голеобразующие. При растворении кислотных оксидов в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, то есть высшее ее значение, называют высшими. При рассмотрении Периодического закона мы уже характеризовали их состав и свойства.
усиление кислотных свойств оксидов и шдронепдоп В пределах одной главной подгруппы, например, VI группы действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени оксиления неметалла.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут чроявлять только окислительные свойства.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
Практические задания
1. К каким электронным семействам откосят элементы-неметаллы?
2. Какие элементы-неметаллы являются биогенными?
3. Какие факторы определяют валентные возможности ато-ыов неметаллов? Рассмотрите их на примере атомов кислорода и серы.
4. Почему одни неметаллы при обычных условиях — газы, другие – твердые тугоплавкие вещества? 5. Приведите примеры простых веществ-неметаллов, существующих при обычных условиях в разном агрегатном состоянии: а) газообразном, б) жидком, в) твердом.
6. Составьте уравнения окислительно-восстановительных реакций с участием неметаллов. Какие свойство (окислительные или восстановительные) проявляют в этих реакциях неметаллы?
По какой причине очень сильно различаются температуры кипения воды и сероводорода, но близки между собой температуры кипения серо- и селеноводорода?
7. Почему метан устойчив на воздухе, а силен на воздухе самовозгорается: фтороводород устойчив к нагреванию, иодо-водород уже при слабом нагревании разлагается на иод и водород?
8. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
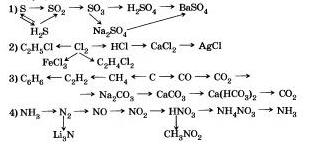
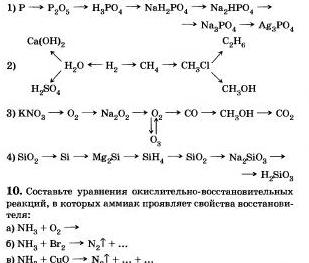
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие переходы:
12. Через раствор, содержащий 10 г едкого натра, пропустили 20 г сероводорода. Какая соль и в какой количестве получится?
Ответ: 0.25 моль NaHS.
14. При обработке 30 г известняка соляной кислотой получилось 11 г углекислого газа. Какова массовая доля карбоната кальция в природном известняке? Ответ: 83.3%. 15. Применяемая в медицине йодная настойкп является 51% ным раствором кристаллического иода в этиловом спирте. Какой объем спирта, плотность которого 0.8 г/мл. требуется для приготовления 250 г такого раствора?
Ответ: 297 мл. 16. Смесь кремния, графита и карбоната кальция .массой 34 г обработали раствором гидроксида натрия п получили 22.4 л газа (н. у.). При обработке такой порции смеси соляной кислотой получили 2.24 л газа (н. у.). Определите массовый состав смеси.
Ответ: 14 г 81: 10 г С; 10 г СаСО2.
17. Газообразный аммиак объемом 2.24 л (н. у.) поглощен 20 г раствора фосфорной кислоты с массовой долей 49%. Какая соль образовалась, какова ее масса?
Ответ: 11,5г
19. Какой объем аммиака требуется для получения 6,3 т азотной кислоты, считая потери в производстве равными 5%?
Ответ: 2352 м3.
20. Из природного газа объемом 300 л (н. у.) с объемной долей метана в газе 96% получили ацетилен. Определите его объем, если выход продукта 65%.
Ответ: 93.6 л.
21. Определите структурную формулу углеводорода с плотностью паров по воздуху 1,862 и массовой долей углерода 88,9%. Известно, что углеводород взаимодействует с аммиачным раствором оксида серебра.
Роль неметаллов в жизни человека
Неметаллы в жизни человека играют огромную роль, так как без них невозможна жизнь не только человека, но и других живых организмов. Ведь благодаря таким неметаллическим элементам, как кислород, углерод, водород и азот, образуются аминокислоты, из которых затем образуются белки, без чего не может существовать все живое на Земле.
Давайте внимательно рассмотрим картинку внизу, на которой представлены основные неметаллы:

А теперь давайте рассмотрим некоторые неметаллы более подробно и узнаем их значение, которое они играют в жизни человека и в его организме.
Полноценная жизнь человека зависит от воздуха, которым он дышит, а в воздухе содержатся неметаллы и соединения между ними. Обеспечением важнейших функций нашего организма, занимается кислород, а азот и другие газообразные вещества его разбавляют, и тем самым защищают наши дыхательные пути. Ведь, с курса биологий вам уже известно, что все защитные функции организма тесно связаны с наличием кислорода.
От проникновения губительного УФ излучения, на защиту нашего организма становиться озон.
Такой необходимый микроэлемент, как сера, в организме человека выступает в роли минерала красоты, так как благодаря ней, кожа, ногти и волосы, будут оставаться здоровыми. Также, не стоит забывать, что сера принимает участие в формировании хрящевой и костных тканей, помогает улучшить работу суставов, укрепляет нашу мышечную ткань и выполняет еще много других функций, которые очень важны для здоровья человека.
Анионы хлора также играют важную биологическую роль для человека, так как принимают участие в активизации некоторых ферментов. С их помощью поддерживается благоприятная среда в желудке и поддерживается осмотическое давление. Хлор, как правило, попадает в организм человека, благодаря поваренной соли при приеме пищи.
Помимо важных качеств, которые неметаллы оказывают на человеческий организм, и другие живые организмы, эти вещества применяют и в других различных отраслях.
Применение неметаллов
Такая разновидность неметаллов, как водород, широко применяется в химической промышленности. Его используют для синтеза аммиака, метанола, хлороводорода, а также для гидрогенизации жиров. Также, не обойтись без участия водорода, в качестве восстановителя и при производстве многих металлов и их соединений.
Широко применяется водород и в медицине. При обработке ран и для остановки мелких кровотечений используют трех процентный раствор перекиси водорода.
Для производства соляной кислоты, каучука, винилхлорида, пластмасс, а также и многих органических веществ, применяют хлор. Его используют в таких промышленностях, как текстильная и бумажная, в качестве отбеливающего средства. На бытовом уровне, хлор незаменим для обеззараживания питьевой воды, так как, обладая окислительными свойствами, он имеет сильное дезинфицирующее действие. Такими же свойствами обладают и хлорная вода, и известь.
В медицинских целях, как правило, в качестве физраствора, используется хлорид натрия. На его основе производят многие водорастворимые лекарства.
Такой неметалл, как сера, используют для производства серной кислоты, пороха, спичек. Также он применяется при вулканизации каучука. Ее применяют в производстве красителей и люминофоров. А коллоидная сера необходима в медицине.
Сера нашла применение и в сельском хозяйстве. Ее используют, как фунгицид, для борьбы с различными вредителями.
В синтезе полимерных материалов, а также для изготовления различных медицинских препаратов, широкое применение получили и такие неметаллы, как йод и бром.
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение
 Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16 О, 17 О и 18 О (преобладает 16 О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км 3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.

Строение молекулы озона
3О2 = 2О3 – 285 кДж
Озон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.
При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2
2. В лаборатории кислород получают:
1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:
2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
3. Разложением пероксида водорода:
2H2O2 = H2O + O2↑ (катализатор MnO2)
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
 Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s 2 2p 4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
 Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.
С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
 Кислород легко реагирует с щелочными и щелочноземельными металлами:
Кислород легко реагирует с щелочными и щелочноземельными металлами:
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 o C или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2H2S + O2 → 2S + 2H2O (недостаток кислорода),
4NH3 + 5O2 → 4NO + 6H2O (в присутствии катализатора Pt ),
Известны соединения, содержащие катион диоксигенила O2 + , например, O2 + [PtF6] — (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).

Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I — в растворе Kl:
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.
Кислород ℹ формула, строение элемента, химические и физические свойства, способы получения и применения, с какими соединениями реагирует
Ключевые слова конспекта: химические свойства простых веществ-неметаллов, характеристика элемента? простое вещество — кислород O2, получение кислорода.
Характеристика элемента кислорода
Кислород О – элемент № 8, 2-й период, VIA группа. Электронная конфигурация атома кислорода 1s 2 2s 2 2p 4 .
Валентные возможности кислорода – II и III (с учётом возможности образования связи по донорно–акцепторному механизму, например в ионе гидроксония Н3О + ). Возможные степени окисления кислорода:
+2 – в соединении со фтором OF2;
+1 – в соединении со фтором О2F2;
– в простых веществах O2 (кислород), O3 (озон);
–1 – в пероксидах (Н2O2, Na2O2);
–2 – во всех остальных соединениях кислорода (кроме супероксидов).
Кислород – самый распространённый элемент в земной коре. Кислороду присуща аллотропия, элемент кислород образует два простых вещества – киcлород O2 и озон O3.
Кислород – простое вещество O2
Кислород является молекулярным веществом, молекула двухатомна. В молекуле кислорода связь ковалентная неполярная.
При обычных условиях кислoрoд – газ без цвета и запаха, тяжелее воздуха, плохо растворим в воде (несколько лучше, чем азот). В жидком состоянии кислород светло-голубого, в твёрдом – синего цвета.
Кислород является хорошим окислителем. Реагирует практически со всеми простыми веществами (кроме инертных газов, галогенов, благородных металлов). Так, например, киcлород окисляет металлы:
O2 + 2Zn = 2ZnO
3O2 + 4Al = 2Al2O3
O2 + 2Cu = 2CuO
2O2 + 3Fe = Fe3O4
Кислорoд является также окислителем многих неметаллов. В некоторых случаях, для того чтобы началась реакция, требуется нагревание:
Кислoрод реагирует с азотом в электрической дуге (реакция обратима, идёт с небольшим выходом NO):

В кислороде сгорают многие горючие вещества, практически все органические вещества:
Кислoрoд окисляет многие сложные вещества – как неорганические, так и органические:
В промышленности кислород получают перегонкой воздуха. Способ основан на том, что у азота и кислорода разные температуры кипения. В лаборатории киcлорoд получают:
а) электролизом воды:
б) разложением пероксида водорода под действием катализатора:
в) разложением перманганата калия при нагревании:
г) разложением хлората калия (бертолетовой соли) при нагревании:
д) разложением нитратов щелочных металлов при нагревании:


Вся информация о кислороде в одной таблице

Конспект урока «Кислород: химические свойства».
Кислород
Кислород (лат. Oxygenium) – элемент VIa группы 2 периода периодической таблицы Д.И. Менделеева. Первым открывает группу халькогенов – элементов VIa группы.
Газ без цвета, без запаха, составляет 21% воздуха.

Общая характеристика элементов VIa группы
Общее название элементов VIa группы O, S, Se, Te, Po – халькогены. Халькогены (греч. χαλκος – руда + γενος – рождающий) – входят в состав многих минералов. Например, кислород составляет 50% массы земной коры.
От O к Po (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Среди элементов VIa группы O, S, Se – неметаллы. Te, Po – металлы.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns 2 np 4 :
- O – 2s 2 2p 4
- S – 3s 2 3p 4
- Se – 4s 2 4p 4
- Te – 5s 2 5p 4
- Po – 6s 2 6p 4
Основное состояние атома кислорода
У атома кислорода (как и атомы азота, фтора, неона) нет возбужденного состояния, так как отсутствует свободная орбиталь с более высоким энергетическим уровнем, куда могли бы перемещаться валентные электроны.
Атом кислорода имеется два неспаренных электрона, максимальная валентность II.

Природные соединения
- Воздух – в составе воздуха кислород занимает 21% (это число пригодится в задачах!)
- В форме различных минералов в земной коре кислорода содержится около 50%
- В живых организмов кислород входит в состав органических веществ: белков, жиров, углеводов и нуклеиновых кислот
Получение
В промышленности кислород получают из сжиженного воздуха. Также активно применяются кислородные установки, мембрана которых устроена как фильтр, отсеивающие кислород (мембранная технология).
В лаборатории кислород получают разложением перманганата калия (марганцовки) или бертолетовой соли при нагревании. Применяется реакция каталитического разложения пероксида водорода.
На подводных лодках для получения кислорода применяют следующую реакцию:

Химические свойства
Является самым активным неметаллом после фтора, образует бинарные соединения со всеми элементами кроме гелия, неона, аргона. Чаще всего реакции с кислородом экзотермичны (горение), ускоряются при повышении температуры.
-
Реакции с неметаллами
Во всех реакциях, кроме взаимодействия со фтором, кислород проявляет себя в качестве окислителя.
2C + O2 = (t) 2CO (неполное окисление – угарный газ, соотношение 2:1)
C + O2 = (t) CO2 (полное окисление – углекислый газ, соотношение 1:1)
F + O2 → OF2 (фторид кислорода, O +2 )

В реакциях кислорода с металлами образуются оксиды, пероксиды и супероксиды. Реакции с активными металлами идут без нагревания.
Известна реакция горения воды во фторе.

Все органические вещества сгорают с образованием углекислого газа и воды.

При применении катализаторов и особых реагентов в органической химии достигают контролируемого окисления: алканы окисляются до спиртов, спирты – до альдегидов, альдегиды – до кислот.
Процесс можно остановить на любой стадии в зависимости от желаемого результата.

© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Кислород – химические и физические свойства, получение, распространение
Содержание:
Кислород распространён в природе в виде изотопов 16О, 17О, 18О, которые имеют следующее процентное содержание на Земле – 99,76%, 0,048%, 0,192% соответственно. В свободном состоянии кислород находится в виде трёх алло-тропных модификаций: атомарного кислорода – Оо , дикислорода – О2 и озона – О3.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Кислород – распространение кислорода в природе и получение
Кислород – элемент (О), кислород – простое вещество ( ), воздух
), воздух
В виде простого вещества кислород входит в состав воздуха, что впервые установил в 1770 г. шведский химик К. Шееле. Объемное содержание кислорода в воздухе 21%. Эта
величина (округлена до 20%) часто используется при решении задач. В земной коре в составе химических соединений содержится около 49% кислорода. Это видно из формул
следующих природных соединений:  – вода,
– вода,  – песок,
– песок,  – глина,
– глина,  – мрамор и т. д. Кислород входит также в состав важнейших органических соединений живых организмов: белков, липидов, углеводов и др.
– мрамор и т. д. Кислород входит также в состав важнейших органических соединений живых организмов: белков, липидов, углеводов и др.

В Периодической таблице Д. И. Менделеева кислород находится на 8-м месте, химический знак – O (oxygenium). Относительная атомная масса – 16. Кислород в соединениях проявляет валентность II.
Строение атома кислорода: 
В воздухе содержится, кроме кислорода, азот – 78%; примерно 1% составляют инертные газы (гелий, неон, аргон и др.), что было установлено учеными в конце ХIX века. Это постоянные компоненты воздуха. Есть и переменные компоненты – загрязняющие газы, состав которых зависит от местных условий (≈ 1%). К ним относятся углекислый газ и водяные пары. Таким образом, воздух является смесью газов.

Массовая доля кислорода в воздухе – 23%. Запас кислорода в воздухе  т, из них
т, из них  т расходуется на горение.
т расходуется на горение.
Количество кислорода в воздухе все время уменьшается под влиянием различных техногенных факторов, которые зависят от хозяйственной ориентации каждого конкретного региона. В то же время содержание кислорода в воздухе пополняется за счет процесса фотосинтеза, который идет непрерывно, поэтому состав воздуха остается примерно постоянным (рис. 28).

Экологическая обстановка в нашей республике, в первую очередь в промышленных городах, ухудшается из года в год (Усть-Каменогорск, Павлодар, Тараз, Шымкент, Караганда, Текели и т. д.). Усиливает этот процесс и увеличение количества автомобилей.

До некоторого предела переменные компоненты воздуха не влияют на окружающую среду. Это количество называется предельно допустимой концентрацией (ПДК). Если содержание вредных примесей превышает ПДК, появляется опасность отравления и т. п. Организм человека чувствует снижение концентрации кислорода более чем на 1%.
Ученые всего мира упорно работают над созданием новейших экологически чистых технологий, ведь воздух определяет саму возможность жизни на Земле.
Вам уже знакомы реакции окисления – процессы взаимодействия простых и сложных веществ с кислородом.
Как химический элемент кислород образует два простых вещества:  – кислород и
– кислород и  – озон.
– озон.
Из курса биологии вы уже знаете, что в процессе фотосинтеза растения поглощают углекислый газ и выделяют кислород, которым мы дышим. Растения являются «легкими» планеты. Поэтому не случайно в народе говорят: «Каждый должен вырастить хотя бы одно дерево». В последние годы в Казахстане по программе «Жасыл ел» ежегодно высаживают несколько сотен тысяч саженцев. Например, Астана окружена несколькими «зелеными
поясами». Их площадь достигла 78 тыс. гектаров. Эти меры способствуют улучшению состава воздуха.
Физические свойства
Кислород  – бесцветный газ, без вкуса и запаха, температура кипения – 183°С, плотность 1,43 г/л, тяжелее воздуха. Мало растворим в воде: в 1 л воды при нормальных условиях растворяется 0,04 г кислорода (табл. 9).
– бесцветный газ, без вкуса и запаха, температура кипения – 183°С, плотность 1,43 г/л, тяжелее воздуха. Мало растворим в воде: в 1 л воды при нормальных условиях растворяется 0,04 г кислорода (табл. 9).

Получение кислорода
Промышленный способ получения кислорода заключается в сжижении воздуха при низких температурах и его перегонке. Вначале из жидкого воздуха отгоняют газообразный азот (его температура кипения ниже, чем у кислорода). В жидком состоянии остается почти чистый кислород. Его хранят в баллонах голубого цвета, так как жидкий кислород имеет светло-голубой цвет (рис. 29).
Лабораторные способы получения кислорода основаны на реакциях разложения некоторых богатых кислородом веществ.
1. Разложение перманганата калия.
В сухую пробирку насыпаем немного вещества и, закрыв пробирку пробкой с газоотводной трубкой, осторожно нагреваем. При этом протекает химическая реакция:

2. Каталитическое разложение пероксида водорода (рис. 30).


Тлеющей лучинкой проверяем наполненность пробирки кислородом. Если ее поднести к отверстию трубки, она вспыхнет.
3. Каталитическое разложение хлората калия.
Для ускорения этой реакции добавляем к хлорату немного оксида марганца (IV) и нагреваем. Вещества, ускоряющие реакцию и при этом не расходующиеся, называются катализаторами.



Выделившийся кислород можно собрать двумя способами:
1) вытеснением воздуха, так как кислород тяжелее (рис. 31, а):
2) вытеснением воды, т. к. он плохо растворяется в воде (рис. 31, б).

В 1774 г. английский ученый Д. Пристли получил кислород разложением оксида ртути (II):


Для хранения газов в лабораториях используют газометр (рис. 32). Газометр состоит из сосуда и большой воронки, конец которой немного не доходит до дна сосуда.
Воронка, снабженная краном, вставляется в сосуд на шлифе, обеспечивающем герметичность прибора. Перед наполнением газометра газом воздух из него вытесняют водой. Для этого
открывают краны 1 и 2. Через воронку 3 вливают воду и доверху заполняют ею газометр. Затем закрывают оба крана, вынимают пробку из тубуса 4 и вводят в газометр конец газоотводной трубки от прибора для получения газа. Газ поступает в газометр, вытесняя из него воду, которая выливается в стеклянную ванну или раковину. После наполнения
газометра газом закрывают нижнее отверстие 4 пробкой и наливают воду в воронку 3. Для выпуска газа из газометра открывают кран 1 и слегка – кран 2. При этом вода из воронки поступает в сосуд и вытесняет из него газ, который выходит через газоотводную трубку и может быть направлен в сосуд-приемник.
В газометре можно хранить газы, малорастворимые в воде и не взаимодействующие с ней. Взрывоопасные газы нельзя хранить в газометре.

Демонстрация №4
Разложение пероксида водорода
Опыт проводит учитель, учащиеся наблюдают, делают выводы.
Цель: Уметь получать кислород и собирать двумя способами.

1. Закрепите вертикально в зажиме штатива термостойкую пробирку.
2. В пробирку наберите немного раствора пероксида водорода и всыпьте в пробирку заранее приготовленного порошка диоксида марганца.
3. Опустите в пробирку тлеющую лучинку. Затем пробирку закройте пробкой с газоотводной трубкой. Опыт можно провести в термостойком стакане (рис. 33).

Химические свойства кислорода
Химические свойства. При нагревании кислород взаимодействует со
многими веществами.
Этот процесс называется горением и сопровождается выделением тепла
и света.
Взаимодействие с простыми веществами
Если бросить кусочек тлеющего
угля в пробирку с кислородом, то он раскаляется и сгорает (рис. 34, а).

В кислороде также горят сера, фосфор и другие неметаллы (рис. 34, б, в).

Фосфор горит очень интенсивно (рис. 35). За считанные секунды колба
наполняется белым дымом, на стенках колбы оседает оксид фосфора (V).


Некоторые металлы также взаимодействуют с кислородом с образованием оксидов. Держа щипцами зажженную ленту магния, поместим ее в сосуд с кислородом. Магний горит светящимся пламенем. (Нельзя долго смотреть на горящий магний, это вредно для глаз.)

Раскаленный уголек поместим на кончике железной проволоки, прикрепленной к лучинке, и опустим в пробирку с кислородом. При этом загорятся и лучинка, и уголь, и даже железо (рис. 36):

Горение железа сопровождается треском и «фейерверком» искр – расплавленных капель железной окалины.
При взаимодействии простых веществ – металлов и неметаллов – с кислородом образуются оксиды.
Оксидами называются сложные вещества, состоящие из атомов двух элементов, один из которых кислород. Химические реакции между кислородом и другими веществами называются реакциями окисления.
Названия оксидов образуются с помощью слова «оксид» и соответствующего названия элемента с указанием в скобках переменной валентности. Например,  – оксид серы (IV),
– оксид серы (IV),  – оксид серы (VI). По международной номенклатуре в названии оксида греческими числительными указывается количество атомов элементов. Например, CO – монооксид углерода,
– оксид серы (VI). По международной номенклатуре в названии оксида греческими числительными указывается количество атомов элементов. Например, CO – монооксид углерода,  – диоксид углерода,
– диоксид углерода,  – диоксид марганца,
– диоксид марганца,  – гептаоксид димарганца.
– гептаоксид димарганца.
Взаимодействие со сложными веществами
Некоторые сложные вещества также взаимодействуют с кислородом с образованием оксидов. Например, при горении пропана, который входит в состав природного газа, протекает следующая реакция:

При автогенной сварке и резке металлов горит ацетилен:

В металлургии в обжиговых печах протекают реакции окисления обогащенных руд:

Реакции взаимодействия простых и сложных веществ с кислородом называются реакциями окисления.

- 1. Кислород – самый распространенный в природе элемент. Он встречается в виде двух аллотропных модификаций: кислород (О.,) и озон (О3).
- 2. С участием кислорода идут процессы медленного окисления, горения, гниения, брожения.
- 3. Явление образования нескольких простых веществ одним элементом называется аллотропией.
- 4. Кислород вступает в реакцию с металлами, неметаллами и сложными веществами.
Услуги по химии:
Лекции по химии:
Лекции по неорганической химии:
Лекции по органической химии:
Присылайте задания в любое время дня и ночи в 
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Кислород, строение молекулы, способы получения, физические и химические свойства. Озон, его получение, свойства и применение.



Кислоро́д — элемент 16-й группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород .
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:

Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):

На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:

Физические свойства.
Немного тяжелее воздуха. Слабо растворяется в воде и спирте. Хорошо растворяется в расплавленном серебре. Является парамагнетиком. Жидкий кислород (температура кипения −182,98 °C) — это бледно-голубая жидкость. Твёрдый кислород (температура плавления −218,35 °C) — синие кристаллы.
Химические свойства.
Сильный окислитель, взаимодействует со всеми элементами, кроме гелия, неона, аргона и фтора, образуя оксиды. Степень окисления −2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры.


Кислород реагирует непосредственно со всеми простыми веществами, кроме Au и инертных газов, реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Кислород образует пероксиды со степенью окисления атома кислорода, формально равной −1.
Озо́н — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
Получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Применяют: сильного окисляющего реагента, для стерилизации изделий медицинского назначения, отбеливания бумаги, очистки масел, очистки воды и воздуха.








