Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.

2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
К катионам относятся: ион водорода Н + , ион аммония NH4 + , ионы металлов Na + , K + , Fe 2+ , Al 3+ , катионы основных солей CuOH + , Аl(ОН)2 + , FeOH 2+ и т. д.
К анионам относятся: гидроксид-ион ОН — , ионы кислотных остатков Сl — , NO3 — , SO4 2- , Cr2O7 2- , анионы кислых солей НСО3 — , Н2РО4 — , HPO4 2- и т. д.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:

Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
При растворении в воде ионных соединений, например хлорида натрия NaCl, дипольные молекулы воды ориентируются вокруг ионов натрия и хлорид-ионов. При этом положительные полюсы молекул воды притягиваются к хлорид-ионам Сl — , отрицательные полюсы — к положительным ионам Na + .
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.

II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.

Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:

Для простоты в химических уравнениях ионы изображают без молекул воды: Н + , Ag + , Mg 2 + , F — , SO4 2- и т. д.
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Ионы имеют различную окраску. Гидратированные и негидратированные ионы s- и р-элементов обычно бесцветны. Так, бесцветны ионы Н + , Na + , K + , Ва 2 + , Аl 3+ и др. Ионы некоторых d-элементов имеют окраску. Окраска гидратированных и негидратированных ионов одного и того же d-элемента может быть различной. Например, негидратированные ионы Cu 2+ — бесцветные, а гидратированные ионы меди Cu 2+ • 4Н2О — синего цвета
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:

где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:

где [А m + ], [B n — ] — равновесные концентрации ионов А m + и B n — , [АnВm] — равновесная концентрация недиссоциированных молекул АnВm.
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:

Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.

Значение электролитов для живых организмов
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na + , калия K + , кальция Са 2+ , магния Mg 2+ , водорода Н + , анионы ОН — , Сl — , SO4 2- , НСО3 — имеют большое значение для физиологических и биохимических процессов. Концентрации различных ионов в организме человека различны. Концентрации ионов водорода Н+ и гидроксид-ионов ОН — очень малы, но они играют большую роль в жизненных процессах. Ионы водорода Н + способствуют нормальному функционированию ферментов, обмену веществ, перевариванию пищи и т.д. Концентрации ионов натрия Na + и хлорид-ионов Cl — в организме человека весьма значительны. Эти ионы человек получает ежедневно, используя в пищу поваренную соль NaCl. В медицине применяется 0,85%-ный раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом.
Электролитическая диссоциация (ЭД) электролитов в водных растворах. Сильные и слабые электролиты
Содержание:
Понятие об электролитах и неэлектролитах
Ещё в начале XIX в. М. Фарадей обнаружил, что одни растворы веществ пропускают электрический ток, другие – нет.
Если в металлах электрический ток возникает за счёт направленного движения электронов, то в растворах, а также в расплавах электрический заряд переносится ионами.
Соединениям, которые распадаются в растворах на ионы и проводят электрический ток, химики дали название электролиты.
Физики же их называют проводниками 2-го рода.
Растворённые вещества, неспособные пропускать электричество, называются неэлектролитами. В растворах они существуют в виде электронейтральных молекул. Большинство органических соединений – неэлектролиты.
Процессы диссоциации и ассоциации в электролитах по теории Аррениуса, степень диссоциации
Распад электролита на ионы называется электролитической диссоциацией (ЭД) или ионизацией.
В 1887 г. шведским химиком С.Аррениусом были сформулированы основные принципы этого явления:
- Под действием воды (растворителя) происходит разложение электролита на ионы.
- Электроток заставляет ионы с плюсовым зарядом (катионы) двигаться к катоду (–), ионы с минусовым зарядом (анионы) – к плюсовому электроду (аноду).
- Одновременно с диссоциацией происходит встречный процесс – ассоциация ионов в молекулы.
- Полноту разложения электролита на заряженные частицы, по-другому сказать, силу электролита определяет степень диссоциации (обозначается α). Она равна отношению количества продиссоциировавших молекул электролита (Nд) к общему их количеству в растворе (N), т.е. по формуле: α = (Nд/ N)·100%
На эту характеристику влияют:
- природа электролитов и участвующих в ЭД растворителей – с увеличением полярности связей в их молекулах α растет;
- температура – α находится в прямой пропорции от неё;
- концентрация – в более разбавленных растворах α выше.
Эти основные положения теории электролитической диссоциации (ТЭД) в 1891 г. были дополнены русским химиком И. Каблуковым понятием сольватации (гидратации) катионов и анионов. Он, используя теорию Д.Менделеева о растворах, доказал, что между растворителем и растворяемым веществом формируются химические связи.
Механизм ЭД
Когда химические соединения растворяются в воде молекулы H2O , будучи биполярными, начинают ориентироваться вокруг ионов растворяемого вещества: полюс (+) молекулы воды притягивается к отрицательному иону соединения и наоборот.
Межмолекулярные связи этого реагента ослабевают, оно разрушается, ионы перемещаются в раствор. Там ионы связываются с молекулами H2O и становятся гидратированными. Это наглядно видно на примере ионизации NaCl.
Классификация и некоторые особенности диссоциации электролитных растворов
С учетом степени ЭД электролиты классифицируют по 3 группам (см. Таблицу 1):
- сильные
- средней силы
- слабые
Классификация электролитов
Сильные электролиты
Средние электролиты
Слабые электролиты
Значение степени диссоциации (α)
α + и анион кислотного остатка.
а) Для многоосновных кислот отрыв иона H + происходит ступенчато, причём самая высокая степень ионизации достигается на первой стадии
б) Именно из-за присутствия ионов H + кислоты обладают кислым вкусом и происходит соответствующие окрашивание индикаторов.
Основания в ходе ЭД образуют анионы гидроксида (OH – ) и катион металла.
Аналогично кислотам многокислотные основания отщепляют гидроксид-ионы ступенчато:
Zn(OH)2 = ZnOH + + OH –
ZnOH + ⇆ Zn 2+ + OH –
Соли в ходе диссоциации распадаются на кислотные остатки (анионы) и катионы металлов.
При этом возможны несколько вариантов этого процесса:
-
С образованием нормальных (средних) солей. Происходит полное замещение всех атомов водорода в кислоте на атомы металла.
С образованием кислых солей. За счёт ступенчатой диссоциации в составе соли находится ещё несколько или один атом водорода.
С образованием основных солей. В этом случае они распадаются, образуя катионы металла, анионы кислотного остатка и гидроксид-ионы.
Mg(OH)Cl ⇆ Mg(OH) + + Cl –
Mg(OH) + ⇆ Mg 2+ + OH –
Диссоциация также может вести к образованию двойных и смешанных солей.
Константа электролитической диссоциации
Наиболее общей характеристикой электролитов (прежде всего слабых) является константа диссоциации Кд.
В слабых электролитах из-за неполной их ионизации возникает равновесие между нераспавшимися молекулами и ионами. Одновременно идут процессы диссоциации и ассоциации (молекуляризации). Кд по сравнению со степенью диссоциации (α) более объективно характеризует способность электролита к ионизации.
С увеличением Кд растёт количество ионов, а значит сильнее становится электролит. Для слабых электролитов при данной температуре константа диссоциации постоянная величина, для сильных – переменная, зависимая от концентрации раствора.
Кд и α связаны формулой: Кд = (α 2 ·c) / (1 – α), где c – молярная концентрация раствора.
Реакции ионного обмена
Согласно ТЭД взаимодействия в электролитных растворах есть реакции между ионами и получили название реакций ионного обмена (РИО). А уравнения, которые их описывают, – ионные уравнения.
РИО между сильными электролитами необратимы. Их продукты выходят из реакции или в виде нерастворимого осадка, или газообразными, или малодиссоциирующими электролитами. Такое условие необратимости ионообменных реакций сформулировано в 1803 г. французским химиком Бертолле.
Реакции в электролитах письменно оформляются в 3 видах: сначала в молекулярной форме, затем в полной ионной и сокращенной ионной.
| Молекулярная форма уравнения | K2CO3 + H2SO4 = K2SO4 + CO2↑ + H2O |
| Полное ионное уравнение | 2K + + CO3 2- + 2H + + SO4 2- = 2K + + SO4 2- + CO2↑ + H2O |
| Сокращённое ионное уравнение | CO3 2- + 2H + = CO2↑ + H2O |
Значение электролитов
Без них невозможно существование живых организмов, в том числе человека. Все биохимические и физиологические процессы проходят при их непосредственном участии: транспортировка кислорода в крови, регулирование водно-солевого баланса, работа кишечника и сердца.
В технике электролиты участвуют в таких процессах как электролиз, электрокатализ, защита металлов от коррозии. В энергетике создаются новые топливные элементы, солнечные батареи, электрохимические преобразователи информации.
Хлорид аммония (нашатырь, Е510): описание, реакции, применение
Хлорид аммония – это неорганическое азотсодержащее вещество, имеющее минеральную природу. Нашатырь, как часто называют хлорид аммония, обладает высокой химической активностью, поэтому используется во многих сферах. В пищевой промышленности хлористому аммонию присвоен статус пищевой добавки Е510, но применение ограничено в связи с неприятным вкусом и запахом. Может вноситься в почву в качестве удобрения, содержащего азот и хлор. Также его применяют в медицине, металлургии и фотографии. Вещество обладает отхаркивающими, мочегонными свойствами, назначается для откашливания мокроты при заболеваниях дыхательных путей, а также в качестве натурального диуретика.

Что такое хлорид аммония, формула
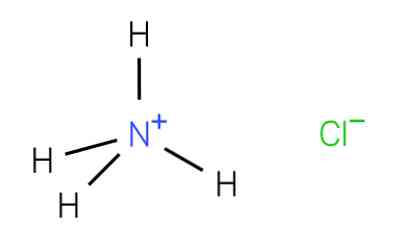
Хлорид аммония – это собой среднюю хлористую соль аммония с химической формулой NH4Cl. В нормальных условиях хлористый аммоний имеет вид белого или желтоватого крупнодисперсного порошка, состоящего из кристаллов прямоугольной формы. Гигроскопичность слабая, не имеет запаха.
Вещество переходит из твёрдого состояния в газообразное при температуре 337,6 °С, в жидком состоянии кипит при очень высокой температуре (520°С). Хорошо растворим в органических растворителях, особенно в спиртах: в метаноле больше, чем в этаноле. Растворяется в воде и жидком аммиаке, при повышении температурного режима растворимость медленно возрастает, наибольшая наблюдается при 100°С.
Насыщенные водные растворы нашатыря имеют меньшую точку кипения (116 °С), проявляют слабокислую реакцию в результате сольволиза водой, поскольку происходит отделение большого количество протонов водорода (H + ).
В природе хлорид аммония встречается в виде минерала нашатыря, имеющего сходную химическую формулу, но с примесями железа (Fe), йода (I) и брома (Br). Обладает жёсткой кубической кристаллической решеткой. Кристалл белого, желтоватого, сероватого или коричневатого цвета, со стеклянным блеском, обладает низкой хрупкостью, режущийся, минимальной твёрдости по шкале Мооса. При раскалывании нашатырь образует раковистый излом.
Минерал формируется в естественных условиях в результате вулканической активности или в районе горячих источников. Имеет вид налётов, корочек, редко образуя массивные скопления. Чаще всего его находят в залежах разложившегося помёта верблюдов, летучих мышей, морских птиц. Нашатырь имеет неприятный резкий горько-солёный вкус, достаточно токсичен, запах едкий, отрезвляющий, в прошлом использовался как компонент нюхательной соли: водным раствором минерала пропитывали углеаммонивые соли.

Молекула хлорида аммония
Реакции с хлоридом аммония
Хлористый аммоний проявляет сходные с другими солями аммония химические свойства. При взаимодействии с водой начинается реакция гидролиза – разложение вещества с образованием воды и ионов. При этом разрушается остаток основания (NH4OH), т.е. сольволиз протекает по катиону:
При нагревании образуется аммиак и соляная кислота:
Химическое разложение происходит под воздействием концентрированной серной кислоты:
а также при взаимодействии с щелочами щелочно-земельных металлов:
При этом обязательно выделяется хлороводородная кислота или аммиак.
Хлорид аммония реагирует с металлами с выделением нитрида водорода:
Взаимодействие с оксидами протекает тяжело, требует подогревания или участия катализаторов. Так, при температуре около 300°С идёт реакция с окисью меди:
При этом образуется молекулярный азот и выпадает чистая медь.
При слабом подогревании (60-70°С) или пропускании электрического тока нашатырь взаимодействует с хлором, образуя маслянистую летучую жидкость – трёххлористый азот:
Активно идут реакции с различными нитратами, например, с нитратом серебра:
Формирующийся осадок хлорида серебра белого цвета темнеет на свету.
Хлорид аммония реагирует и с нитритами: нитритом натрия, калия и других металлов:
История использования
Хлорид аммония – это вещество, которое было известно со времен до нашей эры. Впервые его использовали в Египте, получая путём возгонки (перехода из твёрдого состояния в газ). Печи топились верблюжьим навозом, в котором в изобилии был аммиак. В результате образовывалась сажа, из которой добывалось вещество. Нередко минерал находили в пустынях, в местах оазисов, где скапливался кал и моча ездовых животных. Резко пахнущие кристаллы использовали в мистических практиках жрецы бога Амона. Вдыхая едкий запах, люди ощущали рефлекторную стимуляцию дыхательного центра, онемение. Эти эффекты связывались с религиозным общением. Хлориду аммония дали название «нушадир», что в переводе с арабского означает «аммиак».
Спустя столетия, в период Средних веков, алхимики экспериментировали с хлористой солью аммония. Смешивая аммиак с летучий хлористоводородной кислотой, они видели образование густого белого дыма. Активную реакцию нейтрализации аммиака (основания) кислотой (HCl) они объясняли также с точки зрения мистики: считалось, что газы представляют собой богов, в результате сражения которых появляется дым и белый налёт на предметах.
По мере развития науки химики стали использовать кристаллы нашатыря в медицинских целях. Из него готовили водный раствор, в котором смачивали платки или марли для приведения в чувства людей, упавших в обморок. Порошок применялся в качества нюхательной соли при головных болях, в стрессовых ситуациях, при заболеваниях верхних и нижних дыхательных путей, для успокоения при истерических припадках. Безводный хлорид аммония не имеет запаха, однако со временем постепенно разлагается, выделяя аммиак, который и даёт местно-раздражающий эффект.
Сначала нашатырь импортировался в страны Европы и в Россию из Индии и Египта, затем учёные стали синтезировать его самостоятельно. Повсеместное активное применение вещества началось в 1710-1800 годах. В 1710 году в России был построен первый завод по производству хлористого аммония.
Получение и производство
В лабораторных условиях хлорид аммония получают взаимодействием аммиака с хлором:
Первые производственные методы получения хлористого аммония были основаны на нейтрализации водного раствора аммиаком соляной кислоты.
Сегодня большое количество Е510 производится как побочный продукт при выпуске пищевой соды. Общее уравнение реакции:
Производство проходит в несколько этапов:
- получают насыщенный раствор гидрокарбоната натрия (NaHCO3);
- отделяют бикарбанат;
- оставшийся маточный раствор упаривают для большей концентрации соединений;
- в раствор дополнительно добавляют хлориды, затем пропускают углекислый газ.
Так поступают заводы, специализирующиеся на производстве двууглекислого натрия. Для них наиболее экономически выгодно совмещать выпуск двух продуктов, поскольку в наличии изначально есть все необходимые реактивы.
Иногда получение хлорида аммония может быть не связано с пищевой содой. Для этого используют самую первую технологию – взаимодействие раствора аммиака и хлористоводородной кислоты. При этом производство идёт с участием крупного и дорогостоящего оборудования.
Исходный метод был усовершенствован, т.к. имел некоторые недостатки: выпаривание водного раствора для выделения нужного соединения происходило с затратами тепла, сопровождалось сильной коррозией выпарных устройств, в результате производитель нёс убытки. Поэтому было решено заменить водный раствор аммиака насыщенным растворов – таким, в котором концентрация вещества наибольшая, а содержание воды – наименьшее. Последовательность стадий производства:
- Чистый реагент синтетического хлористого водорода помещают в аппарат для поглощения газов. Туда же добавляют раствор хлористого аммония в жидкой форме. При температуре 70°С происходит реакция поглощения раствором газа.
- Насыщенный раствор, нагретый до 110°С, поступает в реактор.
- В реактор подаётся газообразный аммиак, который нейтрализует хлорид водорода.
- Образуется суспензия хлористого аммония, которая отстаивается.
- Расслоившийся раствор направляют в центрифугу, где хлорид аммония отделяется в виде кристаллов.
Выход вещества при таком способе довольно большой. Однако производитель сталкивается с токсичными и опасными реактивами, во время синтеза есть вероятность образования взрывоопасного трихлорида азота (Cl3N). Поэтому чаще всего вещество, поступающее в продажу, производится вместе с пищевой содой.

Воздействие на организм
При правильном применении хлорид аммония не оказывает негативного воздействия на организм. Нужно строго следовать рекомендациям лечащего врача, если вещество было назначено в качестве мочегонного, отхаркивающего средства.
Вред для организма, противопоказания, побочные эффекты
Частое или интенсивное вдыхание паров нашатыря может привести к ожогу слизистой, головным болям. Злоупотребление пищевыми продуктами, в состав которых входит Е510, может привести к отравлению, тошноте и болям в животе, аллергии.
Главное противопоказание к применению хлористого аммония – индивидуальная непереносимость. Она может выражаться в отёках, развитии тяжёлых аллергических реакций. Вещество противопоказано следующим группам лиц:
- беременным или кормящим женщинам;
- детям до 18 лет;
- людям с почечной недостаточностью и другими заболеваниями почек;
- при печёночной недостаточности, гепатитах.
Среди побочных эффектов после использования нашатыря головокружение, головная боль, тошнота, временная потеря или притупление вкусовой чувствительности, обоняния, а также сыпи, кашель.
Полезные свойства
Хлористый аммоний обладает выраженной фармакологической активностью. Воздействуя через рецепторы носа на дыхательный центр, он производит мощный раздражающий эффект. При этом активизируются базовые защитные рефлексы: кашель и чихание. Средство улучшает отхождение мокроты из нижних дыхательных путей при бронхите, пневмонии, способствует сужению сосудов полости носа (избавляет от насморка).
Хлорид аммония проявляет мочегонные свойства. При этом его принимают перорально в виде слабого раствора, который быстро всасывается в желудочно-кишечном тракте. Он вызывает отток жидкостей из тканей в кровь, а затем усиливает выделение и формирование мочи в почках, ускоряет процесс перехода первичной мочи во вторичную, вывод её из организма. Благодаря диуретикоподобному действию хлористый аммоний способствует устранению отёков и нормализации водно-щелочного баланса.
Допустимые нормы потребления хлорида аммония
Предельно допустимая доза хлористого аммония в сутки составляет 12 г в сутки для взрослых людей и 2,5 г в день для детей. Вещество разрешено к применению во многих странах мира, в том числе в США, Канаде, России.
Применение хлорида аммония
Хлорид аммония используется во многих сферах. Сегодня его значение в некоторых областях несколько уменьшилось (сельское хозяйство, пищевая промышленность), поскольку его заменили более совершенные вещества.
Применение хлорида аммония в пищевой промышленности
Пищевая добавка Е510 действует как эмульгатор. Добавка позволяет смешивать исходно трудно растворимые друг в друге соединения, стабилизирует и улучшает их структуру. При производстве хлебобулочной продукции хлористый аммоний добавляется как улучшитель муки. Пищевую добавку Е510 можно встретить в составе и других продуктов:
- кондитерские изделия;
- лакричные конфеты;
- плодово-ягодные вина;
- макароны;
- дрожжи;
- хлебобулочные изделия.
Применение хлористого аммония в пищевой промышленности ограничивается, поскольку иногда он даёт неприятный вкус и запах. Ему предпочитают безвкусные стабилизаторы. Однако в лакричной карамели аммиачный привкус пищевой добавки Е510 ценится.
Применение хлорида аммония в медицине
Хлорид аммония выпускается в виде желатиновых капсул, а также дозированного порошка для приготовления растворов. Препараты на основе этого вещества назначаются при следующих патологических состояниях:
- Острый бронхит.
- Пневмония неясного генеза.
- Обильная трудноотходящая мокрота.
- Застойная сердечная недостаточность, сопровождающаяся отёками.
- Болезнь Меньера.
- Синдром предменструального напряжения.
- Повышение водородного показателя крови (алкалоз).
Благодаря мягкому мочегонному действию хлористый аммоний может назначаться как индивидуально, так и в составе комплексной терапии для усиления других диуретиков. Важно не превышать предельно допустимую дозировку и обязательно консультироваться о возможности приёма средства с врачом.
Применение хлорида аммония в сельском хозяйстве
Иногда хлористый аммоний может использоваться в качестве прикорневого удобрения сельскохозяйственных культур. Для этого необходим порошок, содержащий не менее 25% азота. Внесение в почву данного вещества улучшает рост и развитие растений, плодоношение, повышает их продуктивность. В качестве подкормки используют водный раствор.
Недостаток удобрения в том, что более 65% в составе занимает хлор. Этот элемент токсичен для многих видов растений. Поэтому хлорид аммония чаще всего используют для подкормки малочувствительных к хлору культур:
- сахарная свёкла;
- кукуруза;
- рис;
- подсолнухи.
При применении данного удобрения нужно стараться вносить его при перекопке грунта осенью, тогда есть вероятность, что большинство хлора вымоется осадками. В связи с этими трудностями в использовании, хлористый аммоний чаще всего заменяют более безопасными для сельскохозяйственных растений азотными удобрениями.
Применение хлорида аммония в других сферах
При перепайке различных устройств хлорид аммония удаляет оксиды с поверхности металлов, что улучшает эффективность спаивания.
За счёт высокой способности к сольволизу водой нашатырь используется как источник электрического тока в гальванических элементах. Также может быть источником обильного дымообразования, что необходимо в пиротехнических составах.
В лабораториях хлористый аммоний используется для исследования состава крови. Соединение приводит к гемолизу эритроцитов, в результате чего их оболочка разрывается, и гемоглобин выходит наружу, становится доступным для изучения.
Хлорид аммоний раньше применялся в фотографии как компонент фиксирующей жидкости.
Где купить и сколько стоит хлорид аммония
Хлористый аммоний продаётся оптом заводами-производителями. Цена варьирует от 25 до 28 рублей за 1 кг. Удобрение на основе этого вещества продаётся в магазинах, ориентированных на товары для сада и огорода. Стоимость пакета, содержащего 500 грамм порошка, около 95-100 рублей. Хлорид аммония продаётся в аптеках, стоимость порошкообразного препарата от 95 до 200 рублей.
Заключение
Хлорид аммония – это неорганическое вещество, насыщенное азотом и хлором, которое издревле применяется в медицинских целях. Оно обладает мочегонным и отхаркивающим действием. Вещество используют как пищевую добавку Е510 для эмульгирования и стабилизации состава ряда продуктов. Хлористым аммонием можно удобрять почву, улучшая азотное питание растений. Он высоко химически активен, образует устойчивые водные растворы, способные проводить электричество, которые применяются также в промышленности, фотографии, пиротехнике.
Хлорид аммония (NH4Cl) формула, свойства, риски и использование
хлорид аммония, также известная как аммиачная соль, является неорганической солью в моче, формула которой NH4Кл. Встречается в минералогических образованиях и в таком виде называется аммиачной солью. Он также был найден в некоторых вулканических жерлах и пепла.
Это может быть получено различными методами. Первый заключается в нейтрализации с помощью HCl аммиачного остатка, образующегося при перегонке угля: NH3 + HCl → NH4Cl.
Вторая стратегия заключается в процессе Сольве для получения карбоната натрия (или бикарбоната) и где хлорид аммония образуется в качестве побочного продукта:
В процессе Solvay бикарбонат натрия выделяют фильтрацией, а затем кристаллизуется хлорид аммония, который остается в растворе (формула хлорида аммония, S.F.).
Ежегодно в Японии производится более 230 000 тонн хлорида аммония, где он в основном используется для удобрения при выращивании риса..
Однако соль без запаха имеет множество других применений, которые включают использование в производстве средств для личной гигиены, пиротехники, в качестве компонента в металлургической промышленности, в медицине, в качестве ароматизатора в пищевой промышленности и в качестве электролита в цинковых батареях. -карбон (Химическая Компания, 2016).
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 3.1 1- Медицина
- 3.2 2- Удобрения
- 3.3 3- Металлургия
- 3.4 4- Аккумуляторный компонент
- 3,5 5- Обед
- 3.6 6- Другое использование
- 4 Ссылки
Физико-химические свойства
Хлорид аммония – это гигроскопичные мелкодисперсные белые частицы без запаха (Национальный центр биотехнологической информации, 2017).

Соединение имеет триклинную сетчатую структуру с кубической структурой с центром в центре. Его молекулярная масса составляет 53 490 г / моль, его плотность составляет 1,5274 г / мл, а температуры плавления и кипения составляют 338 ° С и 520 ° С..
Хлорид аммония растворим в воде, способен растворять 383,0 г соединения на литр растворителя. Он также растворим в этаноле, метаноле и глицерине и мало растворим в ацетоне. Он нерастворим в органических растворителях, таких как этилацетат (Royal Society of Chemistry, 2015).
Хлорид аммония может подвергаться различным реакциям, имеющим большое значение для химической и фармацевтической промышленности. Может разлагаться при нагревании в соляной кислоте и аммиаке:
Кроме того, он может реагировать с основаниями, такими как гидроксид натрия или калия, с образованием газообразного аммиака:
Другая важная реакция, в которой используется хлористый аммиак, – это разложение карбонатов и бикарбонатов с образованием соли и аммиака:
Хлорид аммония считается кислой солью. Полученные растворы содержат умеренные концентрации ионов гидрония и имеют рН менее 7,0. Реагируют как кислоты, чтобы нейтрализовать основания.
Как правило, они не реагируют как окислители или восстановители, но такое поведение не является невозможным. Многие из этих соединений катализируют органические реакции (хлорид аммония, 2016 г.).
Реактивность и опасности
Хлорид аммония чрезвычайно ядовит и токсичен. Он вызывает повреждение органов при проглатывании или длительном воздействии, а также вреден для глаз. Он не воспламеняется и не реагирует с другими химическими веществами (Национальный институт безопасности и гигиены труда, 2014).
В случае попадания в глаза, следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело.
Поместите жертву под безопасный душ. Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, оно осторожно моет загрязненную кожу проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание является серьезным, пострадавшего следует как можно скорее эвакуировать в безопасное место. Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук.
Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста. Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста.
Во всех случаях вам следует немедленно обратиться к врачу (паспорт безопасности материала Хлорид аммония, 2013).
приложений
1- Медицина
Хлорид аммония выполняет очень важную биохимическую функцию: он поддерживает физиологический уровень pH.
Как кислотная соль, она может помочь исправить ситуации, в которых концентрация хлорид-ионов в плазме низкая или в случаях алкалоза крови (высокий уровень pH крови). Это может произойти после рвоты, всасывания (удаления) содержимого желудка, использования диуретиков (таблеток с водой или жидкостью) или при некоторых заболеваниях желудка..
Хлорид аммония также вызывает выведение излишков солей и воды через мочеиспускание и вызывает ацидоз в моче (делает его более кислым).
Хлорид аммония также используется для уменьшения отека или увеличения веса, которое происходит до менструации, и в качестве помощи при лечении инфекций мочевыводящих путей (Университет Юты, 2017).
Это компонент многих лекарств от простуды и кашля из-за его эффективности в качестве отхаркивающего средства. В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец (Encyclopædia Britannica, 2016).
2- Удобрения
Хлорид аммония в основном используется в качестве источника азота в удобрениях (что соответствует 90% мирового производства соединения), таких как хлораммонийфосфат, в основном для выращивания риса и пшеницы в Азии..
3- Металлургия
Хлорид аммония используется в качестве флюса при изготовлении металлов, которые должны быть покрыты оловом, оцинкованы или сварены. Он работает как флюс, очищая поверхность заготовок, реагируя с оксидами металлов на поверхности, образуя летучий хлорид металла..
Для этого он продается в блоках в хозяйственных магазинах для использования при чистке наконечника паяльника и может быть включен в припой в виде флюса..
4- компонент батареи
Хлорид аммония, NH4Cl, является компонентом сухих батарей, энергетических резервуаров, которые питают электрические устройства. Батареи позволяют вам использовать электричество, когда вы не находитесь рядом с электрической розеткой или розеткой.
Для каждой батареи есть три основных компонента: катод (верхняя часть вашей обычной батарейки АА, из которой текут электроны), анод (нижняя часть батареи АА, в которую текут электроны) и электролит для через которые могут двигаться электроны и ионы.
Когда хлорид аммония используется в качестве электролита в батарее, он превращается в водную пасту и помещается между катодом и анодом.
Химические реакции между катодами батареи и анодами заставляют электроны протекать через пасту из хлорида аммония от катода к аноду.
Электроны проходят через металлические контакты в батарейном отсеке, заставляя электрическое оборудование работать (American Chemistry Council, Inc., 2005).
5- Еда
В некоторых странах хлорид аммония, под названием соль аммиака или разговорно сальмиакки, используется в качестве пищевой добавки под номером E E510, обычно в качестве дрожжевого питательного вещества при производстве хлеба.
Это пищевая добавка для крупного рогатого скота и ингредиент в питательной среде для дрожжей и многих микроорганизмов.
Хлорид аммония используется для придания вкуса темным конфетам, называемым соленой солодкой (очень популярным в скандинавских странах), для выпечки, чтобы дать бисквитам очень хрустящую текстуру, а в ликере Salmiakki Koskenkorva для ароматизации..
В Индии и Пакистане его называют «ношадер» и используют для улучшения свежести бутербродов, таких как самоса и джалеби.
6- Другое использование
Хлорид аммония можно найти в шампунях, красках и отбеливателях для волос, средствах для мытья и очищения тела, моющих средствах для лица, кондиционере, моющем средстве для мытья посуды, а также в маслах и солях для ванн..
Хлорид аммония также используется в травлении при изготовлении печатных плат, таких как огнетушитель. Он также является компонентом фейерверков, взрывчатых веществ и спичек, а также отвердителем в клеях на основе формальдегида..
Химические свойства хлористого аммония – формула, получение и применение
Аммония хлорид начали использовать еще с древности. В античной Греции вещество применялось для храмовых обрядов и лечения людей. Непонятное название химического соединения скрывает знакомый всем препарат, ведь что такое нашатырь, знает каждый: без него не обходится ни одна домашняя аптечка.
Что такое хлорид аммония
Первенство в получении вещества принадлежит древним египтянам и грекам. Название происходит от египетского слова «Аммоний». Так называли божество, в храме которого вдыхали испарения «нушадира» – раствора, сделанного из порошка с пещерных стен. С годами слово стало звучать как «нашатырь». Ammonium chloride, или хлорид аммония – это соль аммония. Выглядит как сухой кристаллический порошок без запаха, слегка солоноватый, белого цвета.
Хлорид аммония – формула
Структурная формула хлорида аммония – NH4Cl, по строению вещество представляет собой химическое соединение аммония с хлором. Лабораторный метод получения реагента выглядит как процесс упаривания маточного раствора хлорной извести. Второй способ – реакция взаимодействия между хлором и аммиаком. Народные умельцы придумали, как получить вещество из солевых батареек путем очищения и выпаривания.

Хлористый аммоний – свойства
Вскоре после открытия порошка ученые выделили свойства хлорида аммония:
- гигроскопичность, или способность собирать воду;
- растворение в воде, жидком аммиаке, метиловом и этиловом спирте с небольшим осадком;
- способность реагировать на щелочи;
- летучесть при возгорании: образуется белый плотный дым и пары аммиака;
- полное разложение под действием электрического разряда и температуре больше 338 градусов Цельсия.
Для получения нашатырного спирта сухой реактив смешивается с водой. В отличие от исходного соединения у него другая формула и свойства. Водный раствор обладает резким запахом. Чрезмерное вдыхание приводит к передозировке и летальному исходу. Врачи советуют хранить нашатырь отдельно от других лекарств. Пользоваться веществом нужно с особой осторожностью, ограничивая вдыхание несколькими секундами. Признаки передозировки хлористым аммонием и его производными:
- тошнота;
- учащенное дыхание;
- потеря аппетита;
- рвота.
Аммоний хлористый – применение
Полезные свойства аммиака способствовали тому, что он нашел широкое распространение во многих отраслях. Применение хлорида аммония нередко в таких сферах, как:
- металлургия – травление металлов;
- деревообработка – защита древесины от вредителей;
- медицина – производство лекарств;
- пищепром – приправа;
- химическая промышленность – реагент для опытов;
- радиотехника – удаление оксидной пленки в процессе пайке;
- машиностроение – устранение загрязнений с поверхности;
- пиротехника – дымообразователь;
- гальваника – электролиты;
- сельскохозяйственные работы – азотное удобрение;
- фотодело – фиксаж для снимков.
В медицине и фармакологии аммиак и его растворы используются чаще. Раствор хлорида аммония применяется в фармацевтике:
- При обмороке нашатырь оказывает возбуждающее действие на человека, приводит в сознание.
- При отеках ценится действие диуретиков или мочегонных веществ, выводящих лишнюю жидкость.
- При пневмонии, хроническом бронхите и бронхиальной астме помогает от сильного кашля.
На втором месте находится пищевая промышленность. Добавка с маркировкой Е510 указана в перечне многих продуктов, использующихся в изготовлении: хлебобулочных, макаронных, кондитерских изделий, фруктовых вин. В Финляндии и других европейских странах принято добавлять вещество для усиления вкуса. Популярные лакричные конфеты Salmiakki и Tyrkisk Peber тоже сделаны с применением хлористого аммония.
В последнее время ученые провели ряд опытов, которые подтвердили, что пищевая добавка Е510 после термообработки теряет свои полезные свойства и становится вредна для здоровья. Многие производители продуктов питания предпочли полностью отказаться от ее использования, заменив на более безвредные аналогичные компоненты. Однако в других сферах соль аммония остается незаменимой.
- Как мариновать грибы: рецепты с фото
- Черная смородина протертая с сахаром на зиму
- Ежики в мультиварке – рецепты с фото. Как приготовить ежики из мясного фарша с рисом и соусом в мультиварке
Хлористый аммоний в виноделии
Для изготовления вина на заводах и дома используют порошкообразный препарат. Хлористый аммоний в виноделии служит подкормкой для дрожжевой среды. Добавлять его нужно не чаще одного раза за месяц. Для этого препарат покупают в аптеке, сначала растворяют в жидкости, а затем вносят по 0,3 г на каждый литр сусла. Мастера-виноделы советуют использовать пипетку или шприц, чтобы случайно не переборщить с количеством раствора.

Хлористый аммоний в быту
Использовать хлористый аммоний в быту научились еще наши бабушки. Он хорошо справляется с сильными загрязнениями на одежде, посуде, бытовой технике, украшениях. Овощи на грядках станут плодоносить лучше, если добавить к воде для полива несколько кристаллов соли аммония. Техническая форма вещества для этих целей продается в ветеринарной аптеке или магазине для садоводов. Хранить его нужно в герметичной емкости подальше от детей, соединение имеет третий класс опасности.
Хлористый аммоний — применяется со времен древнего мира
Хлористый аммоний (хлорид аммония, нашатырь) — неорганическое соединение,  широко использующееся в самых разных областях. С химической точки зрения — соль аммония; формула NH4Cl.
широко использующееся в самых разных областях. С химической точки зрения — соль аммония; формула NH4Cl.
Хлорид аммония был известен уже в Древней Греции и Древнем Египте. Одно из его названий, «нашатырь» происходит от египетского «нушадир» — вещества, которое жрецы собирали на стенках пещер, чтобы вдыхать его пары перед церемонией и настраиваться на общение с божественными силами. «Аммоний» ведет историю названия от имени египетского бога Солнца Амона. В Древней Греции вещество добывали из сажи, которая образовывалась на стенках дымоходов в результате горения верблюжьего навоза, служившего грекам топливом (хлористый аммоний получается при разложении выделений животных и человека).
Хлорид аммония встречается в природе в вулканических пещерах и около трещин в земной коре, в виде налета или корочек.
Свойства
NH4Cl — белый кристаллический порошок (реактив технической чистоты может быть желтоватым или розовым), слегка гигроскопичный, без запаха, солоноватый на вкус. Хорошо растворяется в воде и жидком аммиаке, с ростом температуры водорастворимость увеличивается. Вступает в реакцию со щелочами с образованием соли, воды и аммиака. В гораздо меньшей степени реактив растворяется в этиловом и метиловом спиртах. Горит с выделением густого белого дыма. Полностью разлагается при температуре свыше 338 °С, а также под действием электрического тока. Горящий хлорид аммония выделяет аммиак, который раздражает органы дыхания.
Водный раствор реактива — это нашатырный спирт, жидкость с резким запахом, который возбуждающе действует на нервную систему. Реактив используется как лекарство, но лечение нашатырным спиртом должно проводиться строго по рекомендации врача, так как передозировка может привести к остановке дыхания и коме (в качестве антидота вводят щелочные растворы, например, натрия гидрокарбонат). К тому же это лекарство имеет противопоказания.
 В промышленности хлористый аммоний получают как побочный продукт при производстве соды. В лаборатории соединение можно синтезировать из хлора и аммиака, или пропусканием аммиака с хлорводородом через раствор поваренной соли.
В промышленности хлористый аммоний получают как побочный продукт при производстве соды. В лаборатории соединение можно синтезировать из хлора и аммиака, или пропусканием аммиака с хлорводородом через раствор поваренной соли.
Хлористый аммоний относится к веществам умеренно опасным (класс 3), работать с ним следует в средствах защиты: резиновых перчатках, защитных очках и респираторе, в помещении с приточно-вытяжной вентиляцией. Нужно следить, чтобы реактив не попал на кожу и слизистые оболочки. Хранить хим. реактив нужно в герметично закрытых многослойных мешках, в крытых помещениях без доступа влаги. Соединение опасно для окружающей среды.
Применение
— В цветной металлургии для травления металлов.
— Как составная часть электролитов в гальванике.
— Для удаления оксидной пленки при пайке и лужении стали, для производства сухих батарей в электротехнике.
— В текстильной индустрии — для отверждения клеев и лаков.
— Для получения нашатырного спирта, которым приводят в чувство при потере сознания. Также хлорид аммония является компонентом сердечных противоотечных средств, средств против кашля. Его используют для усиления некоторых мочегонных лекарств.
— В пищепроме это пищевая добавка E510, разрешенная в России и европейских странах. Его применяют для улучшения свойств муки, как загуститель и эмульгатор, для изготовления плодовых и ягодных вин, лакричных конфет, как приправу к рыбе. В последнее время добавка Е 510 применяется все реже из-за подозрений в ее вреде.
— При изготовлении сигнальных дымовых шашек, как дымообразователь.
— В сельском хозяйстве, при выращивании некоторых культур в качестве азотного удобрения на нейтральных и щелочных почвах.
— В аналитической химии и биологии в качестве фиксанала.
— Как составная часть быстрого фиксажа при проявке фотографий.
— При изготовлении фитилей для свечей.
— В быту в разведенном виде — для очистки различных поверхностей и украшений, при стирке.
В магазине «ПраймКемикалсГрупп» вы можете купить аммоний хлористый BASF в порошке, а также ампулы с фиксаналом «Аммоний хлористый». На эти и другие реактивы у нас доступные цены, имеется доставка.
Хлорид аммония (NH4Cl) формула, свойства, риски и использование
хлорид аммония, также известная как аммиачная соль, является неорганической солью в моче, формула которой NH4Кл. Встречается в минералогических образованиях и в таком виде называется аммиачной солью. Он также был найден в некоторых вулканических жерлах и пепла.
Это может быть получено различными методами. Первый заключается в нейтрализации с помощью HCl аммиачного остатка, образующегося при перегонке угля: NH3 + HCl → NH4Cl.

Вторая стратегия заключается в процессе Сольве для получения карбоната натрия (или бикарбоната) и где хлорид аммония образуется в качестве побочного продукта:
В процессе Solvay бикарбонат натрия выделяют фильтрацией, а затем кристаллизуется хлорид аммония, который остается в растворе (формула хлорида аммония, S.F.).
Ежегодно в Японии производится более 230 000 тонн хлорида аммония, где он в основном используется для удобрения при выращивании риса..
Однако соль без запаха имеет множество других применений, которые включают использование в производстве средств для личной гигиены, пиротехники, в качестве компонента в металлургической промышленности, в медицине, в качестве ароматизатора в пищевой промышленности и в качестве электролита в цинковых батареях. -карбон (Химическая Компания, 2016).
- 1 Физико-химические свойства
- 2 Реактивность и опасности
- 3 использования
- 3.1 1- Медицина
- 3.2 2- Удобрения
- 3.3 3- Металлургия
- 3.4 4- Аккумуляторный компонент
- 3,5 5- Обед
- 3.6 6- Другое использование
- 4 Ссылки
Физико-химические свойства
Хлорид аммония – это гигроскопичные мелкодисперсные белые частицы без запаха (Национальный центр биотехнологической информации, 2017).

Соединение имеет триклинную сетчатую структуру с кубической структурой с центром в центре. Его молекулярная масса составляет 53 490 г / моль, его плотность составляет 1,5274 г / мл, а температуры плавления и кипения составляют 338 ° С и 520 ° С..
Хлорид аммония растворим в воде, способен растворять 383,0 г соединения на литр растворителя. Он также растворим в этаноле, метаноле и глицерине и мало растворим в ацетоне. Он нерастворим в органических растворителях, таких как этилацетат (Royal Society of Chemistry, 2015).
Хлорид аммония может подвергаться различным реакциям, имеющим большое значение для химической и фармацевтической промышленности. Может разлагаться при нагревании в соляной кислоте и аммиаке:
Кроме того, он может реагировать с основаниями, такими как гидроксид натрия или калия, с образованием газообразного аммиака:
Другая важная реакция, в которой используется хлористый аммиак, – это разложение карбонатов и бикарбонатов с образованием соли и аммиака:
Хлорид аммония считается кислой солью. Полученные растворы содержат умеренные концентрации ионов гидрония и имеют рН менее 7,0. Реагируют как кислоты, чтобы нейтрализовать основания.
Как правило, они не реагируют как окислители или восстановители, но такое поведение не является невозможным. Многие из этих соединений катализируют органические реакции (хлорид аммония, 2016 г.).
Реактивность и опасности
Хлорид аммония чрезвычайно ядовит и токсичен. Он вызывает повреждение органов при проглатывании или длительном воздействии, а также вреден для глаз. Он не воспламеняется и не реагирует с другими химическими веществами (Национальный институт безопасности и гигиены труда, 2014).
В случае попадания в глаза, следует проверить, носите ли вы контактные линзы, и немедленно снять их. Глаза следует промыть проточной водой не менее 15 минут, держа веки открытыми. Вы можете использовать холодную воду. Мазь не следует использовать для глаз.
Если химическое вещество попало на одежду, удалите его как можно быстрее, защищая свои руки и тело.
Поместите жертву под безопасный душ. Если химическое вещество накапливается на незащищенной коже жертвы, например на руках, оно осторожно моет загрязненную кожу проточной водой и неабразивным мылом. Вы можете использовать холодную воду. Если раздражение не проходит, обратитесь к врачу. Выстирать загрязненную одежду перед повторным использованием.
Если контакт с кожей серьезный, его следует промыть дезинфицирующим мылом и покрыть кожу, загрязненную антибактериальным кремом..
В случае вдыхания пострадавшему должно быть разрешено отдыхать в хорошо проветриваемом помещении. Если вдыхание является серьезным, пострадавшего следует как можно скорее эвакуировать в безопасное место. Ослабьте тесную одежду, такую как воротник рубашки, ремни или галстук.
Если пострадавшему трудно дышать, следует назначить кислород. Если пострадавший не дышит, проводится реанимация из уст в уста. Всегда принимая во внимание, что человеку, оказывающему помощь в проведении реанимации изо рта в рот, может быть опасно, когда вдыхаемый материал токсичен, инфекционен или вызывает коррозию.
В случае проглатывания не вызывать рвоту. Ослабьте тесную одежду, такую как воротники рубашки, ремни или галстуки. Если пострадавший не дышит, проведите реанимацию из уст в уста.
Во всех случаях вам следует немедленно обратиться к врачу (паспорт безопасности материала Хлорид аммония, 2013).
приложений
1- Медицина
Хлорид аммония выполняет очень важную биохимическую функцию: он поддерживает физиологический уровень pH.
Как кислотная соль, она может помочь исправить ситуации, в которых концентрация хлорид-ионов в плазме низкая или в случаях алкалоза крови (высокий уровень pH крови). Это может произойти после рвоты, всасывания (удаления) содержимого желудка, использования диуретиков (таблеток с водой или жидкостью) или при некоторых заболеваниях желудка..
Хлорид аммония также вызывает выведение излишков солей и воды через мочеиспускание и вызывает ацидоз в моче (делает его более кислым).
Хлорид аммония также используется для уменьшения отека или увеличения веса, которое происходит до менструации, и в качестве помощи при лечении инфекций мочевыводящих путей (Университет Юты, 2017).
Это компонент многих лекарств от простуды и кашля из-за его эффективности в качестве отхаркивающего средства. В ветеринарной медицине его используют для профилактики мочекаменной болезни у коз, крупного рогатого скота и овец (Encyclopædia Britannica, 2016).
2- Удобрения
Хлорид аммония в основном используется в качестве источника азота в удобрениях (что соответствует 90% мирового производства соединения), таких как хлораммонийфосфат, в основном для выращивания риса и пшеницы в Азии..
3- Металлургия
Хлорид аммония используется в качестве флюса при изготовлении металлов, которые должны быть покрыты оловом, оцинкованы или сварены. Он работает как флюс, очищая поверхность заготовок, реагируя с оксидами металлов на поверхности, образуя летучий хлорид металла..
Для этого он продается в блоках в хозяйственных магазинах для использования при чистке наконечника паяльника и может быть включен в припой в виде флюса..
4- компонент батареи
Хлорид аммония, NH4Cl, является компонентом сухих батарей, энергетических резервуаров, которые питают электрические устройства. Батареи позволяют вам использовать электричество, когда вы не находитесь рядом с электрической розеткой или розеткой.
Для каждой батареи есть три основных компонента: катод (верхняя часть вашей обычной батарейки АА, из которой текут электроны), анод (нижняя часть батареи АА, в которую текут электроны) и электролит для через которые могут двигаться электроны и ионы.
Когда хлорид аммония используется в качестве электролита в батарее, он превращается в водную пасту и помещается между катодом и анодом.
Химические реакции между катодами батареи и анодами заставляют электроны протекать через пасту из хлорида аммония от катода к аноду.
Электроны проходят через металлические контакты в батарейном отсеке, заставляя электрическое оборудование работать (American Chemistry Council, Inc., 2005).
5- Еда
В некоторых странах хлорид аммония, под названием соль аммиака или разговорно сальмиакки, используется в качестве пищевой добавки под номером E E510, обычно в качестве дрожжевого питательного вещества при производстве хлеба.
Это пищевая добавка для крупного рогатого скота и ингредиент в питательной среде для дрожжей и многих микроорганизмов.
Хлорид аммония используется для придания вкуса темным конфетам, называемым соленой солодкой (очень популярным в скандинавских странах), для выпечки, чтобы дать бисквитам очень хрустящую текстуру, а в ликере Salmiakki Koskenkorva для ароматизации..
В Индии и Пакистане его называют «ношадер» и используют для улучшения свежести бутербродов, таких как самоса и джалеби.
6- Другое использование
Хлорид аммония можно найти в шампунях, красках и отбеливателях для волос, средствах для мытья и очищения тела, моющих средствах для лица, кондиционере, моющем средстве для мытья посуды, а также в маслах и солях для ванн..
Хлорид аммония также используется в травлении при изготовлении печатных плат, таких как огнетушитель. Он также является компонентом фейерверков, взрывчатых веществ и спичек, а также отвердителем в клеях на основе формальдегида..



