Формула этиленгликоля: как это вещество изменило нашу жизнь
Утро многих людей начинается похоже: выпиваем бутылку воды, заводим машину, чтобы поехать на работу, сидим в офисе, задумчиво глядя на стену с календарем, где уже отмечены даты отпуска. Но мало кто знает, что ничего этого бы не было, если бы не этиленгликоль (моноэтиленгликоль, или МЭГ), благодаря которому появилась пластиковая тара, антифриз и даже краска для стены. Рассказываем о незаменимых свойствах этиленгликоля и сферах его применения.
 Рассказываем, что такое этиленгликоль
Рассказываем, что такое этиленгликоль
Многопрофильное вещество
Этиленгликоль – один из наиболее популярных видов нефтехимического сырья и компонент для многих промышленных продуктов. Это двухатомный спирт, который в очищенном виде выглядит, как бесцветная жидкость без запаха. Вещество достаточно токсично и отнесено к третьему классу опасности по международной классификации.
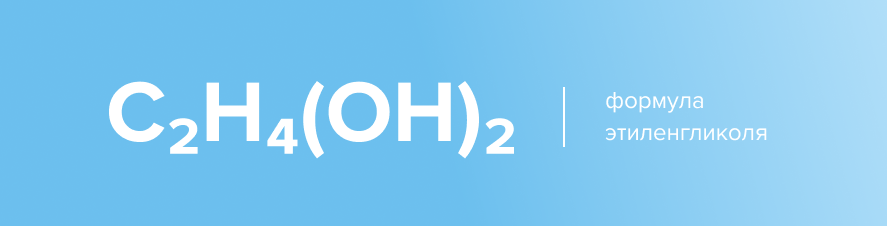 Формула этиленгликоля
Формула этиленгликоля
- в высокой концентрации он переносит нагрев почти до 200 градусов, что позволяет использовать их в теплоносителях;
- температура их кристаллизации в смеси с водой может опускаться вплоть до 75 градусов ниже нуля. Это делает МЭГ наиболее популярным компонентом антифризов автомобильных систем охлаждения. Максимальной морозоустойчивости МЭГ достигает в пропорции с водой в 25/75%.
 Основные характеристики этиленгликоля
Основные характеристики этиленгликоля
Но полвека с момента его открытия этиленгликоль фактически «пролежал на полке».
От нефти к «зеленым» технологиям. История создания этиленгликоля
История производства этиленгликоля началась в середине 19 века. Впервые это вещество в 1859 году синтезировал французский химик Шарль Адольф Вюрц. Вначале — из диацетата этиленгликоля, а в год спустя – гидратацией этиленоксида. Но потом еще полвека этиленгликоль не получал широкого распространения.
Его свойства оценили только в ходе Первой мировой войны. Германия начала применять этиленгликоль при производстве взрывчатки, используя в качестве сырья дихлорэтан. Следом были запущены мощности по его выпуску в США на базе этиленхлоргидрина.
Наиболее масштабное производство этиленгликоля начала компания Carbide в 1937 году, используя технологию газофазного окисления этилена и этиленоксида. Монополия на такой способ производства сохранялась до 1953 года.
За счет низкой себестоимости и более конкурентного набора свойств к середине 20 века этиленгликоль полностью вытеснил глицерин из промышленного производства динамита, а также из состава охлаждающей жидкости, спрос на которую стремительно рос с развитием машиностроения.
Сейчас этиленгликоль производится в основном путем гидратации (присоединение молекул воды) оксида этилена. В одном из вариантов это происходит при давлении в 10 атмосфер и температуре около 180 градусов в присутствии кислотного катализатора. На выходе получается жидкость, содержащая до 90% чистого этиленгликоля.
Побочные продукты – диэтиленгликоль и триэтиленгликоль – также используются в промышленности, например, в дезинфекторах, системах охлаждения воздуха и при производстве пластификаторов.
Другой вариант синтеза МЭГ – гидратация этилена с участием серной или ортофосфорной кислот при давлении в 1 атмосферу и температуре 50-100 градусов.
На фоне прогнозируемого сокращения добычи углеводородов повышается интерес к экологичным методам выпуска этиленгликоля. Американская компания IPCI нашла новый способ производства многоатомных спиртов из сахаров любого происхождения и уже запустила по этой технологии завод на 10 тыс. тонн продукции в год в Китае.
Запустить заводы по производству этиленгликоля из растительного сырья в середине 2020-ых годов планируется и в Европе.
После отвязки цены на МЭГ от нефтяных котировок, рынок станет прозрачнее, а сферы применения этиленгликоля могут расшириться за счет разработки новых продуктов.
Пластик, антифриз и краски. Где используется этиленгликоль?
Основная часть МЭГ идет на производство полиэтилентерефталата (ПЭТ). Это одна из разновидностей полимеров, продукт поликонденсации этиленгликоля с терефталевой кислотой. ПЭТ применяется для получения синтетических волокон, пленок и пластиковых бутылок.
Именно со сферой ПЭТ связаны позитивные перспективы роста объемов потребления этиленгликоля. Популярность полиэтилентерефталата гарантируют разнообразные потребительские качества: продукция из ПЭТ выдерживает температуры от — 40 градусов до + 70 градусов, ударопрочна и практически не впитывает запахи.
Эксперты уверены, что потребление ПЭТ, а, следовательно, и этиленгликоля будет расти в ближайшие годы, несмотря на запланированное ужесточение в ЕС и некоторых других странах норм использования продукции из полиэтилентерефталата. Тем более что сроки внедрения новых требований существенно сдвинулись вправо из-за ситуации с коронавирусом, которая повысила спрос на одноразовую пластиковую посуду и тару.
Алексей Костин, генеральный директор Центра отраслевых исследований
Хотя ПЭТ незаменим во многих областях, этот продукт из первичного сырья будет замещать его рециркулированная версия из вторсырья. Степень влияния будет зависеть от регулирования в странах потребления ПЭТ, которые могут ввести обязательный норматив на r-PET в волокне или взять на себя какие-либо обязательства в области текстильного бизнеса. Например, установить пошлину на ввоз пряжи, тканей или даже одежды в зависимости от содержания в этих продуктах r-PET.
Еще один крупный сектор применения этиленгликоля в качестве сырья – изготовление охлаждающих жидкостей. Добавленный в воду МЭГ мешает ей замерзнуть в ледяной монолит, что является угрозой для двигателя, и помогает сформировать отдельные ледяные кристаллы, которые не препятствуют запуску мотора.
Благодаря низкой температуре замерзания в смеси с водой, этиленгликоль используются в противообледенительных жидкостях для авиации, которыми самолеты покрывают перед взлетом.
В качестве компонента антифриза МЭГ впервые стали использоваться еще в 1926 году, а более масштабное применение началось незадолго до Второй мировой войны в основном в военной технике.
На тот момент мало кто обращал внимание на главную проблему охлаждающих жидкостей с использованием этиленгликолей – коррозию металла двигателя от соприкосновения с ним.
Во многом это объяснялось тем, что детали были чугунные, а радиаторы – латунные. Но с внедрением автопроизводителями в 1960-ых годах более легких сплавов, в частности, алюминия, пришлось искать ответ на вопрос агрессивного воздействия МЭГ на детали автомобилей. Проблему решили ингибиторы коррозии, которые замедляли окисление этиленгликоля, оберегая двигатель.
Этиленгликоль широко используется при производстве красок как растворитель. В текстильном секторе он применяется для формирования тканей и скручивания нитей, а также как один из главных составляющих красителей для кожи.
Многообещающая динамика
Объемы производства этиленгликоля, которые уже сейчас в мире приближаются к 30 млн. тонн, постоянно увеличиваются.
В Китае к 2020 году их выпуск за последние пять лет вырос на треть, превысив 10 млн. тонн. Еще около 6 млн. тонн производит второй по величине экспортер – Саудовская Аравия.
По прогнозам экспертов, как минимум до 2025 года динамика роста спроса на МЭГ составит 5-6% в год. Россия пока не занимает существенной доли в мировом производстве. В 2020 году внутренние производители (СИБУР, Казаньоргсинтез и Нижнекамскнефтехим) выпустили менее 400 тыс. тонн этиленгликолей, что связано с низкими темпами увеличения спроса внутри страны и высокой конкуренцией на экспорте.
Благодаря возможности разностороннего применения, этиленгликоль стал незаменимым компонентом для многих промышленных отраслей. При этом экономическая эффективность его применения и перспективы дальнейшего развития в качестве экологичного сырья гарантируют МЭГ стабильный спрос еще долгие годы.
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH – | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | – | – | Н | Н | Н | |
| F – | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | – | Н | Р | Р |
| Cl – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | – | – | – | Н | – | – | Н | – | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | – | Н | ? | Н | Н | ? | М | М | – | Н | ? | ? |
| HSO3 – | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | – | Н | Р | Р |
| HSO4 – | Р | Р | Р | Р | Р | Р | Р | Р | – | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р |
| NO2 – | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | – | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO – | Р | Р | Р | Р | Р | Р | Р | Р | Р | – | Р | Р | – | Р | Р | Р | Р | Р | Р | Р | – | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2
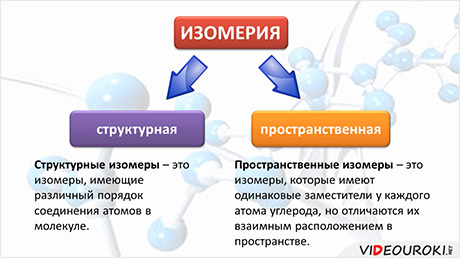
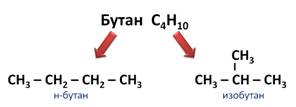
Скопируйте эту ссылку, чтобы разместить результат запроса ” ” на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса ” ” содержит ошибку, нажмите на кнопку “Отправить”. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки – помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация – такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Изомерия в органической химииИзомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение. Изомерия – это явление существования веществ с одинаковым составом, но различным строением. Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С. Виды изомерии Различают два основных вида изомерии: структурную и пространственную (стереоизомерию) . Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве. Структурная изомерия Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается. 1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная. Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул. 2.1. Изомерия положения функциональной группы . Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу. Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
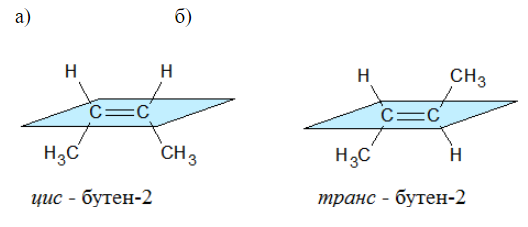
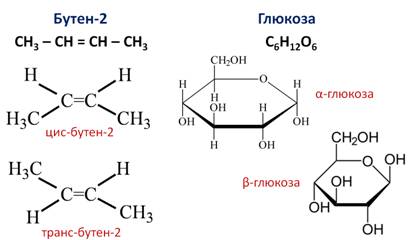
Пространственная изомерия Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия. 1. Геометрическая изомерия (или цис-транс-изомерия). Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов. Двойная связь не имеет свободного вращения вокруг своей оси. Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот. Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
Например , в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры. Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
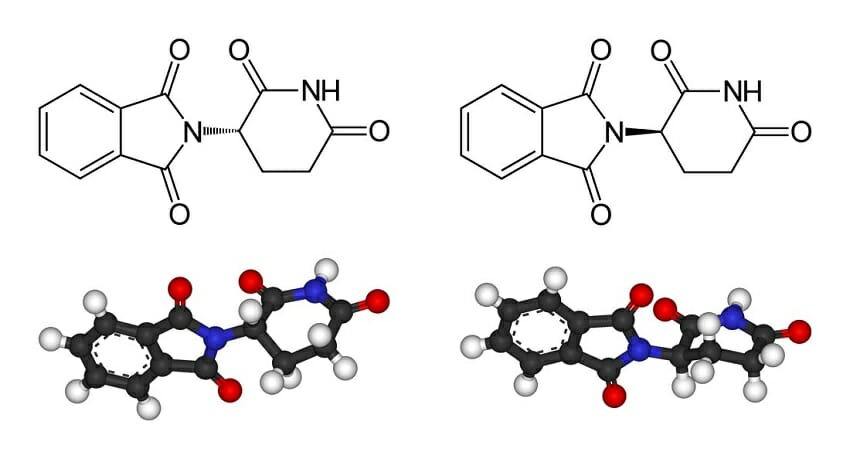
2. Оптическая изомерия Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение. Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода. Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества. Например, оптические изомеры образует 3-метилгексан: Изомеры органических веществОрганические соединения с одинаковым качественным и количественным составом – изомеры — могут отличаться по свойствам. Причиной является различное строение, которое определяет отношение веществ к классу соединений. Чтобы определить класс недостаточно оперировать молекулярной формулой вещества – необходимо знать графическую формулу, которая показывает структурное и пространственное расположение атомов в молекуле. ОпределениеИзомеры — это химические соединения с идентичным атомным составом, но различные по строению или пространственному расположению атомов. Изомеры имеют разные химические свойства. Основные виды изомерии:
Структурная изомерияСтруктурные изомеры – химические вещества, при одинаковом качественном и количественном составе различающиеся порядком расположения атомов – строением вещества. Выделяют шесть видов структурной изомерии: Изомерия углеродного скелетаПентан
Изомерия положения кратной связиПри общей формуле
У изомеров положения кратной связи параллельно может быть изомерия углеродного скелета. Для пентена это:
Общее число структурных изомеров пентена равно пяти, из которого два изомера положения двойной связи и три изомера углеродного скелета. Изомерия положения функциональной группыК функциональным группам относятся фрагменты органических соединений, определяющие их свойства. Для примера: -ОН гидроксильная, -СООН карбоксильная, -NH2 аминогруппа, -CN цианогруппа и другие. Как выглядит изомерия положения можно рассмотреть на примере пентана и -Cl в качестве функциональной группы:
Хлорпентан имеет 3 положения функциональной группы, которые различаются между собой местом расположения заместителя на углеродной цепи. Валентная изомерияИзомеры, которые можно перевести из одного в другой путем перераспределения внутренних связей называют валентными. Внутримолекулярная перегруппировка является не катализируемым и не зависящим от растворителя процессом. На внутримолекулярные изменения, влияет температура, в случае с бензолом Хюккеля УФ-облучение.
Бензол Дьюара трансформируется в обычный бензол при t 20°С за 48 часов, при t 90°С для изомеризации достаточно 30 минут. Преобразование бензола в бензвален (бензол Хюккеля) происходит при его облучении УФ-светом с определенной длиной волны. Призман – самый нестабильный из изомеров бензола. Межклассовая изомерияСоединения, имеющие общую формулу, могут содержать функциональные группы, относящиеся к разным классам соединений. Общую формулу
Изомерия статическая и динамическаяРазличают типы изомерии:
К статической относятся изомерия углеродного скелета, положения кратной связи, функциональной группы, межклассовая и валентная. Пример динамической изомерии – прототропная таутомерия, при которой обратимая изомеризация происходит за счет перехода протона водорода внутри молекулы. СтереоизомерияВ пространственных изомерах с одинаковой структурной формулой, атомы молекулы ориентированы в пространстве по-разному. Чем же отличается структурная изомерия от пространственной: первая рассматривает порядок атомов в молекуле на плоскости, а вторая – в объеме. Стереоизомерия делится на геометрическую (цис-транс) и оптическую. Цис-транс — изомерия (геометрическая)Геометрические изомеры присутствуют в веществах, имеющих двойные связи или циклы. Подразделяют геометрические изомеры относительно плоскости, в которой расположена π-связь или закольцованный цикл. Изомеры, у которых одинаковые заместители расположены по одну сторону от плоскости называют цис- изомерами. Соединения, у которых заместители расположены по разные стороны от плоскости π-связь или кольца называют транс- изомерами. Наглядной иллюстрацией могут служить простейшие геометрические изомеры — бутен-
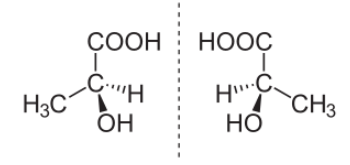
Оптическая изомерияПри исследовании веществ с одинаковой структурной формулой на поляриметре было выявлено явление вращения плоскости поляризованного света. Такие вещества получили название оптически активных веществ. Исследования показали, что молекулы этих веществ хиральны, то есть несовместимы со своим отражением в зеркале. Хиральные вещества присутствуют в виде двух оптических антиподов (энантиомеров), один из которых правовращающий (+), а другой – левовращающий (-). Определить знак оптического изомера можно с помощью поляриметра. Причина хиральности состоит в присутствии ассиметрического атома углерода – связанного с четырьмя различными заместителями. Хиральные молекулы невозможно совместить, так как они зеркально симметричны. Пример пары стереоизомеров, представляющих зеркальные отражения: (S)-(+)- Молочная кислота (слева) и (R)-(-)-Молочная кислота (справа).
Для изображения оптических изомеров используют проекционные формулы Э.Фишера. Правила построения формул ФишераИзображают стереоизомеры с ассиметрическим атомом углерода на плоскости в виде проекционных форм, предложенных в конце XIX века Э.Фишером.
Правила изображения проекции Фишера:
Правила пользования проекциями Фишера имеют ограничения:
Номенклатура стереоизомеров основана на правиле последовательности заместителей при асимметрическом атоме углерода по старшинству (определяется как порядковый номер в Периодической таблице). Учитывается направление уменьшения старшинства: падение по часовой стрелке обозначается как R, против – как S. ЗаключениеВсе виды изомерии органических соединений делят на две части – структурная изомерия и пространственная. Изомеры, относящиеся к первой группе, различаются порядком соединения атомов, а ко второй – только их пространственным расположением. Классификация изомеров опирается на различия между ними. Изучение множества структурных и пространственных форм веществ стали возможны благодаря работам А.М.Бутлерова и Я.Г.Вант-Гоффа. Изомерия в химии – определение, положения, примеры и видыАбросимова Елена Владимировна учитель химии и биологии
НАВИГАЦИЯВиды изомерии
1. Структурная изомерия Причиной структурной изомерии является различный порядок соединения атомов в молекулах. Она включает: – изомерию, определяемую строением углеродного скелета
– изомерию, определяемую положением кратных связей – изомерию, определяемую положением функциональных групп – изомерию, определяемую принадлежностью веществ к разным классам (межклассовая)
– изомерию взаимного расположения заместителей
На данный вид изомерии ещё указывал А. М. Бутлеров, называя его «изомерия нецельных структур».
Геометрическая изомерия определяется различным положением групп атомов относительно кратной связи или цикла.
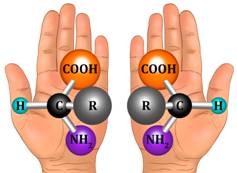
Данные молекулы относятся друг к другу как две руки – левая и правая, то есть являются антиподами. Условием существования антиподов является наличие в молекуле асимметрического атома углерода (хирального центра). Изомер – определение, типы, пример и тестОпределение изомераИзомеры – это две молекулы с одинаковой молекулярной формулой, но структурно различающиеся. Следовательно, изомеры содержат одинаковое количество атомов для каждого элемента, но расположение атомов отличается. Несмотря на одинаковую молекулярную формулу, физические свойства каждого молекула может отличаться, особенно если функциональные группы, связанные с каждой молекулой, различны. Изомеризация – это процесс, при котором одна молекула превращается в другую молекулу с одинаковыми атомами. Это может происходить спонтанно или может потребоваться реакция для достижения этого эффекта. Типы изомеровСуществует два основных типа изомеров: структурные изомеры и стереоизомеры (показаны ниже). Структурные изомерыСтруктурные изомеры различаются в отношении специфического присоединения атомов и функциональных групп. Таким образом, в зависимости от конкретных изомеров, они не могут быть отнесены к одной и той же функциональной группе, и они будут иметь разные названия IUPAC. Типы структурных изомеров включают в себя цепные изомеры (например, углеводородные цепи, демонстрирующие различные схемы разветвления); положение изомеров, которые различаются в зависимости от расположения функциональной группы на цепи; функциональные группы изомеров, в которых функциональная группа дополнительно разделена на различные функциональные группы; и скелетные изомеры, которые имеют различные углеродные цепи. Другим типом структурного изомера является таутомер. Таутомеры самопроизвольно преобразуются между двумя структурными изомерами и проявляют различные свойства в зависимости от конкретной изоформы. Иногда конверсия таутомеров может быть настолько быстрой, что выделение обоих невозможно. стереоизомерыСтереоизомеры относятся к изомерам, которые имеют одинаковую структуру связи, но различаются в отношении геометрического положения функциональных групп и атомов. Типы стереоизомеров состоят из энантиомеров, диастереомеров и конформационных изомеров. Энантиомеры являются зеркальными изображениями, которые содержат хиральные центры и не являются наложенными. Диастереомеры не являются зеркальными изображениями, которые могут содержать или не содержать хиральные центры. Конформационные изомеры показывают различные вращения вокруг одинарных связей. Пример изомераЕсть несколько примеров изомеров, описанных следующим образом: Метоксиэтан и пропанолХимическая структура C3H8O существует в виде нескольких изомеров пропанола, а также изомера метоксиэтана. Два изомера пропанола состоят из пропан-1-ола и пропан-2-ола (также известного как изопропиловый спирт), которые отличаются размещением атома кислорода либо на концевом атоме углерода, либо на центральном атоме углерода, соответственно. Метоксиэтан также является изомером C3H8O, но представляет собой простой эфир, так как атом кислорода находится в центре молекулы, а не связан с одним атомом углерода. Метилацетилен и алленМетилацетилен и аллен являются примером изомеров C3H4, которые различаются в зависимости от типа связи, проявляемой молекулами. Метилацетилен имеет одну тройную связь и одну одинарную связь между атомами углерода, а аллен имеет две двойные связи между атомами углерода. Фульминат и цианатФульминат и цианат являются примером изомеров CNO. Фульминат демонстрирует расположение, в котором N связан как с атомами С, так и с О, тогда как в цианате и О, и N связаны с центральным атомом С. Глюкоза и фруктозаГлюкоза и фруктоза являются примером изомеров C6H12O6, которые различаются в зависимости от положения атома кислорода с двойной связью. В глюкозе О расположен на первом С, тогда как он расположен на втором С во фруктозе (структуры каждого показаны ниже). Фармацевтические примерыИзомеры чрезвычайно важны при разработке фармацевтических препаратов, поскольку обычно только один изомер конкретной молекулы будет оказывать желаемый эффект. Например, только один изомер ибупрофена будет связываться с необходимой мишенью в организме человека и вызывать облегчение боли. Точно так же цисплатин является эффективным противоопухолевым препаратом, в то время как его изомер, трансплатин, вообще не оказывает противоракового действия. Один из самых известных примеров – талидомид (на фото ниже). Хотя один изомер талидомида является сильнодействующим средством для подавления утреннего недомогания, он был доставлен в соотношении 50:50 со своим стереоизомером, который был ответственен за врожденные дефекты, наблюдаемые у детей, родившихся в 1950-х годах, от матерей, которые принимали препарат. Ферментативные реакцииОдна из важнейших функций изомеров в организме человека – ферментативные реакции. Ориентация, функциональные группы, длины связей и общая трехмерная структура молекулы влияют на ее способность связываться с ферментами. Ферменты обычно распознают определенную молекулярную форму, похожую на замок и ключ. Следовательно, изомеры, которые имеют различную физическую форму, не смогут связываться с конкретным ферментом, несмотря на то, что они имеют одинаковую молекулярную формулу. Примером этого является фермент триозофосфатизомераза, который участвует в гликолизе, катализируя взаимопревращение дигидроксиацетона и (R) -глицеральдегидфосфата; однако изомер (S) -глицеральдегид не достигает той же реакции, поскольку он не вписывается в триозофосфатный фермент. Ферменты, которые функционируют для превращения молекул в их изомеры (например, триозофосфатизомераза, описанная выше), называются изомеразами. викторина1. Изомеры с одинаковой структурой связи, но геометрическим положением атомов и функциональных групп, известны как:A. Структурные изомерыB. стереоизомерыC. таутомерыD. Цепные изомеры Ответ на вопрос № 1 В верно. Стереоизомеры отличаются от структурных изомеров, потому что они имеют одинаковую структуру основной связи, но атомы и функциональные группы имеют тенденцию вращаться или располагаться по-разному в пространстве. 2. Молекулы А, В и С являются изомерами. Фермент А связывается с изомером А с образованием изомера В и наоборот, но Фермент А не может связываться с изомером С. Фермент А является примером:A. ИзомеразаB. СтереоизомерC. Структурный изомерD. Конверсионный изомер Ответ на вопрос № 2 верно. Изомеразы – это специализированные ферменты, которые превращают молекулу в ее изомер. Однако не все изомеры способны связываться с ферментом из-за физической структуры молекулы. 3. Изомеры важны в биологических системах, потому что:A. Различные изомеры могут оказывать различное влияние на организм. XXB. Конкретные изомеры могут потребоваться для ферментативных реакцийC. Фармацевтическая разработка должна учитывать все потенциальные изомеры, чтобы избежать потенциальных вредных побочных эффектов, вызванных непреднамеренным взаимодействием изомеров молекулы при доставке пациентам.D. Все вышеперечисленноеE. Только А и БF. Ни один из вышеперечисленных Ответ на вопрос № 3 D верно. Поскольку физическая структура часто различается между изомерами, разные изомеры могут по-разному связываться с различными рецепторами или ферментами в организме, вызывая тем самым дифференциальные эффекты. Это может представлять потенциальную проблему в фармацевтической промышленности, если лекарство содержит смесь его изомеров, поскольку такие молекулы могут вызывать непреднамеренные эффекты. Изомерия, её видыУрок 4. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикамЧтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге. Получите невероятные возможности
Конспект урока “Изомерия, её виды”Изомерия (от греческих слов «изос» – «равный» и «мерос» – «часть», «доля») — явление существования химических соединений — изомеров, — одинаковых по составу и молекулярной массе, но различающихся по строению или расположению атомов в пространстве и по свойствам. Термин «изомерия» вёл в химию Й. Берцелиус в 1830 году, а подлинное объяснение этот термин получил во второй половине 19 века на основе теории химического строения А. М. Бутлерова и стереохимического учения Я. Вант-Гоффа. Например, вам известно, что молекулярная формула бутана – С4Н10. Бутан, в молекуле которого атомы расположены в виде линейной цепочки, называют нормальным бутаном, а бутан, цепь атомов углерода которого разветвлена, называют изобутаном. Эти два вещества имеют одинаковую молекулярную формулу, но различаются по строению, а значит, и по свойствам.
Например, молекулярной формуле C2H6O соответствуют два вещества с разными структурными формулами – этиловый спирт и диметиловый эфир. Они также имеют одинаковый состав, по разное строение и свойства. Этиловый спирт – жидкость, которая реагирует с металлическим натрием с выделением водорода, кипит при +78,5 0 С. При тех же условиях диметиловый эфир – газ, не реагирующий с натрием, кипит при -23 0 С. Существуют два основных типа изомерии. Это структурная и пространственная. Структурные изомеры – это изомеры, имеющие различный порядок соединения атомов в молекуле. Пространственные изомеры – это изомеры, которые имеют одинаковые заместители у каждого атома углерода, но отличаются их взаимным расположением в пространстве. Различают три вида структурной изомерии. Это изомерия углеродного скелета, обусловленная различным порядком связи атомов углерода, изомерию положения, обусловленную различным положением функциональных групп или кратных связей при одинаковой углеродной цепи. Изомерия углеродного скелета характерна для любых классов органических соединений. Например, для вещества С4Н10 изомерами будут бутан и 2-метилпропан, для С5Н8 – это пентин и 3-метилбутин-1, для С5Н10О2 – это пентановая кислота и 2-метилбутановая кислота, 3-метилбутановая кислота, для С5Н12О – это пентанол-1 и 2-метилбутанол-1, для С4Н8О2 – это пропилметаноат и изопропилметаноат. Если рассмотреть изомерию положения кратной связи или функциональной группы, то существуют структурные изомеры с одинаковым углеродным скелетом, которые отличаются положением кратных связей (двойных и тройных) или функциональных групп. Например, изомерия положения кратных связей характерна для алкенов, алкинов и диенов. Так, изомерами по отношению друг к другу будут бутен-1 и бутен-2, бутин-1 и бутин-2, бутадиен-1,2 и бутадиен-1,3. Изомерия положения функциональных групп характерна для спиртов и аминов. Так пропанол-1 и пропанол-2 будут по отношению к друг другу изомерами, как и бутанамин-1 и бутанамин-2, α-аминопропановая кислота и β-аминопропановая кислота. В межклассовой изомерии вещества относятся к различным классам органических соединений, как этанол и диметиловый эфир имеют общую формулу – С2Н6О или бутин-1 и бутадиен-1,3, относящиеся к классам алкинов и диенов, а также этановая кислота и метилметаноат (то есть насыщенные одноосновные карбоновые кислоты и сложные эфиры). Различают два вида пространственной изомерии: геометрическую и оптическую. Геометрическая изомерия характерна для соединений с двойной углерод-углеродной связью. Так для молекулы бутена-2 характерно 2 изомера: цис-изомер и транс-изомер. У цис-изомера одинаковые группы атомов находятся по одну сторону от плоскости, а у транс-изомера – по разные стороны. Другим примером пространственных изомеров являются циклические α- и β-формы глюкозы, различающиеся положением гидроксильных групп у первого атома углерода.
Оптической изомерией обладают только те вещества, у которых есть асимметрический, или хиральный атом (от греческого хирос – «рука», «образец несимметричной фигуры»), то есть это атом, который связан с четырьмя различными заместителями. Оптические изомеры являются зеркальным изображением друг друга, подобно двум ладоням и несовместимы. Так, молочная кислота, или 2-оксипропановая кислота, существует в виде двух оптических изомеров, потому что она содержит 1 асимметрический атом углерода.
Оптическая изомерия называется также энантиомерией (от греческого enantios – «противоположный» и meros – «часть»), а оптические изомеры – энантиомерами. У хиральных молекул возникают изомерные пары, в которых молекулы изомеров различаются пространственной организацией, точно также, как предмет и его зеркальное отражение. Пара таких изомеров имеют, как правило, одинаковые химические и физические свойства, но разную оптическую активность: если один изомер вращает плоскость поляризованного света по часовой стрелке, то другой – обязательно против. Тогда один изомер называют правовращающим, а второй – левовращающим. |











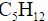 имеет три структурные формулы изомеров:
имеет три структурные формулы изомеров:
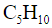 пентен имеет два изомера, различающихся расположением двойной связи:
пентен имеет два изомера, различающихся расположением двойной связи: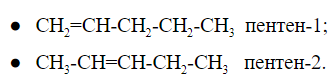
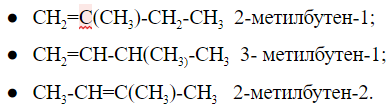
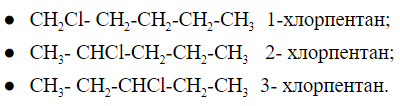
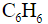 бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
бензол – у этого простейшего ароматического углеводорода, известны три валентных изомера:
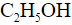 имеют два вещества:
имеют два вещества: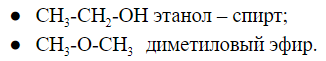
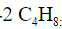 :
: