Физико-химические свойства толуола, уравнения реакций
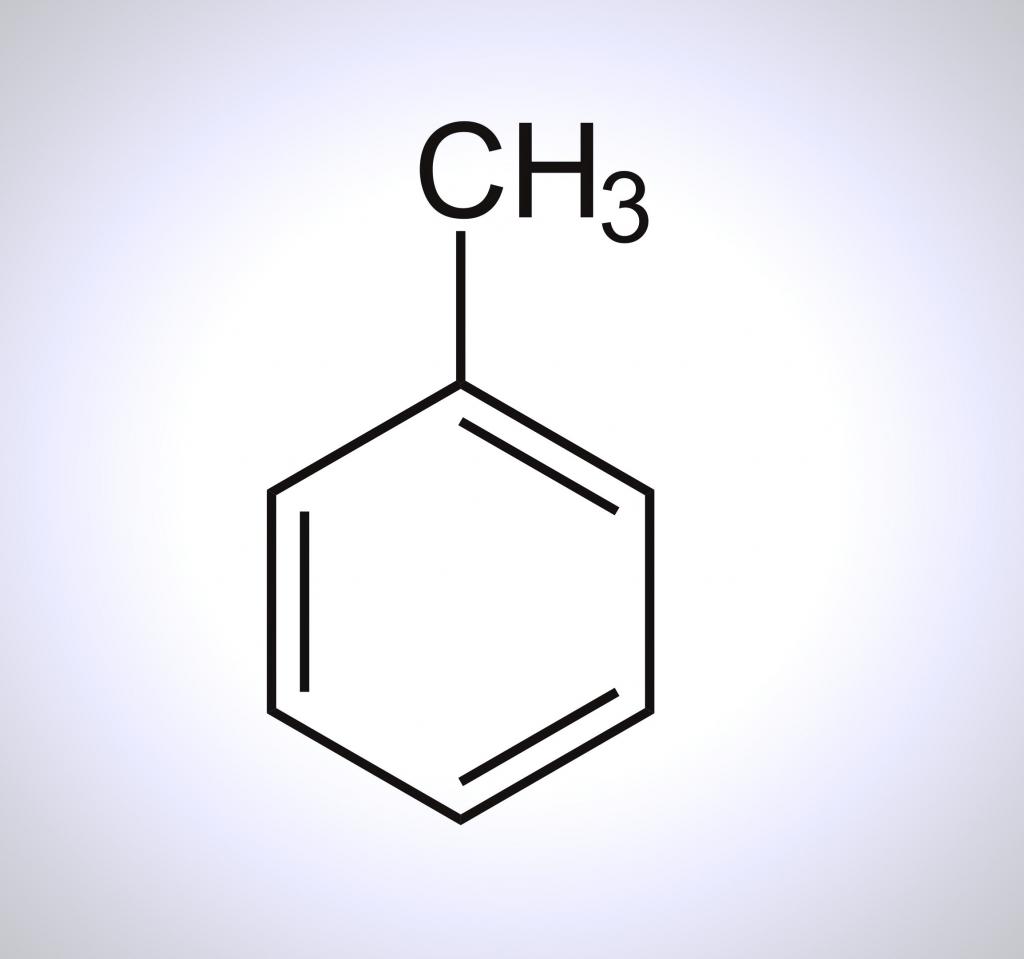
Толуол – это метилбензол, представляющий собой бесцветную жидкость, относящуюся к классу аренов, которые являются органическими соединениями с ароматической системой в составе.
Ключевой особенностью данного вещества можно считать его специфический запах. Впрочем, это не единственная «отличительная черта» вещества. Свойств и характеристик у толуола много, и обо всех них стоит вкратце рассказать.

Немного истории
Химические свойства толуола начали изучать чуть меньше 200 лет тому назад, когда его и получили впервые. Вещество обнаружил в 1835 году французский фармацевт и химик Пьер Жозеф Пеллетье. Ученый получил толуол при перегонке сосновой смолы.
А спустя три года французский физикохимик Анри Сент-Клер Девиль выделил данное вещество из бальзама, который он привез из колумбийского города Толу. В честь этого напитка, собственно говоря, соединение и получило свое название.
Общие сведения
Что можно сказать о характеристиках и химических свойствах толуола? Вещество представляет собой летучую подвижную жидкость с резким запахом. Оказывает легкое наркотическое действие. Реагирует с неограниченным количеством углеводородов, взаимодействует с простыми и сложными эфирами, со спиртами. С водой не смешивается.
- Вещество обозначается формулой С7Н8.
- Его молярная масса равна 92,14 г/моль.
- Плотность составляет 0,86694 г/см³.
- Температуры плавления и кипения равны −95 ℃ и 110,6 ℃ соответственно.
- Удельная теплота испарения составляет 364 кДж/кг.
- Критическая температура фазового перехода равна 320 °C.
Еще это вещество отличается горючестью. Сгорает коптящим пламенем.
Основные химические свойства
Толуол – это вещество, которому свойственны реакции электрофильного замещения. Они происходят в так называемом ароматическом кольце, проявляющим анормально высокую стабильность. Эти реакции идут, в основном, в пара- и орто-положениях относительно метильной группы -CH3.
Относятся к химическим свойствам толуола реакции озонолиза и присоединения (гидрирование). Под воздействием некоторых окислителей метильная группа становится карбоксильной. Чаще всего для этого используется щелочной раствор калийного перманганата или неконцентрированная азотная кислота.
Еще стоит отметить, что толуол способен самовоспламеняться. Для этого необходима температура в 535 °C. Вспышка происходит при 4 °C.

Образование бензойной кислоты
Способность обсуждаемого вещества участвовать в этом процессе также обусловлена его химическими свойствами. Толуол, реагируя с сильными окислителями, образует простейшую одноосновную бензойную карбоновую кислоту, относящуюся к ароматическому ряду. Ее формула – С6Н5СООН.
Кислота имеет вид белых кристаллов, которые хорошо растворяются в диэтиловом эфире, хлороформе и этаноле. Ее получают посредством следующих реакций:
- Толуол и перманганат калия, взаимодействующие в кислой среде. Формула следующая: 5С6Н5СН3 + 6KMnO4 + 9H2SO4 → 5С6Н5СООН + 6MnSO4 + 3K2SO4 + 14Н2О.
- Толуол и перманганат калия, взаимодействующие в нейтральной среде. Формула такая: С6Н5СН3 + 2KMnO4 → С6Н5СООК + 2MnO2 + КОН + Н2О.
- Толуол, взаимодействующий на свету с галогенами, энергичными окислителями. Происходит по формуле: С6Н5СН3 + Х2 → С6Н5СН2Х + НХ.
Полученная вследствие этих реакций бензойная кислота применяется во многих сферах. В основном ее используют для получения реактивов – бензоилхлорида, бензоатных пластификаторов, фенола.
Также ее применяют при консервировании. Добавки Е213, Е212, Е211 И Е210 изготовлены именно на основе бензойной кислоты. Она блокирует ферменты и замедляет обмен веществ, подавляет рост дрожжей, плесени и бактерий.
А еще бензойная кислота используется в медицине для лечения кожных заболеваний, и как отхаркивающее средство.

Получение вещества
Демонстрирующие химические свойства толуола уравнения реакций, представленные выше – это еще не все, что хотелось бы рассмотреть. Важно поговорить и о процессе получения данного вещества.
Толуол является продуктом промышленной переработки бензиновых фракций нефти. Это еще называется каталитическим риформингом. Вещество выделяют селективной экстракцией, после чего проводят ректификацию – разделяют смесь посредством противоточного тепло- и массообмена между жидкостью и паром.
Нередко данный процесс заменяется каталитическим дегидрированием гептана. Это органический алкан с формулой СН3(СН2)5СН3. Дегидрирование происходит через метилциклогексан – циклоалкан с формулой С7Н14. Это моноциклический углеводород, у которого метильной группой замещен один атома водорода.
Очищают толуол так же, как и бензол. Вот только если применяется серная кислота, нужно учесть – это вещество сульфируется легче. Значит, при очищениитолуола надо поддерживать более низкую температуру. Ниже 30 °C, если быть точнее.

Толуол и бензол
Поскольку эти два вещества похожи, стоит выполнить сравнение химических свойств. Бензол и толуол оба вступают в реакции замещения. Однако скорости их протекания отличаются. Поскольку в молекуле толуола метальная группа влияет на ароматическое кольцо, он реагирует быстрее.
Но бензол, в свою очередь, проявляет устойчивость к окислению. Так, например, когда на него воздействует перманганат калия, ничего не происходит. Зато толуол при такой реакции образует бензойную кислоту, о чем уже упоминалось ранее.
В то же время, известно, что предельные углеводороды не реагируют с раствором калиевого перманганата. Так что окисление толуола объясняется влиянием, оказываемым бензольным кольцом на метильную группу. Данное утверждение подтверждается теорией Бутлерова. В соответствии с ней атомы и их группы в молекулах оказывают взаимное влияние.
Реакция Фриделя-Крафтса
Выше было многое сказано о формуле и химических свойствах толуола. Но еще не упоминалось о том, что данное вещество вполне реально получить из бензола, если выполнить реакцию Фриделя-Крафтса. Так называется способ ацилирования и алкилирования ароматических соединений с использованием кислотных катализаторов. К ним относится трифторид бора (BF3), хлорид цинка (ZnCl2), алюминия (AlCl3) и железа (FeCI3).
Вот только в случае с толуолом можно использовать только один катализатор. И это трибромид железа, который представляет сбой сложное бинарное соединение неорганического характера с формулой FeBr3. А реакция выглядит следующим образом: С6Н6 + CH3Br à FeBr 3 С6Н5СН3 + HBr. Так что не только химические свойства бензол и толуол объединяют, но еще и возможность получить одно вещество из другого.

Пожарная опасность
Нельзя не упомянуть и о ней, рассказывая про химические и физические свойства толуола. Ведь это очень огнеопасное вещество.
Оно относится к классу 3,1 легковоспламеняющихся жидкостей. В эту же категорию входит дизельное топливо, газойль, десенсибилизированные взрывчатые соединения.
Нельзя допускать возникновения рядом с толуолом открытого огня, курения, искр. Даже смесь паров этого вещества с воздухом является взрывоопасной. Если выполняются сливно-наливные операции, то соблюдение правил защиты от статического электричества приобретает первостепенную важность.
Производственные помещения, предназначенные для проведения работ, связанных с толуолом, обеспечиваются приточно-вытяжной вентиляцией, а техника – отсосами. Запрещен использование инструментов, которые могут при ударе дать искру. А если происходит возгорание вещества, то тушить его нужно лишь тонкораспыленной водой, воздушно-механической или химической пеной. Разлитый толуол обезвреживают песком.
Опасность для человека
Характеристики и химические свойства толуола определяют его токсичность. Как уже было сказано, его пары оказывают наркотическое воздействие. Оно особенно сильно в повышенных концентрациях. У человека, вдохнувшего пары, появляются сильные галлюцинации. Мало кто знает, но до 1998 года это вещество входило в состав клея «Момент». Именно поэтому он был так популярен среди токсикоманов.
Высокие концентрации данного вещества также отрицательно влияют на нервную систему, слизистые оболочки глаз, кожу. Нарушается функция кроветворения, поскольку толуол – это высокотоксичный яд. Из-за этого может возникнуть такие заболевания, как гипоксия и цианоз.
Существует даже понятие толуольной токсикомании. Она имеет и канцерогенное влияние. Ведь пару, попадая через кожу или органы дыхания в организм человека, поражают нервную систему. Порой, данные процессы обратить невозможно.
Кроме того, пары могут вызвать заторможенность и нарушить работу вестибулярного аппарата. Поэтому люди, работающие с данным веществом, трудятся в хорошо проветриваемых помещениях, обязательно под тягой, и используют специальные резиновые перчатки.

Применение
Завершить тему физико-химических свойств толуола стоит рассмотрением областей, в которых данное вещество активно задействовано.
В основном оно используется в качестве сырья для производства нитротолуолов, бензилхлорида, бензойной кислоты, а также прочих органических веществ.
Также это соединение – эффективный растворитель для многих полимеров (аморфных кристаллических высокомолекулярных веществ). И еще его нередко добавляют в состав товарных растворителей для красок и лаков, некоторых лекарственных медикаментов. Даже в производстве взрывчатых веществ это соединение применимо. С его добавлением изготавливают тринитротолуол и тротилтол.
Ароматические УВ. Бензол
Ароматические УВ (арены) – это УВ, молекулы которых содержат одно или несколько бензольных колец.
Примеры ароматических УВ:

Арены ряда бензола (моноциклические арены)
Общая формула: CnH2n-6, n≥6
Простейшим представителем ароматических УВ является бензол, его эмпирическая формула С6Н6.
Электронное строение молекулы бензола
Общая формула моноциклических аренов CnH2n-6 показывает, что они являются ненасыщенными соединениями.
В 1856 г. немецкий химик А.Ф. Кекуле предложил циклическую формулу бензола с сопряженными связями (чередуются простые и двойные связи) — циклогексатриен-1,3,5:
Такая структура молекулы бензола не объясняла многие свойства бензола:
- для бензола характерны реакции замещения, а не реакции присоединения, свойственные ненасыщенным соединениям. Реакции присоединения возможны, но протекают труднее, чем для алкенов;
- бензол не вступает в реакции, являющиеся качественными реакциями на непредельные УВ (с бромной водой и раствором КМnО4).
Проведенные позже электронографические исследования показали, что все связи между атомами углерода в молекуле бензола имеют одинаковую длину 0,140 нм (среднее значение между длиной простой связи С—С 0,154 нм и двойной связи С=С 0,134 нм). Угол между связями у каждого атома углерода равен 120 о . Молекула представляет собой правильный плоский шестиугольник.
Современная теория для объяснения строения молекулы С6Н6 использует представление о гибридизации орбиталей атома углерода.
Атомы углерода в бензоле находятся в состоянии sp 2 -гибридизации. Каждый атом «С» образует три σ-связи (две с атомами углерода и одну с атомом водорода). Все σ-связи находятся в одной плоскости:
Каждый атом углерода имеет один р-электрон, который не участвует в гибридизации. Негибридизованные р-орбитали атомов углерода находятся в плоскости, перпендикулярной плоскости σ-связей. Каждое р-облако перекрывается с двумя соседними р-облаками, и в результате образуется единая сопряженная π-система (вспомните эффект сопряжения р-электронов в молекуле бутадиена-1,3, рассмотренный в теме «Диеновые углеводороды»):
Сочетание шести σ-связей с едиой π-системой называется ароматической связью.
Цикл из шести атомов углерода, связанных ароматической связью, называется бензольным кольцом, или бензольным ядром.
В соответствии с современными представлениями об электронном строении бензола молекулу С6Н6 изображают следующим образом:

Физические свойства бензола
Бензол при обычных условиях — бесцветная жидкость; t o пл= 5,5 о С; t o кип. = 80 о С; имеет характерный запах; не смешивается с водой, хороший растворитель, сильно токсичен.
Химические свойства бензола
Ароматическая связь определяет химические свойства бензола и других ароматических УВ.
6π-электронная система является более устойчивой, чем обычные двухэлектроиные π-связи. Поэтому реакции присоединения менее характерны для ароматических УВ, чем для непредельных УВ. Наиболее характерными для аренов являются реакции замещения.
I. Реакции замещения
1.Галогенирование

2.Нитрование
Реакцию осуществляют смесью концентрированных азотной HNO3 и серной H2SO4 кислот (нитрующая смесь):
3.Сульфирование

4.Алкилирование (замещение атома «Н» на алкильную группу) – реакции Фриделя-Крафтса, образуются гомологи бензола:

Вместо галогеналканов можно использовать алкены (в присутствии катализатора – AlCl3 или неорганической кислоты):

II. Реакции присоединения
1.Гидрирование

2.Присоединение хлора

III. Реакции окисления
2. Неполное окисление (KMnO4 или K2Cr2O7 в кислой среде). Бензольное кольцо устойчиво к действию окислителей. Реакция не происходит.
Получение бензола
1) переработка нефти и угля;
2) дегидрирование циклогексана:

3) дегидроциклизация (ароматизация) гексана:


В лаборатории:
Сплавление солей бензойной кислоты со щелочами:

Изомерия и номенклатура гомологов бензола
Любой гомолог бензола имеет боковую цепь, т.е. алкильные радикалы, связанные с бензольным ядром. Первый гомолог бензола представляет собой бензольное ядро, связанное с метильным радикалом:
Толуол не имеет изомеров, поскольку все положения в бензольном ядре равноценны.
Для последующих гомологов бензола возможен один вид изомерии – изомерия боковой цепи, которая может быть двух видов:
1) изомерия числа и строения заместителей;
2) изомерия положения заместителей.



Физические свойства толуола
Толуол — бесцветная жидкость с характерным запахом, не растворимая в воде, хорошо растворяется в органических растворителях. Толуол менее токсичен, чем бензол.
Химические свойства толуола
I. Реакции замещения
1.Реакции с участием бензольного кольца
Метилбензол вступает во все реакции замещения, в которых участвует бензол, и проявляет при этом более высокую реакционную способность, реакции протекают с большей скоростью.
Метильный радикал, содержащийся в молекуле толуола, является заместителем рода, поэтому в результате реакций замещения в бензольном ядре получаются орто- и пара-производные толуола или при избытке реагента — трипроизводные общей формулы:

а) галогенирование

При избытке галогена можно получить ди- и три- замещенные производные в соответствии с правилами ориентации:

б) нитрование

в) сульфирование

г) алкилирование

2. Реакции с участием боковой цепи
Метильная группа в метилбензоле может вступать в реакции, характерные для алканов:

При дальнейшем хлорировании можно получить дихлорметилбензол и трихлорметилбензол:

II. Реакции присоединения
Гидрирование

III.Реакции окисления
2. Неполное окисление
В отличие от бензола его гомологи окисляются некоторыми окислителями; при этом окислению подвергается боковая цепь, в случае толуола – метильная группа. Мягкие окислители типа MnO2 окисляют его до альдегидной группы, более сильные окислители (KMnO4) вызывают дальнейшее окисление до кислоты:
Любой гомолог бензола с одной боковой цепью окисляется сильным окислителем типа KMnO4 в бензойную кислоту, т.е. происходит разрыв боковой цепи с окислением отщепившейся части ее до СО2; например:
При наличии нескольких боковых цепей каждая из них окисляется до карбоксильной группы и в результате образуются многоосновные кислоты, например:

Получение толуола:
В промышленности:
1) переработка нефти и угля;
2) дегидрирование метилциклогексана:

3) дегидроциклизация гептана:

В лаборатории:
1) алкилирование по Фриделю-Крафтсу;
2) реакция Вюрца-Фиттига (взаимодействие натрия со смесью галогенбензола и галогеналкана):

Похожее
Добавить комментарий Отменить ответ

Репетитор по химии. Занятия проходят онлайн по Скайпу. По всем вопросам пишите в Ватсапп: +7 928 285 70 42
Химические свойства алюминия ⚗ строение атома, обозначение, степень окисления, физические свойства, способы получения и применения, с какими веществами взаимодействует
Ключевые слова конспекта: алюминий, свойства алюминия, получение и применение алюминия, алюмосиликаты, глина, оксид алюминия, боксит, дюралюмин, дюраль.
Алюминий Al – элемент № 13, 3–го периода, IIIA группы, Ar (Al) = 27. Электронная конфигурация невозбуждённого атома алюминия 1s 2 2s 2 2p 6 3s 2 3p 1 :

Алюминий является р-элементом. В своих соединениях он всегда имеет степень окисления +3. Оксид и гидроксид алюминия (Al2O3 и Al(ОН)3 соответственно) амфотерны. Существует водородное соединение алюминия – гидрид алюминия AlH3 (алан) – белый порошок.
По распространённости в земной коре алюминий занимает 4-е место (после О, Si, Н). Основная масса алюминия сосредоточена в алюмосиликатах. Продуктом разрушения алюмосиликатов является глина, она состоит из каолинита – Al2O3 • 2SiO2 • 2H2O. Обычно глина содержит примесь соединений железа, придающую ей бурый цвет. Из других минералов наибольшее распространение имеет боксит – Al2O3 • nH2O.
АЛЮМИНИЙ – ПРОСТОЕ ВЕЩЕСТВО
Алюминий – серебристо-белый металл (на воздухе покрывается плотной тонкой плёнкой оксида), плотность 2,7 г/см 3 (лёгкий металл), легкоплавкий (t°пл. = 660 °С).
На воздухе алюминий покрывается прочной тончайшей (10 –8 м) защитной плёнкой оксида, которая препятствует проникновению кислорода к металлу и практически полностью прекращает дальнейшее окисление.
Алюминиевый порошок сгорает при нагревании в кислороде:
При окислении алюминия выделяется большое количество теплоты. Нагретый порошок алюминия при попадании в атмосферу кислорода реагирует с выделением огромного количества теплоты, достигается температура до 3000–3500 °С. Тепловой эффект реакции алюминия с кислородом чрезвычайно высок, образование этого соединения энергетически очень выгодно.
При нагревании алюминий легко реагирует с серой: 
Алюминиевый порошок легко реагирует с галогенами и сгорает в атмосфере хлора. Кусочек алюминия, с которого снята оксидная плёнка, бурно реагирует с бромом. Эти реакции идут без нагревания: 
Алюминиевый порошок реагирует с кристаллическим йодом, в присутствии катализатора (или при нагревании) выделяются капельки воды.
Алюминий без оксидной плёнки реагирует с азотом при сильном нагревании (800–1200 °С), образуя нитрид алюминия: 
При сильном нагревании (1500–1700 °С) алюминий реагирует с углеродом (графитом) с образованием карбида алюминия: 
Алюминий непосредственно не реагирует с водородом. Гидрид алюминия получают косвенным путём.
Алюминий энергично взаимодействует с водой, если механическим путём или амальгамированием снять предохраняющее действие оксидной плёнки: 
Вследствие высокого теплового эффекта соединения алюминия с кислородом алюминий активно восстанавливает многие металлы из оксидов (алюмотермия): 
При этом реакция обычно сопровождается выделением большого количества тепла и повышением температуры до 1200–3000 °С. Алюмотермия применяется в производстве марганца, хрома, ванадия, вольфрама, ферросплавов.
Как метод получения металлов, алюмотермия была предложена Н. Бекетовым в 1859 г. Её используют для получения многих металлов (Мп, Cr, V, W, Sr, Ва и др.).
Алюминий реагирует с галогеноводородными кислотами, разбавленной серной и азотной кислотами с образованием солей, в которых алюминий находится в катионной форме, и выделением водорода. Например: 
Алюминий не реагирует с азотной и серной концентрированными кислотами в обычных условиях. На поверхности алюминия образуется защитная оксидная плёнка, алюминий пассивируется. Алюминий реагирует с разбавленной азотной кислотой (2–3 моль/л) с образованием нитрата алюминия, нитрата аммония и воды: 
Алюминий активно взаимодействует с растворами щелочей. Щёлочи растворяют оксидную плёнку на поверхности алюминия. Образуются соли, в которых алюминий находится в анионной форме, и выделяется водород: 
Алюминий реагирует с растворами солей, восстанавливая катионы менее активных металлов (металлов, расположенных в ряду напряжений правее алюминия): 
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЛЮМИНИЯ
Основным сырьём для производства алюминия служат бокситы, содержащие 32–60% глинозёма Al2O3. Алюминий получают электролизом расплава глинозёма Al2O3 в расплавленном криолите Na3AlF6. В электролизёре находится 6–8% глинозёма и 92– 94% криолита. Криолит в ходе электролиза не расходуется. Его получают искусственным путём – взаимодействием Al(ОН)3, HF и Na2CO3.
На катоде происходит восстановление алюминия: Al 3+ + 3е – → Al 0 ,
на аноде – окисление его оксида: 2Al2О3 – 12е – → 4Al 3+ + 3O2↑,
а затем вторичная реакция на аноде: С + O2 → СO2 или 2С + O2 → 2СО
По широте применения сплавы алюминия занимают 2–е место после чугуна и стали. Алюминий – основа лёгких сплавов (например, дюралюмина, силумина), его применяют для производства различных ёмкостей и аппаратов, фольги и проволоки, в качестве раскислителя стали и восстановителя в алюмотермии. Высокая электропроводность и коррозионная стойкость позволяют применять aлюминий для изготовления электрических проводов, кабелей, конденсаторов. Лёгкость, коррозионная стойкость алюминия и относительная нетоксичность его соединений позволяют применять aлюминий для изготовления бытовой посуды, а алюминиевую фольгу – в пищевой и фармацевтической промышленности для упаковки продуктов и препаратов.
Из сплавов алюминия наиболее распространены дюралюмин, сокращённо – дюраль. Большую твёрдость дюралю по сравнению с чистым алюминием придают добавки меди, марганца и т. д. Дюралюмин – основной конструкционный материал в самолётостроении. Сплавы алюминия широко используются в автомобилестроении, судостроении, авиационной технике.
Конспект урока по химии «Алюминий: характеристика и свойства». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Алюминий. Химия алюминия и его соединений

Бинарные соединения алюминия
Алюминий
Положение в периодической системе химических элементов
Алюминий расположен в главной подгруппе III группы (или в 13 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение алюминия и свойства
Электронная конфигурация алюминия в основном состоянии :
+13Al 1s 2 2s 2 2p 6 3s 2 3p 1 1s  2s
2s  2p
2p  3s
3s  3p
3p 
Электронная конфигурация алюминия в возбужденном состоянии :
+13Al * 1s 2 2s 2 2p 6 3s 1 3p 2 1s  2s
2s  2p
2p  3s
3s  3p
3p 
Алюминий проявляет парамагнитные свойства. Алюминий на воздухе быстро образует прочные оксидные плёнки, защищающие поверхность от дальнейшего взаимодействия, поэтому устойчив к коррозии.
Физические свойства
Алюминий – лёгкий металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью.

Температура плавления 660 о С, температура кипения 1450 о С, плотность алюминия 2,7 г/см 3 .
Алюминий — один из наиболее ценных цветных металлов для вторичной переработки. На протяжении последних лет, цена на лом алюминия в пунктах приема непреклонно растет. По ссылке можно узнать о том, как сдать лом алюминия.
Нахождение в природе
Алюминий — самый распространенный металл в природе, и 3-й по распространенности среди всех элементов (после кислорода и кремния). Содержание в земной коре — около 8%.
В природе алюминий встречается в виде соединений:
Бокситы Al2O3 · H2O (с примесями SiO2, Fe2O3, CaCO3) — гидрат оксида алюминия.

Корунд Al2O3. Красный корунд называют рубином, синий корунд называют сапфиром.

Способы получения
Алюминий образует прочную химическую связь с кислородом. Поэтому традиционные способы получения алюминия восстановлением из оксида протекают требуют больших затрат энергии. Для промышленного получения алюминия используют процесс Холла-Эру. Для понижения температуры плавления оксид алюминия растворяют в расплавленном криолите (при температуре 960-970 о С) Na3AlF6, а затем подвергают электролизу с углеродными электродами. При растворении в расплаве криолита оксид алюминия распадается на ионы:
На катоде происходит восстановление ионов алюминия:
Катод: Al 3+ +3e → Al 0
На аноде происходит окисление алюминат-ионов:
Суммарное уравнение электролиза расплава оксида алюминия:
Лабораторный способ получения алюминия заключается в восстановлении алюминия из безводного хлорида алюминия металлическим калием:
AlCl3 + 3K → Al + 3KCl
Качественные реакции
Качественная реакция на ионы алюминия — взаимодействие избытка солей алюминия с щелочами . При этом образуется белый аморфный осадок гидроксида алюминия.
Например , хлорид алюминия взаимодействует с гидроксидом натрия:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl

При дальнейшем добавлении щелочи амфотерный гидроксид алюминия растворяется с образованием тетрагидроксоалюмината:
Обратите внимание , если мы поместим соль алюминия в избыток раствора щелочи, то белый осадок гидроксида алюминия не образуется, т.к. в избытке щелочи соединения алюминия сразу переходят в комплекс:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
Соли алюминия можно обнаружить с помощью водного раствора аммиака. При взаимодействии растворимых солей алюминия с водным раствором аммиака также в ыпадает полупрозрачный студенистый осадок гидроксида алюминия.
AlCl3 + 3NH3·H2O = Al(OH)3 ↓ + 3NH4Cl
Al 3+ + 3NH3·H2O = Al(OH)3 ↓ + 3NH4 +
Видеоопыт взаимодействия раствора хлорида алюминия с раствором аммиака можно посмотреть здесь.
Химические свойства
1. Алюминий – сильный восстановитель . Поэтому он реагирует со многими неметаллами .
1.1. Алюминий реагируют с галогенами с образованием галогенидов:
1.2. Алюминий реагирует с серой с образованием сульфидов:
1.3. Алюминий реагируют с фосфором . При этом образуются бинарные соединения — фосфиды:
Al + P → AlP
1.4. С азотом алюминий реагирует при нагревании до 1000 о С с образованием нитрида:
2Al + N2 → 2AlN
1.5. Алюминий реагирует с углеродом с образованием карбида алюминия:
1.6. Алюминий взаимодействует с кислородом с образованием оксида:
Видеоопыт взаимодействия алюминия с кислородом воздуха (горение алюминия на воздухе) можно посмотреть здесь.
2. Алюминий взаимодействует со сложными веществами:
2.1. Реагирует ли алюминий с водой? Ответ на этот вопрос вы без труда найдете, если покопаетесь немного в своей памяти. Наверняка хотя бы раз в жизни вы встречались с алюминиевыми кастрюлями или алюминиевыми столовыми приборами. Такой вопрос я любил задавать студентам на экзаменах. Что самое удивительное, ответы я получал разные — у кого-то алюминий таки реагировал с водой. И очень, очень многие сдавались после вопроса: «Может быть, алюминий реагирует с водой при нагревании?» При нагревании алюминий реагировал с водой уже у половины респондентов))
Тем не менее, несложно понять, что алюминий все-таки с водой в обычных условиях (да и при нагревании) не взаимодействует. И мы уже упоминали, почему: из-за образования оксидной пленки . А вот если алюминий очистить от оксидной пленки (например, амальгамировать), то он будет взаимодействовать с водой очень активно с образованием гидроксида алюминия и водорода:
2Al 0 + 6 H2 + O → 2 Al +3 ( OH)3 + 3 H2 0

Амальгаму алюминия можно получить, выдержав кусочки алюминия в растворе хлорида ртути ( II ):
3HgCl2 + 2Al → 2AlCl3 + 3Hg

Видеоопыт взаимодействия амальгамы алюминия с водой можно посмотреть здесь.
2.2. Алюминий взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой). При этом образуются соль и водород.
Например , алюминий бурно реагирует с соляной кислотой :
2Al + 6HCl = 2AlCl3 + 3H2↑

2.3. При обычных условиях алюминий не реагирует с концентрированной серной кислотой из-за пассивации – образования плотной оксидной пленки. При нагревании реакция идет, образуются оксид серы (IV), сульфат алюминия и вода:
2.4. Алюминий не реагирует с концентрированной азотной кислотой также из-за пассивации.
С разбавленной азотной кислотой алюминий реагирует с образованием молекулярного азота:
При взаимодействии алюминия в виде порошка с очень разбавленной азотной кислотой может образоваться нитрат аммония:
2.5. Алюминий – амфотерный металл, поэтому он взаимодействует с щелочами . При взаимодействии алюминия с раствором щелочи образуется тетрагидроксоалюминат и водород:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑

Видеоопыт взаимодействия алюминия со щелочью и водой можно посмотреть здесь.
Алюминий реагирует с расплавом щелочи с образованием алюмината и водорода:
2Al + 6NaOH → 2Na3AlO3 + 3H2 ↑
Эту же реакцию можно записать в другом виде (в ЕГЭ рекомендую записывать реакцию именно в таком виде):
2Al + 6NaOH → 2NaAlO2 + 3H2↑ + 2Na2O
2.6. Алюминий восстанавливает менее активные металлы из оксидов . Процесс восстановления металлов из оксидов называется алюмотермия .
Например , алюминий вытесняет медь из оксида меди (II). Реакция очень экзотермическая:
2Al + 3CuO → 3Cu + Al2O3

Еще пример : алюминий восстанавливает железо из железной окалины, оксида железа (II, III):
Восстановительные свойства алюминия также проявляются при взаимодействии его с сильными окислителями: пероксидом натрия, нитратами и нитритами в щелочной среде, перманганатами, соединениями хрома (VI):
Химические свойства алюминия ⚗ строение атома, обозначение, степень окисления, физические свойства, способы получения и применения, с какими веществами взаимодействует
Абросимова Елена Владимировна учитель химии и биологии
- Главная
- Рабочие программы
- УЧЕНИКАМ
НАВИГАЦИЯ
Алюминий. Строение атома алюминия. Физические и химические свойства простого вещества.
Элементы г лавной подгруппы III группы периодической системы:
бор (В),алюминий (А l ), галлий ( Ga ), индий ( In ) и таллий (Т l ).
Открытие металлов главной подгруппы III группы
Бор представляет собой неметалл. Алюминий — переходный металл, а галлий, индий и таллий — полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются.
Рассмотрим подробнее свойства алюминия.
1. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления.
Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная масса Ar ( Al ) = 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными.
Al 0 – 3 e – → Al +3 Алюминий проявляет в соединениях степень окисления +3:
2. Физические свойства алюминия
Алюминий в свободном виде — серебристо-белый металл, обладающий высокой тепло- и электропроводностью. Температура плавления 650 о С. Алюминий имеет невысокую плотность (2,7 г/см 3 ) — примерно втрое меньше, чем у железа или меди, и одновременно — это прочный металл.
3. Нахождение в природе
По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14 % от массы земной коры.
В природе алюминий встречается только в соединениях (минералах).
Некоторые из них:
4. Химические свойства алюминия и его соединений
Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы).
I . Взаимодействие с простыми веществами – неметаллами
- Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды.
- при нагревании он взаимодействует с серой (200 °С) 2А l + 3 S = А l 2 S 3 (сульфид алюминия),
- азотом (800 °С) 2А l + N2 = 2А lN (нитрид алюминия),
- фосфором (500 °С) А l + Р = А l Р (фосфид алюминия)
- углеродом (2000 °С) 4А l + 3С = А l 4С3 (карбид алюминия)
- с йодом в присутствии катализатора – воды (видео)2Аl + 3 I 2 = 2 A lI3 (йодид алюминия)
Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана:
В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты:
4А l + 3 O 2 = 2А l 2О3 + 1676 кДж.
II . Взаимодействие алюминия со сложными веществами
- Взаимодействие с водой :
2Al + 6H2O = 2 Al(OH)3 + 3H 2 без оксидной пленки!!
- Взаимодействие с оксидами металлов:
Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др.
Термитная смесь Fe3O4 и Al (порошок) –используется ещё и в термитной сварке.
- Взаимодействие с кислотами, например с раствором серной кислоты с образованием соли и водорода:
2 Al + 3 H2SO4 = Al2(SO4)3 + 3 H2
С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода:
- Взаимодействие алюминия с щелочами ( видео) .
2 Al + 2 NaOH + 6 H 2 O = 2 Na [ Al ( OH )4] + 3 H 2
Na [А l (ОН)4] – тетрагидроксоалюминат натрия
По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов.
- Взаимодействие алюминия с растворами солей :
Если поверхность алюминия потереть солью ртути, то происходит реакция:
2 Al + 3 HgCl 2 = 2 AlCl 3 + 3 Hg
Выделившаяся ртуть растворяет алюминий, образуя амальгаму.
5. Применение алюминия и его соединений: РИСУНОК 1 и РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди.
Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных.
Оксид алюминия используется для получения алюминия, а также как огнеупорный материал.
Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сока.
Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии.
Таким образом, сульфат алюминия является коагулянтом.
6. Получение алюминия
1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6 растворяет Al2O3, как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия – электролитом.
В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век – век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес.
- Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием.
- В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия.
- К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами.
- А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка.
- При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета “Сатурн” сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер.
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе?
№2. Закончите уравнения химических реакций :
Al + H2SO4 (раствор) →
Алюминий (Al)
Алюминий (квасцы) впервые был полуен в 1825 году датчанином Г. К. Эрстедом. Изначально, до открытия промышленного способа получения, алюминий был дорооже золота.
Алюминий является самым распространенным металлом в земной коре (массовая доля составляет 7-8%), и третьим по распространенности среди всех элементов после кислорода и кремния. В свободном виде в проироде алюминий не встречается.
Важнейшие природные соединения алюминия:
Рис. Строение атома алюминия.
Алюминий химически активный металл – на его внешнем электронном уровне находятся три электрона, которые участвуют в образовании ковалентных связей при взаимодействии алюминия с другими химическими элементами (см. Ковалентная связь). Алюминий – сильный восстановитель, во всех соединениях проявляет степень окисления +3.
При комнатной температуре алюминий вступает в реакцию с кислородом, содержащимся в атмосферном воздухе, с образованием прочной оксидной пленки, которая надежно препятствует процессу дальнейшего окисления (корродирования) металла, в результате чего химическая активность алюминия снижается.
Благодаря оксидной пленке алюминий не вступает в реакцию с азотной кислотой при комнатной температуре, поэтому, алюминиевая посуда является надежной тарой для хранения и трансопртирования азотной кислоты.
Физические свойства алюминия:
- металл серебристо-белого цвета;
- твердый;
- прочный;
- легкий;
- пластичный (протягивается в тонкую проволоку и фольгу);
- обладает высокой электро- и теплопроводностью;
- температура плавления 660°C
- природный алюминий состоит из одного изотопа 27 13Al
Химические свойства алюминия:
- при снятии оксидной пленки алюминий реагирует с водой:
2Al + 6H2O = 2Al(OH)3 + 3H2; - при комнатной температуре вступает в реакции с бромом и хлором с образованием солей:
2Al + 3Br2 = 2AlCl3; - при высокой температуре алюминий реагирует с кислородом и серой (реакция сопровождается выделением большого кол-ва тепла):
4Al + 3O2 = 2Al2O3 + Q;
2Al + 3S = Al2S3 + Q; - при t=800°C реагирует с азотом:
2Al + N2 = 2AlN; - при t=2000°C реагирует с углеродом:
2Al + 3C = Al4C3; - восстанавливает многие металлы из их оксидов – алюмотермией (при t до 3000°C) получают промышленным способом вольфрам, ванадий, титан, кальций, хром, железо, марганец:
8Al + 3Fe3O4 = 4Al2O3 + 9Fe; - с соляной и разбавленной серной кислотой реагирует с выделением водорода:
2Al + 6HCl = 2AlCl3 + 3H2;
2Al + 3H2SO4 = Al2(SO4)3 + 3H2; - с концентрированной серной кислотой реагирует при высокой температуре:
2Al + 6H2SO4 = Al2(SO4)3 + 3SO2 + 6H2O; - со щелочами реагирует с выделением водорода и образованием комплексных солей – реакция идет в несколько этапов: при погружении алюминия в раствор щелочи происходит растворение прочной защитной оксидной пленки, которая находится на поверхности металла; после растворения пленки, алюминий, как активиный металл, реагирует с водой с образованием гидроксида алюминия, который взаимодействует со щелочью, как амфотерный гидроксид:
- Al2O3+2NaOH = 2NaAlO2+H2O – растворение оксидной пленки;
- 2Al+6H2O = 2Al(OH)3+3H2↑ – взаимодействие алюминия с водой с образованием гидроксида алюминия;
- NaOH+Al(OH)3 = NaAlO2+2H2O – взаимодействие гидроксида алюминия со щелочью
- 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ – суммарное уравнение реакции алюминия со щелочью.
Соединения алюминия
Al2O3 (глинозем)
Оксид алюминия Al2O3 является белым, очень тугоплавким и твердым веществом (в природе тверже только алмаз, карборунд и боразон).
Свойства глинозема:
- не растворяется в воде и вступает с ней в реакцию;
- является амфотерным веществом, реагируя с кислотами и щелочами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 6NaOH + 3H2O = 2Na3[Al(OH)6]; - как амфотерный оксид реагирует при сплавлении с оксидами металлов и солями, образуя алюминаты:
Al2O3 + K2O = 2KAlO2.
В промышленности глинозем получают из бокситов. В лабораторных условиях глинозем можно получить сжигая алюминий в кислороде:
4Al + 3O2 = 2Al2O3.
Применение глинозема:
- для получения алюминия и электротехнической керамики;
- в качестве абразивного и огнеупорного материала;
- в качестве катализатора в реакциях органического синтеза.
Al(OH)3
Гидроксид алюминия Al(OH)3 является белым твердым кристаллическим веществом, которое получается в результате обменной реакции из раствора гидроксида алюминия – выпадает в виде белого студенистого осадка, кристаллизующегося со временем. Это амфотерное соединение почти не растворимое в воде:
Al(OH)3 + 3NaOH = Na3[Al(OH)6];
Al(OH)3 + 3HCl = AlCl3 + 3H2O.
- взаимодействие Al(OH)3 с кислотами:
Al(OH)3+3H + Cl = Al 3+ Cl3+3H2O - взаимодействие Al(OH)3 со щелочами:
Al(OH)3+NaOH – = NaAlO2 – +2H2O
Гидроксид алюминия получают путем действия щелочей на растворы солей алюминия:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl.
Получение и применение алюминия
Алюминий достаточно трудно выделить из природных соединений химическим способом, что объясняется высокой прочностью связей в оксиде алюминия, поэтому, для промышленного получения алюминия применяют электролиз раствора глинозема Al2O3 в расплавленном криолите Na3AlF6. В результате процесса алюминий выделяется на катоде, на аноде – кислород:
Исходным сырьем служат бокситы. Электролиз протекает при температуре 1000°C: температура плавления оксида алюминия составляет 2500°C – проводить электролиз при такой температуре не представляется возможным, поэтому оксид алюминия растворяют в расплавленном криолите, и уже затем полученный электролит используют при электролизе для получения алюминия.
Применение алюминия:
- алюминиевые сплавы широко применяются в качестве конструкционных материалов в автомобиле-, самолето-, судостроении: дюралюминий, силумин, алюминиевая бронза;
- в химической промышленности в качестве восстановителя;
- в пищевой промышленности для изготовления фольги, посуды, упаковочного материала;
- для изготовления проводов и проч.
Если вам понравился сайт, будем благодарны за его популяризацию  Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:

Код кнопки: 
Политика конфиденциальности Об авторе
Физические и химические свойства алюминия
Атомная масса – 27 а.е.м. Электронная конфигурация внешнего энергетического уровня – 3s 2 3p 1 . В своих соединениях алюминий проявляет степень окисления равную «+3».
Химические свойства алюминия
Алюминий в реакциях проявляет восстановительные свойства. Поскольку при пребывании на воздухе на его поверхности образуется оксидная пленка, устойчив к взаимодействию с другими веществами. Например, алюминий пассивируется в воде, концентрированной азотной кислоте и растворе дихромата калия. Однако, после удаления с его поверхности оксидной пленки способен взаимодействовать с простыми веществами. Большинство реакций протекает при нагревании:
2Al + 3F2 = 2AlF3 (t );
);
2Alpowder + 3Hal2 = 2AlHal3 (t  = 25
= 25 C);
C);
2Al + N2 = 2AlN (t );
);
2Al +3S = Al2S3 (t );
);
4Al + 3Cgraphite = Al4C3 (t );
);
4Al + P4 = 4AlP (t , в атмосфере Н2).
, в атмосфере Н2).
Также, алюминий после удаления с его поверхности оксидной пленки способен взаимодействовать с водой с образованием гидроксида:
Алюминий проявляет амфотерные свойства, поэтому он способен растворяться в разбавленных растворах кислот и щелочах:
Алюмиотермия – способ получения металлов из их оксидов, основанный на восстановлении этих металлов алюминием:
Физические свойства алюминия
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот. Температура плавления – 660,37 С, кипения – 2500
С, кипения – 2500 С.
С.
Получение и применение алюминия
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3[AlF6] и Al2O3. Реакция протекает при нагревании до 960 С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий нашел широкое применение в промышленности, так, сплавы на основе алюминия – основные конструкционные материалы в самолето- и судостроении.
Примеры решения задач
| Задание | при взаимодействии алюминия с серной кислотой образовался сульфат алюминия массой 3,42 г. Определите массу и количество вещества алюминия, вступившего в реакцию. |
| Решение | Запишем уравнение реакции: |
Молярные массы алюминия и сульфата алюминия, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 27 и 342 г/моль, соответственно. Тогда, количество вещества образовавшегося сульфата алюминия будет равно:
Согласно уравнению реакции n(Al2(SO4)3): n(Al) = 1:2, следовательно n(Al) = 2×n(Al2(SO4)3 ) = 0,02 моль. Тогда, масса алюминия будет равна:
m(Al) = 0,02×27 = 0,54 г.
| Задание | Какую массу алюминия необходимо взять для получения 15,2 г хрома из оксида хрома (III) алюмотермическим способом? |
| Решение | Запишем уравнение реакции получения хрома алюмотермическим способом из его оксида: |
Молярные массы алюминия и хрома, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 27 и 52 г/моль, соответственно. Тогда, количество вещества образовавшегося хрома будет равно:
n(Cr) = 15,2 / 52 = 0,29 моль.
Согласно уравнению реакции n(Cr): n(Al) = 2:2, следовательно n(Al) = n(Cr) = 0,29 моль. Тогда, масса алюминия будет равна:


