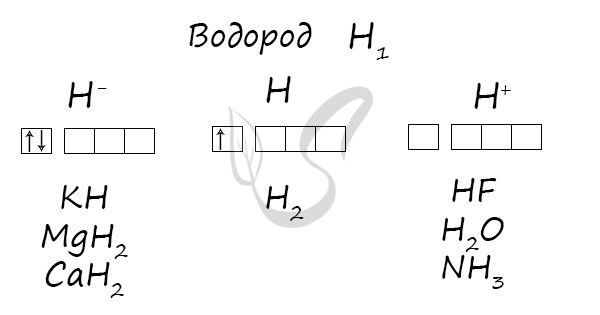
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s 
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
вода H2O и др. летучие водородные соединения (HCl, HBr)
кислые соли (NaHCO3 и др.)
основания NaOH, Cu(OH)2
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом кремния:
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:

Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водород
Водород (лат. hydrogenium = греч. ὕδωρ — вода + γεννάω — рождаю) – самый легкий химический элемент, при обычных условиях – газ без цвета, запаха и вкуса. В соединении с кислородом образует воду.
Водород – самый распространенный элемент Вселенной, входит в состав всего живого и небесных тел (73% массы Солнца).

Степени окисления
Проявляет степени окисления: -1, 0, +1.
Получение
В промышленности водород получают различными методами:
-
Конверсия с водяным паром при t = 1000 °C
Методом газификации угля, торфа, сланца
Электролизом водных растворов щелочей
Каталитическим окислением кислородом (неполное окисление)

Лабораторные методы традиционно отличаются от промышленных своей простотой. В лаборатории водород получают:
-
Вытеснением водорода из кислот
Взаимодействием активных металлов с водой
Реакцией цинка или алюминия с раствором щелочи
Химические свойства
В реакциях водород проявляет себя как восстановитель и окислитель. Как восстановитель реагирует с элементами, электроотрицательность которых выше, чем у водорода:
Как восстановитель реагирует с кислородом, галогенами, азотом, серой, оксидами металлов. При комнатной температуре из перечисленных реакция идет только со фтором.
H2 + F2 → HF (со взрывом в темноте)
H2 + Cl2 → (t) HCl (со взрывом только на свету)

Na + H2 → NaH (гидрид натрия)
Химические свойства:
-
Реакция с металлами
Металлы, стоящие в ряду активности до водорода, вытесняют водород из воды.
Реакции с основными и кислотными оксидами
Реагирует с основными оксидами – с образованием оснований (реакция идет, если основание растворимо), и с кислотными оксидами – с образованием соответствующих кислот. Не забывайте сохранять степени окисления!
Отмечу здесь реакцию двойного гидролиза, которая заключается в гидролизе одной соли по катиону (CrBr3), а другой – по аниону (Na2CO3).
Реакция с гидридами активных металлов
Реакции с C, CO, CH4
Cl2 + H2O → HCl + HClO (соляная и хлорноватистая кислоты – без нагревания)
Cl2 + H2O → HCl + HClO3 (соляная и хлорноватая кислоты – при нагревании)

Кристаллогидраты
Кристаллогидраты – кристаллические соединения, содержащие молекулы воды как самостоятельные структурные единицы. Вода, входящая в состав кристаллогидратов, называется кристаллической. Примеры: CaSO4*2H2O, Na2SO4*10H2O.
При нагревании кристаллогидраты теряют воду. Одним из наиболее известных кристаллогидратов является медный купорос: CuSO4*5H2O. Медный купорос имеет характерный голубой цвет, а безводный сульфат меди – белый.

В задачах бывает дана масса медного купороса. Надо помнить о том, что часто в реакции не участвует кристаллическая вода. В таком случае следует вычесть кристаллизационную воду и найти массу безводного сульфата калия.

Пероксид водорода
Представляет собой бесцветную жидкость с металлическим вкусом. Концентрированные растворы пероксида водорода взрывоопасны.
Получают пероксид водорода в реакции с пероксидами и супероксидами металлов.
В разбавленных растворах пероксид водорода легко разлагается:
Также перекись проявляет окислительные свойства:
Перекисью водорода обрабатывают раневую поверхность. Выделяющийся при разложении атомарный кислород разрушает бактериальные клетки, предотвращая осложнение в виде бактериальной инфекции.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Сложные эфиры — номенклатура, получение, химические свойства. Жиры. Мыла

Важнейшими представителями сложных эфиров являются жиры.
Жиры, масла
Жиры – это сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общее название таких соединений – триглицериды или триацилглицерины, где ацил – остаток карбоновой кислоты -C(O)R. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой C15H31COOH, стеариновой C17H35COOH) и ненасыщенных (олеиновой C17H33COOH, линолевой C17H31COOH). Высшие карбоновые кислоты, которые входят в состав жиров имеют всегда четное количество атомов углерода (С8 – С18) и неразветвленный углеводородный остаток. Природные жиры и масла – это смеси глицеридов высших карбоновых кислот.
Состав и строение жиров могут быть отражены общей формулой:

Этерификация — реакция образования сложных эфиров.

В состав жиров могут входить остатки как предельных, так и непредельных карбоновых кислот в различных сочетаниях.
В обычных условиях жиры, содержащие в своем составе остатки непредельных кислот, чаще всего бывают жидкими. Их называют маслами. В основном, это жиры растительного происхождения — льняное, конопляное, подсолнечное и другие масла (исключения пальмовое и кокосовое масла – твердые в обычных условиях). Реже встречаются жидкие жиры животного происхождения, например рыбий жир. Большинство природных жиров животного происхождения при обычных условиях – твердые (легкоплавкие) вещества и содержат в основном остатки предельных карбоновых кислот, например бараний жир.
Состав жиров определяет их физические и химические свойства.
Физические свойства жиров
Жиры нерастворимы в воде, не имеют четкой температуры плавления и значительно увеличиваются в объеме при плавлении.
Агрегатное состояние жиров твердое, это связано с тем, что в состав жиров входят остатки предельных кислот и молекулы жиров способны к плотной упаковке. В состав масел, входят остатки непредельных кислот в cis – конфигурации, следовательно плотная упаковка молекул невозможна, и агрегатное состояние – жидкое.
Химические свойства жиров
Жиры (масла) являются сложными эфирами и для них характерны реакции сложных эфиров.
Понятно, что для жиров, содержащих остатки ненасыщенных карбоновых кислот, характерны все реакции непредельных соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Наиболее важная в практическом плане реакция – гидрирование жиров. Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция лежит в основе получения маргарина — твердого жира из растительных масел. Условно этот процесс можно описать уравнением реакции:

Все жиры, как и другие сложные эфиры, подвергаются гидролизу:

Гидролиз сложных эфиров- обратимая реакция. Чтобы сместить равновесие в сторону образования продуктов гидролиза, его проводят в щелочной среде (в присутствие щелочей или Na2CO3). В этих условиях гидролиз жиров протекает обратимо, и приводит к образованию солей карбоновых кислот, которые называются мылами. Гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла – натриевые и калиевые соли высших карбоновых кислот:
Омыление – щелочной гидролиз жиров, получение мыла.

Мыла – смеси натриевых (калиевых) солей высших предельных карбоновых кислот (натриевое мыло – твердое, калиевое — жидкое).
Мыла являются поверхностно-активными веществами (сокращенно: ПАВами, детергентами). Моющее действие мыла связано с тем, что мыла эмульгируют жиры. Мыла образуют мицеллы с загрязняющими веществами (условно — это жиры с различными включениями).
Липофильная часть молекулы мыла растворяется в загрязняющем веществе, а гидрофильная часть оказывается на поверхности мицеллы. Мицеллы заряжены одноименно, следовательно отталкиваются, при этом загрязняющее вещество и вода превращается в эмульсию (практически – это грязная вода).

В воде также происходит гидролиз мыла, при этом создается щелочная среда.
Мыла нельзя использовать в жесткой и морской воде, так как образующиеся при этом стеараты кальция (магния) в воде нерастворимы.
Сложные эфиры: строение, изомерия и номенклатура
Сложные эфиры карбоновых кислот: Строение
Сложные эфиры являются производными карбоновых кислот, в молекулах которых группа -ОН (в карбоксильной группе) замещена на спиртовый остаток –O-R:
![]()
Общая формула сложных эфиров карбоновых кислот R–COOR’, где R и R’ — углеводородные радикалы. В сложных эфирах муравьиной кислоты R – это атом водорода.
Общая формула сложных эфиров предельных одноосновных карбоновых кислот, имеющих в качестве спиртового остатка предельные одноатомные спирты совпадает с общей формулой карбоновых кислот: CnH2nO2 или СnH2n+1-COO-СnH2n+1
Например, молекула метилацетата выглядит следующим образом:
![]()
Сложные эфиры карбоновых кислот: Классификация
Сложные эфиры карбоновых кислот можно разделить на три группы.
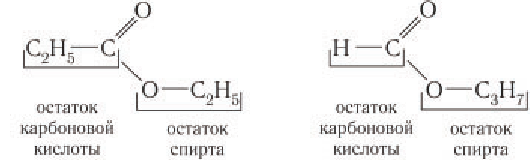
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами. Например, этилацетат, метилпропионат, пропилформиат:
![]()
- Сложные эфиры, образованные высшими карбоновыми кислотами и высшими одноосновными спиртами (воски).
Воски делятся на:
- Растительные, например, пальмовый воск, японский воск
- Животные, например, пчелиный воск, шерстяной (шерстный) воск – ланолин, кожное сало, ушная сера.
- Ископаемые, например, торфяной воск, буроугольный воск (монтан-воск) горный, воск (озокерит).
- Синтетические, например, канифоль — хрупкая стекловидная прозрачная масса.
Например, пчелиный воск – сложный эфир пальмитиновой кислоты и мирицилового спирта; кашалотовый воск (спермацет) сложный эфир пальмитиновой кислоты и цетилового спирта:
![]()
- Сложные эфиры, образованные трехатомным спиртом глицерином и высшими карбоновыми кислотами (жиры). См. раздел Жиры: Строение, получение, химические свойства
Сложные эфиры карбоновых кислот: Изомерия и номенклатура
Изомерия сложных эфиров карбоновых кислот
Для сложных эфиров характерны изомерия углеродной цепи, положения сложноэфирной группировки, и межклассовая виды изомерии. Для сложных эфиров, образованных непредельной кислотой или непредельным спиртом, возможна пространственная изомерия (цис- , транс-изомерия) и изомерия положения кратной связи.
- Изомерияуглеродной цепи может наблюдаться по кислотному остатку, начиная с бутановой кислоты, и по спиртовому остатку, начиная с пропилового спирта. Например, сложный эфир с брутто формулой С5H10O2 может иметь такие изомеры, как: метиловый эфир бутановой (масляной) кислоты, бутирату, метиловый эфир изобутановой (изомасляной) кислоты, пропиловый эфир уксусной кислоты и изопропиловый эфир уксусной кислоты изомерны метилизобутират, пропилацетат и изопропилацетат.
![]()
- Изомерияположения сложноэфирной группировки наблюдается у сложных эфиров, состоящих не мене чем из 4 атомов углерода, например этиловый эфир пропановой кислоты и метиловый эфир бутановой (масляной) кислоты.
![]()
- Межклассовая изомерия. Сложные эфиры изомерны карбоновым кислотам, например, изомерами являются метиловый эфир уксусной кислоты (метилацетат) и пропановая кислота.
![]()
- Изомерия положения кратной связи. Например, метиловый эфир 2-пентеновой кислоты и метиловый эфир 3-пентеновой кислоты:
![]()
- Пространственная цис-, транс-изомерия. Например, метиловый эфир цис-2-бутеновой кислоты и метиловый эфир транс-2-бутеновой кислоты:
![]()
Номенклатура сложных эфиров карбоновых кислот
Согласно систематической номенклатуры ИЮПАК названия сложных эфиров строятся исходя из названий двух остатков: спиртового и кислотного. К названию спиртового остатка прибавляют название кислотного остатка и суффикс –оaт, например:
![]()
Согласно тривиальной номенклатуры названия сложных эфиров строятся исходя из названий образующих его кислот и спиртов с добавлением слова эфир. Например:
![]()
Кроме этого, название сложного эфира может быть построено из названий кислотной и спиртовой частей, добавляя окончание «ый» и слово «эфир». Например, приведенное в примере соединение по этому правилу можно назвать маслянопропиловый эфир.
Сложные эфиры – формула, свойства, способы получения
Процесс получения сложных эфиров носит название реакции этерификации. Эта реакция с использованием общих формул описывается уравнением
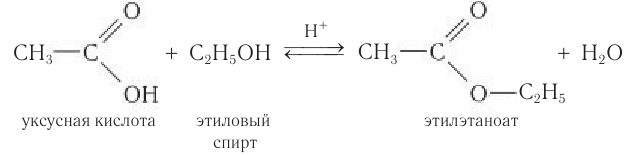
Именно реакцией этерификации в 1759 г. в результате взаимодействия уксусной кислоты с этиловым спиртом был получен первый сложный эфир — этиловый эфир уксусной кислоты:
Обратите внимание на то, как строится название сложного эфира. Оно состоит из четырёх слов, указывающих на название углеводородного радикала и исходной кислоты. Например, продукт взаимодействия муравьиной кислоты с метиловым спиртом — метиловый эфир муравьиной кислоты:
Катион водорода в схеме реакции указывает на то, что реакция этерификации протекает в присутствии кислоты в качестве катализатора.
Сложные эфиры с небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с характерным, часто приятным запахом. Они нерастворимы в воде, но прекрасно растворяют различные органические вещества.
Реакции этерификации обратимы. В присутствии кислот сложные эфиры разлагаются водой — гидролизуются, что можно рассматривать как реакцию, обратную их получению:
В присутствии щелочей гидролиз сложных эфиров необратим, так как образующаяся кислота связывается щёлочью с образованием соли, неспособной вступать в реакцию со спиртом:
Нахождение в природе и применение сложных эфиров
Сложные эфиры широко распространены в природе. Неповторимый аромат цветов и фруктов часто обусловлен присутствием веществ именно этого класса. Сложные эфиры с большой молекулярной массой представляют собой твёрдые вещества — воски. Пчелиный воск — это смесь сложных эфиров, образованных карбоновыми кислотами и спиртами с длинными углеводородными цепями.
Синтетические сложные эфиры используют в пищевой промышленности в качестве добавок для придания фруктовых запахов напиткам и кондитерским изделиям. Благодаря хорошей растворяющей способности сложные эфиры входят в состав растворителей лаков и красок.
Жиры, их строение и свойства
Люди стали использовать жиры в повседневной жизни значительно раньше, чем задумались об их химическом строении. Животные и растительные жиры — важные компоненты пищи. Жиры необходимы для построения клеточных мембран и как источник энергии, поскольку калорийность жиров в 2 раза выше, чем других питательных веществ — углеводов и белков. У позвоночных животных жиры откладываются в жировой ткани, сосредоточенной в основном в подкожной жировой клетчатке и сальнике. В растениях жиры содержатся в сравнительно небольших количествах, за исключением семян масличных растений, в которых содержание жиров может быть более 50%.
Жиры используют не только в пищевой промышленности. Их используют в качестве смазки, косметических и лекарственных средств, для приготовления масляных красок и олифы.
В 1779 г. шведский химик К. Шееле получил из оливкового масла вязкую жидкость, сладкую на вкус, — простейший трёхатомный спирт глицерин. Вскоре выяснилось, что глицерин входит в состав молекул любых жиров. Позднее французский химик М. Шеврёль доказал, что, помимо глицерина, при нагревании жиров в присутствии кислоты образуются и карбоновые кислоты.
| Жиры представляют собой сложные эфиры трёхатомного спирта глицерина и высших карбоновых кислот. |
Общую формулу жиров можно представить в следующем виде: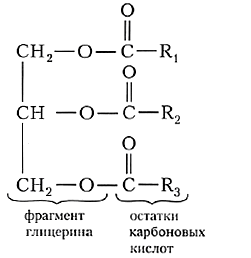
В состав жиров чаще всего входят остатки карбоновых кислот, содержащих чётное число атомов углерода и неразветвлённую углеродную цепь. Наиболее часто в составе жиров встречаются остатки пальмитиновой, стеариновой и олеиновой кислот. В одной молекуле кислотные остатки могут быть различными, поэтому в общей формуле жиров углеводородные радикалы R обозначены разными цифрами.
Сравните состав стеариновой (С17Н35СООН) и олеиновой (С17Н33СООН) кислот. У стеариновой кислоты углеводородный радикал отвечает формуле СnН2n+1, т. е. является предельным. Следовательно, стеариновая кислота относится к предельным карбоновым кислотам. В углеводородном радикале олеиновой кислоты на два атома водорода меньше, поскольку в нём содержится одна двойная углерод-углеродная связь. Олеиновая кислота относится к непредельным карбоновым кислотам.
Жиры животного происхождения имеют твёрдую консистенцию (есть и исключения, например жидкий рыбий жир). В состав молекул твёрдых жиров входят остатки предельных кислот. Растительные жиры, которые часто называют растительными маслами, образованы остатками непредельных кислот, имеют жидкую консистенцию (исключение — твёрдое пальмовое масло). Кстати, название олеиновой кислоты произошло от латинского слова oleum — масло.
Жиры гидрофобны, т. е. нерастворимы в воде, но хорошо растворяются в органических растворителях: этиловом спирте, гексане, тетрахлорметане.
Жиры проявляют все характерные для сложных эфиров химические свойства. Главное из них — это гидролиз. Молекулы воды атакуют связи между кислотным остатком и фрагментом глицерина, в результате чего происходит распад молекулы жира:
Для жира, образованного стеариновой кислотой (такое вещество называют тристеаратом глицерина), уравнение реакции гидролиза выглядит следующим образом: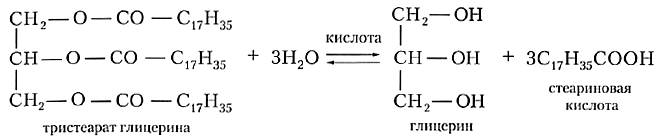
В качестве катализатора гидролиза жиров выступают кислоты. Такой гидролиз так и называют — кислотный гидролиз. Жирные руки трудно отмыть холодной водой, но стоит только протереть их ломтиком лимона, как они становятся заметно чище. Даже при таком непродолжительном контакте с лимонной кислотой жир частично гидролизуется.
Гидролиз жиров в присутствии щелочей называют щелочным гидролизом: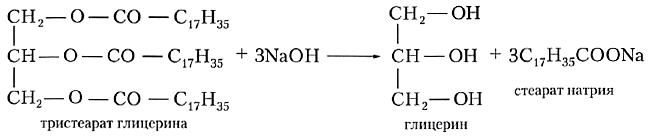
Щёлочь действует как катализатор, а также связывает образующиеся кислоты, превращая их в соли карбоновых кислот. Соли не способны вступать в реакцию этерификации с глицерином, и гидролиз становится необратимым. Неслучайно бытовые средства для удаления жира и засоров в раковинах более чем наполовину состоят из щёлочи.
Щелочной гидролиз жиров называют также омылением. Это название обусловлено тем, что образующиеся при этом натриевые и калиевые соли высших карбоновых кислот являются мылами.
Твёрдые жиры животного происхождения более ценны и дорогостоящи, чем жидкие растительные масла. Можно ли превратить жидкий жир в твёрдый химическим путём? Если вы вспомните, что растительные масла, в отличие от животных жиров, содержат остатки непредельных кислот, то нетрудно догадаться: гидрированием двойных связей С=С растительные масла превращают в аналог твёрдых жиров. Полученный продукт называют саломасом, его используют для приготовления маргарина и других продуктов питания: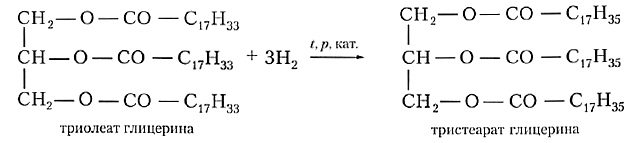
Подобный процесс в больших масштабах проводят на жировых комбинатах.
Двойные связи непредельных кислот в жидких жирах сохраняют способность к реакциям полимеризации. Это свойство используют при изготовлении олифы — натуральной (на основе льняного или конопляного масла) или синтетической. При нанесении на деревянную поверхность олифа под действием кислорода воздуха полимеризуется с образованием прочной защитной плёнки. Олифу используют и при изготовлении и разбавлении масляных красок.
Справочная таблица «Сложные эфиры»

Конспект урока по химии «Сложные эфиры. Жиры». В учебных целях использованы цитаты из пособия «Химия. 10 класс : учеб, для общеобразоват. организаций : базовый уровень / О. С. Габриелян, И. Г. Остроумов, С. А. Сладков. — М. : Просвещение». Выберите дальнейшее действие:
- Вернуться к Списку конспектов по химии
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
Сложные эфиры


Средняя оценка: 4.6
Всего получено оценок: 358.
Средняя оценка: 4.6
Всего получено оценок: 358.
Производные карбоновых или неорганических кислот, в которых атом водорода в гидроксильной группе замещён радикалом, называются сложными эфирами. Обычно общую формулу сложных эфиров обозначают как два углеводородных радикала, присоединённых к карбоксильной группе – CnH2n+1-COO-CnH2n+1 или R-COOR’.
Номенклатура
Названия сложных эфиров составляются из названий радикала и кислоты с суффиксом «-ат». Например:
- CH3COOH – метилформиат;
- HCOOCH3 – этилформиат;
- CH3COOC4H9 – бутилацетат;
- CH3-CH2-COO-C4H9 – бутилпропионат;
- CH3-SO4-CH3 – диметилсульфат.
Также используются тривиальные названия кислоты, входящей в состав соединения:
- С3Н7СООС5Н11 – амиловый эфир масляной кислоты;
- HCOOCH3 – метиловый эфир муравьиной кислоты;
- CH3-COO-CH2-CH(CH3)2 – изобутиловый эфир уксусной кислоты.
Классификация
В зависимости от происхождения сложные эфиры делятся на две группы:
- эфиры карбоновых кислот – содержат углеводородные радикалы;
- эфиры неорганических кислот – включают остаток минеральных солей (C2H5OSO2OH, (CH3O)P(O)(OH)2, C2H5ONO).
Наиболее разнообразны сложные эфиры карбоновых кислот. От сложности строения зависят их физические свойства. Эфиры низших карбоновых кислот – летучие жидкости с приятным ароматом, высших – твёрдые вещества. Это плохо растворимые соединения, плавающие на поверхности воды.
Виды сложных эфиров карбоновых кислот приведены в таблице.
Описание
Примеры
Жидкости, молекулы которых включают не более восьми атомов углерода. Обладают фруктовым ароматом. Состоят из одноатомных спиртов и карбоновых кислот
Жидкие (масла) и твёрдые вещества, содержащие от девяти до 19 атомов углерода. Состоят из глицерина и остатков карбоновых (жирных) кислот
Оливковое масло – смесь глицерина с остатками пальмитиновой, стеариновой, олеиновой, линолевой кислот
Твёрдые вещества с 15-45 атомами углерода
Сложные эфиры карбоновых кислот – главная составляющая ароматных эфирных масел, которые содержатся в плодах, цветах, ягодах. Также входят в состав пчелиного воска.
Получение
Получают сложные эфиры несколькими способами:
-
реакцией этерификации карбоновых кислот со спиртами:
Свойства
Химические свойства сложных эфиров обусловлены функциональной группой -COOH. Основные свойства сложных эфиров описаны в таблице.
Реакция
Описание
Уравнение
При нагревании в воде разлагаются на кислоту и спирт. Под действием раствора щёлочи образуются соль и спирт
Реакция возможна при наличии кратных связей
Радикалы замещаются остатками спиртов и аминогруппой
Сложные эфиры используются в косметологии, медицине, пищевой промышленности в качестве ароматизаторов, растворителей, наполнителей.

Что мы узнали?
Из темы урока химии 10 класса узнали, что такое сложные эфиры. Это соединения, включающие два радикала и карбоксильную группу. В зависимости от происхождения могут содержать остатки минеральных или карбоновых кислот. Сложные эфиры карбоновых кислот делятся на три группы: жиры, воски, фруктовые эфиры. Это плохо растворимые в воде вещества с небольшой плотностью и приятным ароматом. Сложные эфиры реагируют со щелочами, водой, галогенами, спиртами и аммиаком.
Сложные эфиры в химии – свойства, формула, получение, номенклатура и определение с примерами
Содержание:
- Общая формула сложных эфиров
- Номенклатура и изомерия сложных эфиров
- Физические свойства сложных эфиров
- Получение и химические свойства сложных эфиров
- Химические свойства сложных эфиров
- Применение сложных эфиров
- Полиэфирные волокна. Лавсан
Сложные эфиры:
Строение: Сложные эфиры рассматривают как функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа, входящая в состав карбоксильной группы, замещена остатком спирта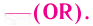
Многочисленные природные и синтетические сложные эфиры являются производными различных по строению и составу карбоновых кислот и спиртов.
Общая формула сложных эфиров
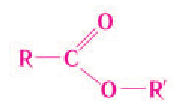
Символами 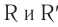 обозначены любые углеводородные заместители (в сложных эфирах метановой кислоты
обозначены любые углеводородные заместители (в сложных эфирах метановой кислоты 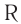 — атом водорода), например:
— атом водорода), например:
Сложные эфиры содержат функциональную группу — 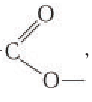 которую называют сложноэфирной.
которую называют сложноэфирной.
Общая формула, отражающая молекулярный состав сложных эфиров, производных насыщенных одноосновных карбоновых кислот и насыщенных одноатомных спиртов, свойства которых вы будете изучать, — 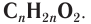
Номенклатура и изомерия сложных эфиров
Названия сложных эфиров по правилам номенклатуры ИЮПАК производят от названия алкильной группы, входящей в состав спирта, и названия кислоты, заменяя суффикс -овая на суффикс -оат.
Правилами ИЮПАК допускаются и тривиальные названия сложных эфиров, которые образуются от названия спирта, затем указывается слово «эфир» и далее приводится название кислоты. Например:
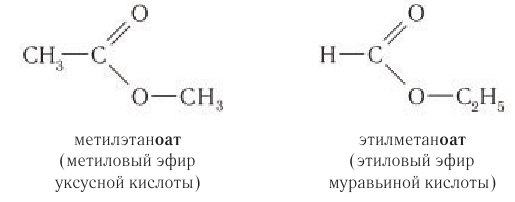
Названия сложных эфиров по номенклатуре ИЮПАК и их тривиальные названия приведены в таблице 28.
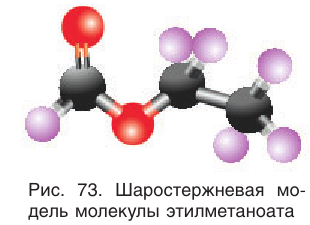
На рисунке 73 представлена модель молекулы этилметаноата.
Для сложных эфиров возможно существование структурной изомерии внутри класса.
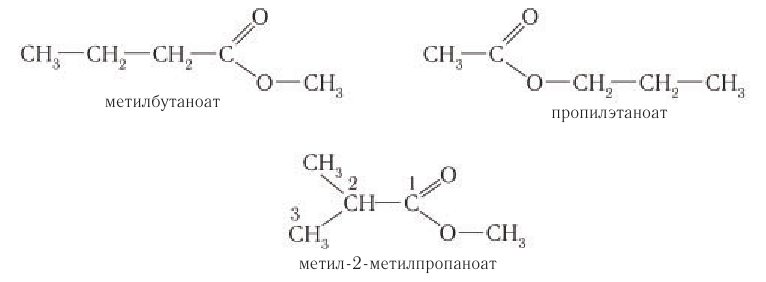
Например, составу 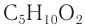 соответствуют следующие изомеры:
соответствуют следующие изомеры:
Физические свойства сложных эфиров
Сложные эфиры, образованные низшими карбоновыми кислотами и низшими спиртами, — летучие, малорастворимые или практически нерастворимые в воде жидкости. Они хорошо растворимы в большинстве органических растворителей. Физические свойства некоторых сложных эфиров приведены в таблице 28. Анализируя данные таблицы 28, обратите внимание на различие физических свойств изомерных эфиров.
Таблица 28. Физические свойства некоторых сложных эфиров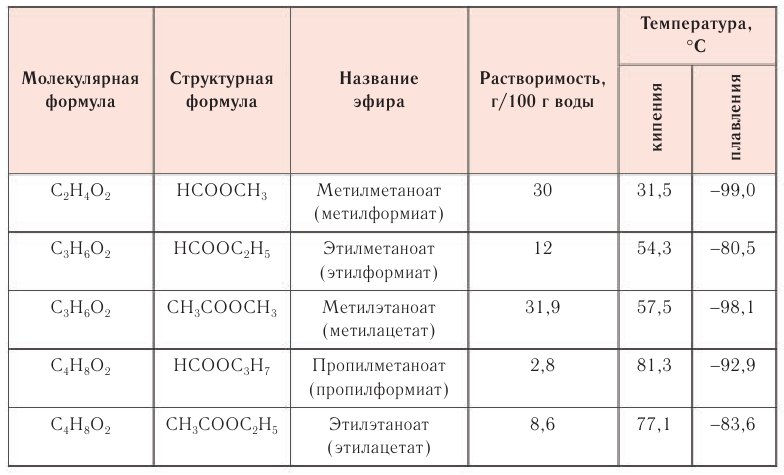
Многие эфиры имеют приятный запах, часто напоминающий запах фруктов или цветов. Например, запах ананаса имеет бутиловый эфир бутановой кислоты, запах груши — изоамиловый эфир этановой кислоты, запах яблок — изопентиловый эфир изовалериановой кислоты, абрикосами пахнет пентиловый эфир бутановой кислоты, запах жасмина напоминает бензиловый эфир этановой кислоты, а запах хризантем — бензиловый эфир метановой кислоты.
Низшие сложные эфиры находятся в ягодах, фруктах, цветах (рис. 74) и придают им аромат. Высшие сложные эфиры — это воски. Они имеют разное происхождение: животное (пчелиный воск, ланолин из овечьей шерсти), растительное (в виде защитной пленки на фруктах).
Основную часть пчелиного воска (более 70 %) составляет мирициловый эфир пальмитиновой кислоты 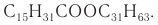
Сложные эфиры — это функциональные производные карбоновых кислот, в молекулах которых гидроксильная группа замещена на остаток спирта.
Общая формула сложных эфиров 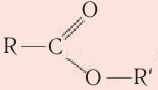 , где
, где  — углеводородные заместители. Сложные эфиры широко распространены в природе.
— углеводородные заместители. Сложные эфиры широко распространены в природе.
Получение и химические свойства сложных эфиров
Получение. Сложные эфиры получают в реакциях карбоновых кислот и спиртов в присутствии сильной минеральной кислоты 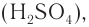 играющей роль катализатора. В процессе реакции от молекулы спирта отщепляется атом водорода, а от молекулы кислоты — гидроксильная группа, которые образуют молекулу воды:
играющей роль катализатора. В процессе реакции от молекулы спирта отщепляется атом водорода, а от молекулы кислоты — гидроксильная группа, которые образуют молекулу воды:
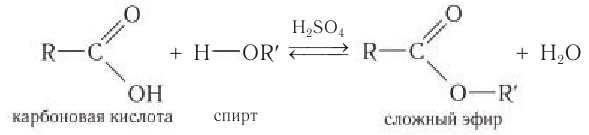
Реакцию образования сложного эфира называют реакцией этерификации (от лат. acfher — эфир). Термин «эфир» по отношению к рассматриваемым веществам впервые использовал К. Шееле в конце XVIII в.
Реакция этерификации — процесс обратимый. Поэтому при получении сложных эфиров в промышленных масштабах, для того чтобы сместить равновесие системы вправо и получить основной продукт, из реакционной смеси удаляют воду или эфир или используют избыток одного из реагентов.
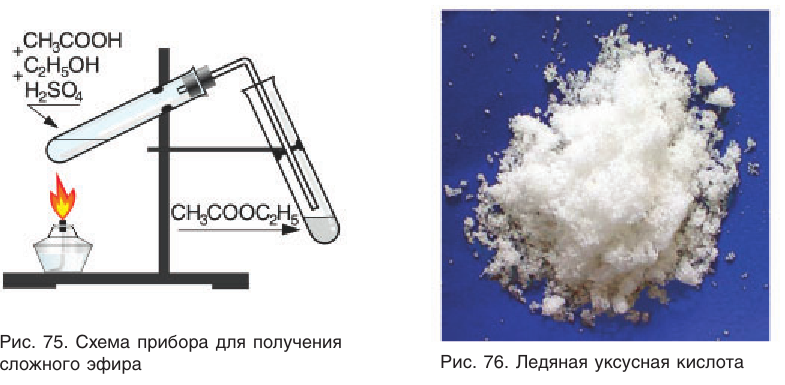
В лаборатории сложный эфир можно получить в приборе, показанном на рисунке 75. В пробирку помещается смесь раствора этанола (с массовой долей спирта 96 %), ледяной уксусной кислоты (рис. 76) и раствора серной кислоты (с массовой долей кислоты 80 %) в объемном соотношении 2 : 1 : 1. Пробирку со смесью осторожно нагревают. В результате реакции образуется небольшое количество сложного эфира этилэтаноата, который собирается в пробирке-приемнике при охлаждении:
Химические свойства сложных эфиров
Важнейшее химическое свойство сложных эфиров — способность к гидролизу в присутствии минеральной кислоты или щелочи.
При нагревании смеси сложного эфира с разбавленным раствором сильной минеральной кислоты происходит кислотный гидролиз. При гидролизе молекулы сложного эфира разрушаются и образуются карбоновая кислота и спирт, из которых был получен сложный эфир. Гидролиз в кислой среде обратим: 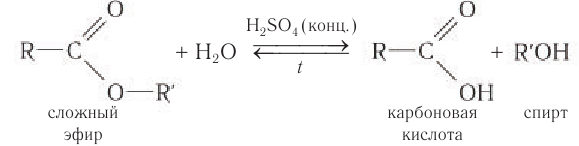
При щелочном гидролизе сложных эфиров образуются спирт и соль карбоновой кислоты. Реакция необратима:
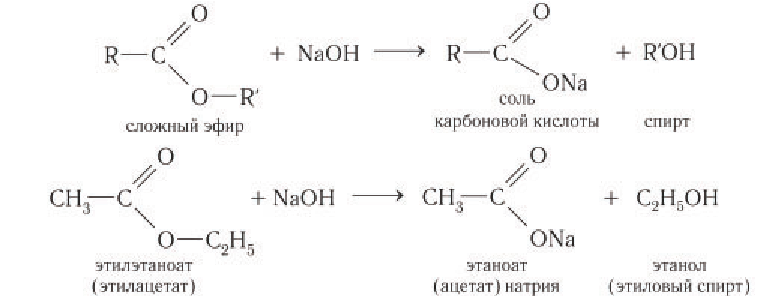
Образовавшийся спирт удаляют перегонкой, а соль карбоновой кислоты, при необходимости, действием сильной минеральной кислоты переводят в карбоновую кислоту: 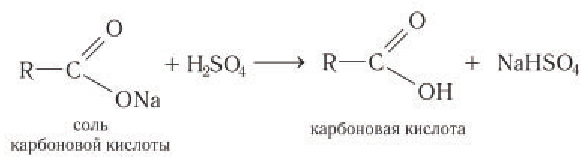
Применение сложных эфиров
Благодаря приятному запаху некоторые сложные эфиры составляют основу эссенций, которые используются при приготовлении фруктовых вод, кондитерских изделий, духов и т.д. Сложные эфиры также находят применение в лакокрасочной промышленности, в производстве искусственных волокон и некоторых полимерных материалов. Они применяются как растворители органических веществ при проведении химических реакций между ними.
Сложные эфиры образуются в результате реакции этерификации. Сложные эфиры гидролизуются растворами минеральных кислот и щелочей.
Сложные эфиры применяются в пищевой, парфюмерной, лакокрасочной промышленности.
Полиэфирные волокна. Лавсан
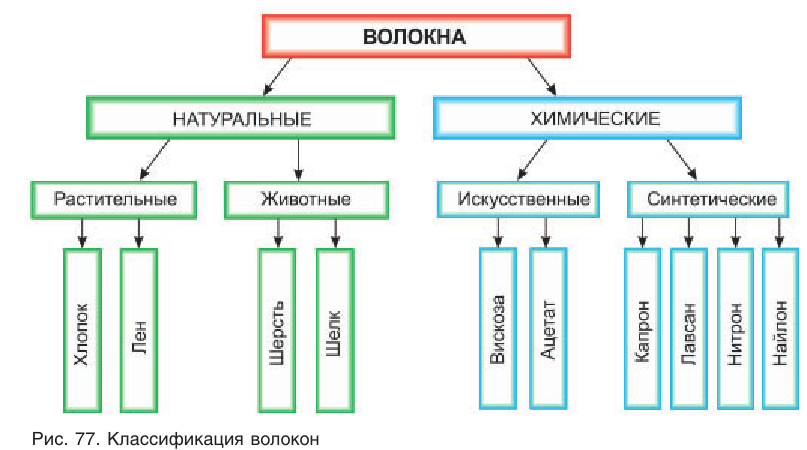
Для изготовления различного вида тканей используют волокна — тонкие непряденые нити. Различают природные (натуральные) и химические волокна (рис. 77). К природным волокнам относят хлопок, лен, натуральный шелк. Волокна, получаемые при химической переработке природных полимеров, называют искусственными. Примером таких волокон является ацетатное волокно, получаемое из целлюлозы. Волокна, получаемые из синтетических полимеров, называют синтетическими. Среди них большое распространение получили волокна на основе полиэфиров, одним из которых является волокно лавсан.
Синтетическое волокно лавсан получают на основе полиэфира полиэтилентерефталата, синтезируемого поликонденсацией терефталевой кислоты и этиленгликоля по следующей схеме:
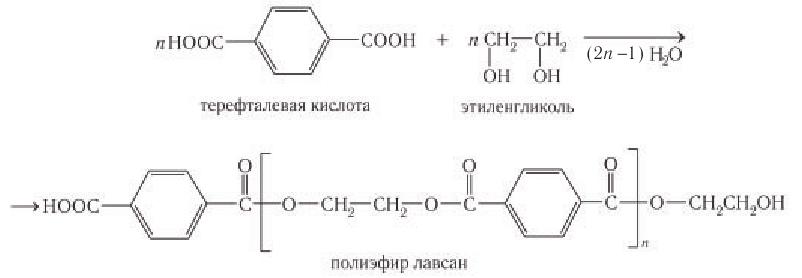
Схема получения полиэфира и его название приведены для ознакомления и не требуют запоминания.
Реакцией поликонденсации называют реакцию образования полимеров из мономеров, протекающую с выделением побочных низкомолекулярных продуктов (вода, хлороводород, аммиак).
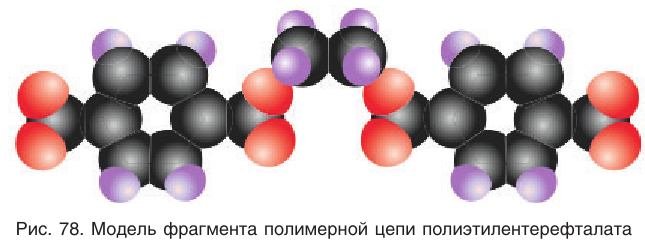
Двухатомный спирт этиленгликоль и двухосновная ароматическая кислота терефталевая взаимодействуют между собой по типу реакции этерификации, которая многократно повторяется, в результате образуется полиэфир и выделяется низкомолекулярный продукт вода. На рисунке 78 показана масштабная модель фрагмента полимерной цепи полиэфира.
Полиэфир получают в виде смолы. Макромолекулы в нем расположены беспорядочно, в волокне же они должны быть ориентированы вдоль его оси, чтобы волокно приобрело необходимую прочность. С этой целью на производстве используют специальную технологию, при которой из расплава полимера вытягивают тонкие нити волокна (рис. 79), называемого лавсаном. При этом происходит изменение в расположении макромолекул полимера, они ориентируются вдоль оси волокна и как бы выпрямляются. Волокна скручивают в нити, которые идут на производство различных тканей. В Республике Беларусь лавсан производят на ОАО «Могилевхимволокно» в Могилеве.
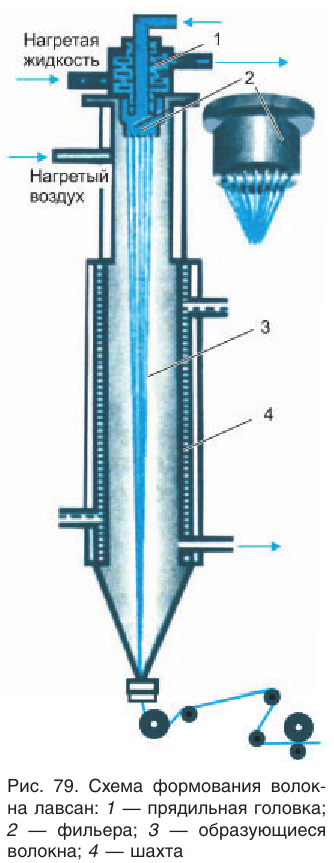
Волокно лавсан обладает такими важными положительными характеристиками, как износостойкость, свето- и термостойкость, прочность, устойчивость к растворам кислот и щелочей. На основе волокна лавсан изготавливают разнообразные ткани для пошива одежды, трикотажные изделия, тюль, технические ткани. Широко известны изделия из технической ткани на основе лавсана: пожарные рукава, транспортные ленты, канаты, паруса и т. д.
В то же время волокно лавсан не гигроскопично и способно накапливать статическое электричество при трении. Поэтому при производстве тканей, использующихся для пошива одежды, применяют волокно лавсан в смеси с природными волокнами, например шерстью, шелком или льном. В этом случае одежда приобретает прочность и износостойкость за счет лавсана и гигиеничность за счет волокна природного происхождения.
Различают волокна природные, искусственные и синтетические. Лавсан относится к синтетическим полиэфирным волокнам. Материалы, получаемые на основе полиэфирного волокна лавсан, широко используются в различных областях производства и жизнедеятельности человека.
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.





